17.3: indicateurs acide-Base
objectifs D’apprentissage
- expliquer la fonction et les changements de couleur des indicateurs acide-base
- démontrer comment sélectionner l’indicateur approprié pour une expérience de titrage
- déterminer les constantes de dissociation acide Ka ou kai des indicateurs.
Certaines substances organiques changer de couleur en solution diluée lorsque la concentration en ions hydronium atteint une valeur particulière., Par exemple, la phénolphtaléine est une substance incolore dans toute solution aqueuse avec une concentration en ions hydronium supérieure à 5,0 × 10-9 M (pH < 8,3). Dans les solutions plus basiques où la concentration en ions hydronium est inférieure à 5,0 × 10-9 M (pH > 8,3), il est Rouge ou rose. Des Substances telles que la phénolphtaléine, qui peuvent être utilisées pour déterminer le pH d’une solution, sont appelées indicateurs acido-basiques. Les indicateurs acido-basiques sont soit des acides organiques faibles, soit des bases organiques faibles.,
l’équilibre dans une solution de l’indicateur acido-basique d’orange méthylique, un acide faible, peut être représenté par une équation dans laquelle nous utilisons HIn comme représentation simple pour la molécule complexe d’orange méthylique:
\
\}{}}=4.0×10^{-4}\]
L’anion de l’orange méthylique, In−, est jaune, et la forme non ionisée, HIn, est Rouge. Lorsque nous ajoutons de l’acide à une solution d’orange méthylique, l’augmentation de la concentration en ions hydronium déplace l’équilibre vers la forme rouge non ionisée, conformément au principe de Le Chatelier. Si nous ajoutons la base, nous décalons l’équilibre vers la forme jaune., Ce comportement est complètement analogue à l’action des tampons.
La couleur d’un indicateur est le résultat visible du rapport des concentrations des deux espèces In− et HIn. Si la plupart de l’indicateur (généralement environ 60-90% ou plus) est présent comme In−, alors nous voyons la couleur de L’in− ion, qui serait jaune pour l’orange méthylique. Si most est présent sous forme de HIn, alors nous voyons la couleur de la molécule de HIn: rouge pour l’orange méthylique., Pour le méthyle orange, nous pouvons réorganiser l’équation pour Ka et à écrire:
\}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}\]
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:ou\:pH=p\mathit{K}_a+log\left(\dfrac{}{}\right)}\]
La dernière formule est la même que la zone Henderson-Hasselbalch équation, qui peut être utilisé pour décrire l’équilibre des indicateurs.,
Lorsque a la même valeur numérique que Ka, le rapport de to est égal à 1, ce qui signifie que 50% de l’indicateur est présent sous la forme rouge (HIn) et 50% est sous la forme ionique jaune (In−), et la solution apparaît de couleur orange. Lorsque la concentration en ions hydronium augmente à 8 × 10-4 m (un pH de 3,1), la solution devient rouge. Aucun changement de couleur n’est visible pour toute augmentation supplémentaire de la concentration en ions hydronium (diminution du pH). À une concentration d’ions hydronium de 4 × 10-5 m (un pH de 4.,4), la majeure partie de l’indicateur est sous forme ionique jaune, et une diminution supplémentaire de la concentration en ions hydronium (augmentation du pH) ne produit pas de changement de couleur visible. La plage de pH entre 3,1 (rouge) et 4,4 (Jaune) est l’intervalle de changement de couleur de l’orange méthylique; le changement de couleur prononcé a lieu entre ces valeurs de pH.
de Nombreuses substances peuvent être utilisés comme indicateurs, en fonction de la réaction à surveiller., Par exemple, le jus de chou rouge contient un mélange de substances colorées qui passent du rouge profond à faible pH au bleu clair à pH intermédiaire au jaune à pH élevé (Figure \(\PageIndex{1}\)). Dans tous les cas, cependant, un bon indicateur doit avoir les propriétés suivantes:
- Le changement de couleur doit être facilement détecté.
- Le changement de couleur doit être rapide.
- La molécule indicatrice ne doit pas réagir avec la substance titrée.
- Pour minimiser les erreurs, l’indicateur doit avoir un pKin qui se trouve à moins d’une unité de pH du pH attendu au point d’équivalence du titrage.,

le jus de chou rouge contient un mélange de substances dont la couleur dépend du pH. chaque tube à essai contient une solution de jus de chou rouge dans l’eau, mais le pH des solutions varie de pH = 2,0 (extrême gauche) à pH = 11,0 (extrême droite). À pH = 7,0, la solution est bleue.,
des indicateurs synthétiques ont été développés qui répondent à ces critères et couvrent pratiquement toute la gamme de pH. La Figure \(\PageIndex{2}\) montre la plage de pH approximative sur laquelle certains indicateurs communs changent de couleur et leur changement de couleur. De plus, certains indicateurs (tels que le bleu de thymol) sont des acides ou des bases polyprotiques, qui changent de couleur deux fois à des valeurs de pH largement séparées.
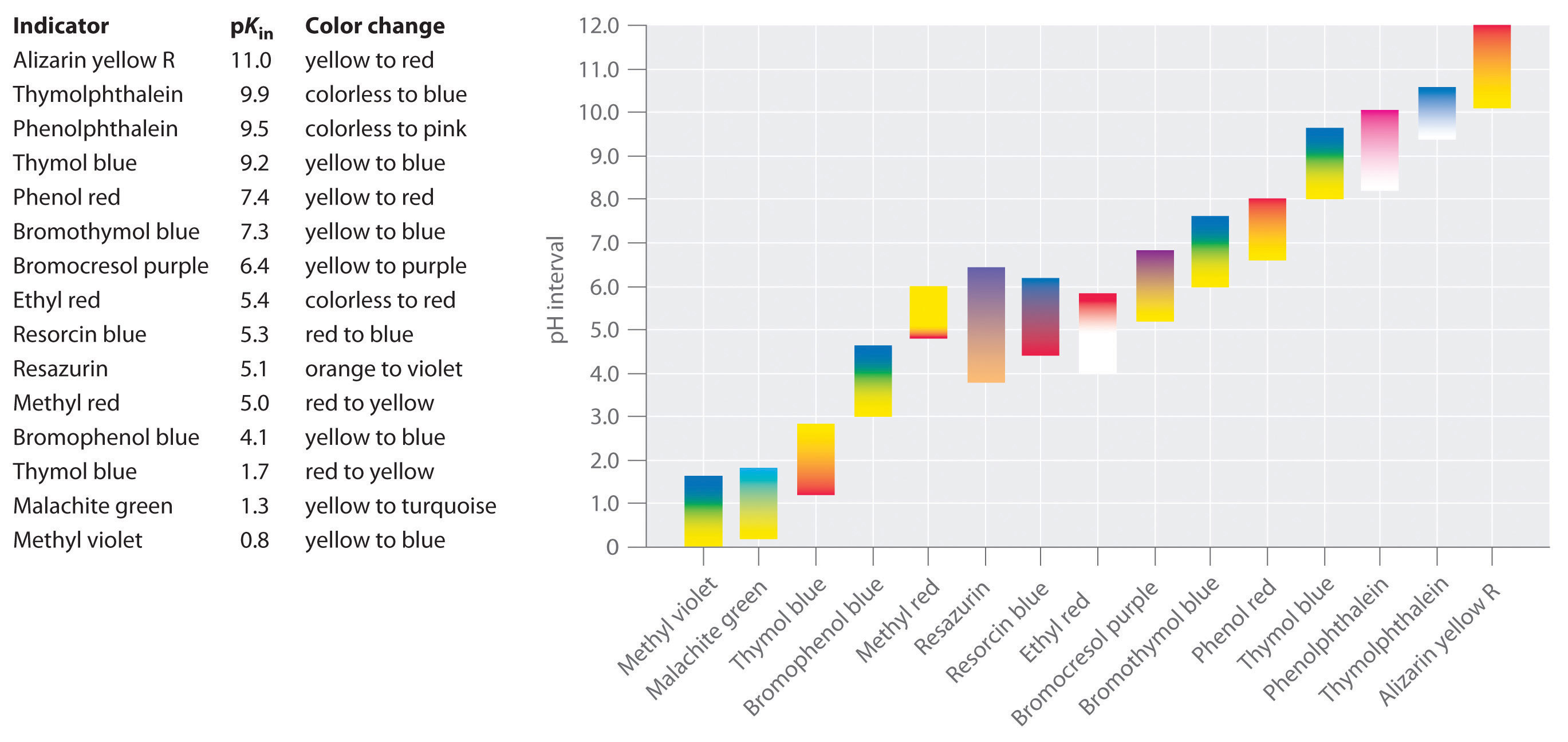
Il est important de savoir qu’un indicateur ne change pas brusquement de couleur à une valeur de pH particulière; au lieu de cela, il subit en fait un titrage de pH comme n’importe quel autre acide ou base. Comme la concentration de HIn diminue et la concentration En augmente, la couleur de la solution change lentement de la couleur caractéristique de HIn pour que de. Comme nous le verrons à la Section 16, le rapport / passe de 0.,1 à un pH d’une unité en dessous de pKin à 10 à un pH d’une unité au-dessus de pKin. Ainsi, la plupart des indicateurs changent de couleur sur une plage de pH d’environ deux unités de pH.
Nous avons déclaré qu’un bon indicateur devrait avoir une valeur pKin proche du pH attendu au point d’équivalence. Pour un titrage acide–base fort, le choix de l’indicateur n’est pas particulièrement critique en raison du très grand changement de pH qui se produit autour du point d’équivalence., En revanche, l’utilisation d’un mauvais indicateur pour un titrage d’un acide faible ou d’une base faible peut entraîner des erreurs relativement importantes, comme illustré à la Figure \(\PageIndex{3}\). Cette figure montre des graphiques du pH par rapport au volume de base ajouté pour le titrage de 50,0 mL d’une solution à 0,100 m d’un acide fort (HCl) et d’un acide faible (acide acétique) avec 0,100 M \(NaOH\). Les plages de pH sur lesquelles deux indicateurs communs (rouge méthylique, \(pK_{in} = 5.0\) et phénolphtaléine, \(pK_{in} = 9.5\)) changent de couleur sont également indiqués., Les barres horizontales indiquent les plages de pH sur lesquelles les deux indicateurs changent de couleur traversent la courbe de titrage HCl, où elle est presque verticale. Par conséquent, les deux indicateurs changent de couleur lorsque le même volume de \(NaOH\) a été ajouté (environ 50 mL), ce qui correspond au point d’équivalence. En revanche, le titrage de l’acide acétique donnera des résultats très différents selon que le rouge de méthyle ou la phénolphtaléine est utilisé comme indicateur., Bien que la plage de pH sur laquelle la phénolphtaléine change de couleur soit légèrement supérieure au pH au point d’équivalence du titrage acide fort, l’erreur sera négligeable en raison de la pente de cette partie de la courbe de titrage. Tout comme pour le titrage du HCl, l’indicateur de phénolphtaléine devient rose lorsqu’environ 50 mL de \(NaOH\) ont été ajoutés à la solution d’acide acétique. En revanche, le rouge de méthyle commence à passer du rouge au jaune autour du pH 5, qui est proche du point médian du titrage de l’acide acétique, et non du point d’équivalence., L’ajout d’environ 25 à 30 mL de \(NaOH\) entraînera donc un changement de couleur de l’indicateur rouge méthylique, ce qui entraînera une énorme erreur.
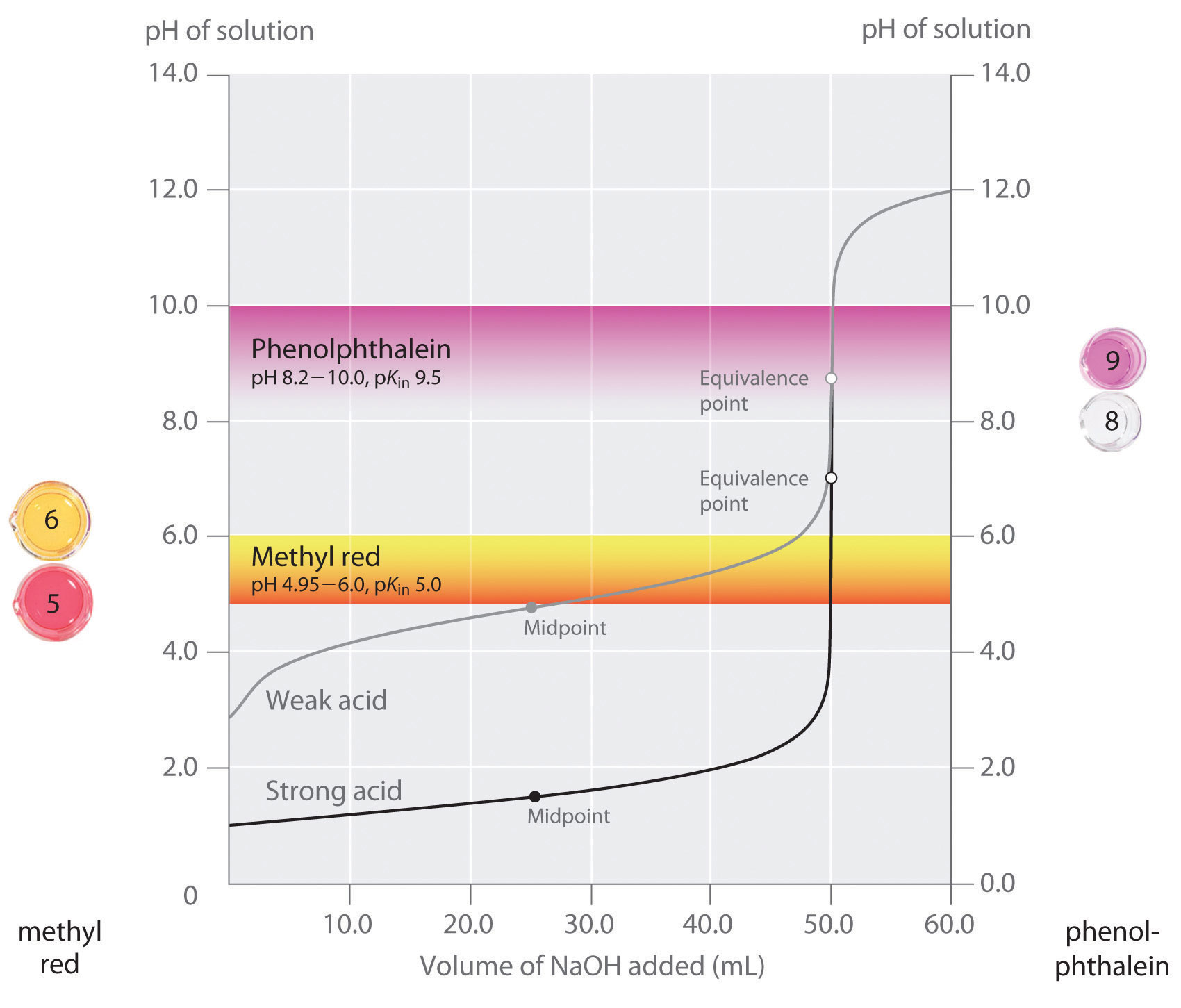
le graphique montre les résultats obtenus en utilisant deux indicateurs (rouge de méthyle et phénolphtaléine) pour le titrage de solutions à 0,100 m d’un acide fort (HCL) et d’un acide faible (acide acétique) avec 0,100 M \(NaOH\)., En raison de la pente de la courbe de titrage d’un acide fort autour du point d’équivalence, l’un ou l’autre indicateur changera rapidement de couleur au point d’équivalence pour le titrage de l’acide fort. En revanche, le pKin pour le rouge méthylique (5,0) est très proche du pKa de l’acide acétique (4,76); le point médian du changement de couleur pour le rouge méthylique se produit près du point médian du titrage, plutôt qu’au point d’équivalence.
en général, pour les titrages d’acides forts avec des bases fortes (et vice versa), tout INDICATEUR avec un pK compris entre environ 4,0 et 10,0 fera l’affaire., Pour le titrage d’un acide faible, cependant, le pH au point d’équivalence est supérieur à 7,0, donc un indicateur tel que la phénolphtaléine ou le bleu de thymol, avec pKin > 7,0, doit être utilisé. Inversement, pour le titrage d’une base faible, où le pH au point d’équivalence est inférieur à 7,0, un indicateur tel que le rouge de méthyle ou le bleu de bromocrésol, avec pKin < 7,0, doit être utilisé.
Exemple \(\PageIndex{1}\)
Dans le titrage d’un acide faible avec une base forte, qui indicateur serait le meilleur choix?,
- Orange de méthyle
- Vert bromocrésol
- phénolphtaléine
Solution
la bonne réponse est C. Dans le titrage d’un acide faible avec une base forte, la base conjuguée de l’acide faible rendra le pH au point d’équivalence supérieur à 7. Par conséquent, vous voudriez qu’un indicateur change dans cette plage de pH. L’orange méthylique et le vert bromocrésol changent de couleur dans une gamme de pH acide, tandis que la phénolphtaléine change dans un pH basique.,
l’existence de nombreux indicateurs différents avec différentes couleurs et valeurs de pKin fournit également un moyen pratique d’estimer le pH d’une solution sans utiliser un pH-mètre électronique coûteux et une électrode de pH fragile. Des bandes de papier ou de plastique imprégnées de combinaisons d’indicateurs sont utilisées comme « papier pH”, ce qui vous permet d’estimer le pH d’une solution en y plongeant simplement un morceau de papier pH et en comparant la couleur résultante avec les normes imprimées sur le récipient (Figure \(\PageIndex{4}\)).,
résumé
Les indicateurs acide–base sont des composés qui changent de couleur à un pH particulier., Ce sont généralement des acides ou des bases faibles dont les changements de couleur correspondent à la déprotonation ou à la protonation de l’indicateur lui-même.
contributeurs et Attributions
-
Paul Flowers (Université de Caroline du Nord – Pembroke), Klaus Theopold (Université du Delaware) et Richard Langley (Stephen F. Austin State University) avec des auteurs contributeurs. Le contenu du manuel produit par OpenStax College est sous licence Creative Commons Attribution License 4.0. Télécharger gratuitement à http://cnx.org/contents/85abf193-2bd…[email protected]).
- {modèle.,ContribBoundless()}}















