chimie pour les non-majeurs (Français)
objectifs D’apprentissage
- décrire les molécules dont les formes sont influencées par la théorie VSEPR.
- définir la paire Solitaire.
- décrivez comment les électrons de paires isolées influencent la géométrie moléculaire.
Comment fonctionne un électroscope travail?
un électroscope est un appareil utilisé pour étudier la charge. Lorsqu’un objet chargé positivement (la tige) s’approche du poteau supérieur, les électrons s’écoulent vers le haut du pot en laissant les deux feuilles d’or chargées postivley., Les feuilles se repoussent les unes les autres puisque les deux tiennent postive, comme des charges. La théorie VSEPR dit que les paires d’électrons, également un ensemble de charges similaires, se repousseront les unes les autres de sorte que la forme de la molécule s’ajustera de sorte que les paires d’électrons de valence restent aussi éloignées les unes des autres que possible.

Atome Central avec Pas de Lone Paires
afin de comprendre facilement les types de molécules possible, nous allons utiliser un système simple pour identifier les parties d’une molécule.,
A = centrale de l’atome dans une molécule
B = atomes entourant l’atome central
les Indices après le B désigne le nombre de B atomes qui sont reliés à la centrale d’Un atome. Par exemple, AB 4 est une molécule avec un atome central entouré de quatre atomes liés de manière covalente. Encore une fois, peu importe si ces obligations sont des obligations simples, doubles ou triples.
AB2: hydrure de béryllium (BeH2)
L’hydrure de béryllium est constitué d’un atome central de béryllium avec deux liaisons simples avec des atomes d’hydrogène. Rappelons qu’il viole la règle de l’octet.,
H-Be-H
selon l’exigence que les paires d’électrons maximisent leur distance l’une de l’autre, les deux paires de liaison dans les molécules BeH 2 s’arrangeront sur les côtés directement opposés de l’atome central Be. La géométrie résultante est une molécule linéaire, représentée sur la Figure 1 dans un modèle” balle et bâton ».

la Figure 1. Modèle d’hydrure de béryllium.
L’angle de liaison à partir de H-Be-H est de 180° en raison de sa géométrie linéaire.,
Le dioxyde de carbone est un autre exemple de molécule qui relève de la catégorie AB 2. Sa structure de Lewis est constituée de doubles liaisons entre le carbone central et les atomes d’oxygène (voir Figure 2).

la Figure 2. Liaison au dioxyde de carbone.
La répulsion entre les deux groupes de quatre électrons (deux paires) n’est pas différent de la répulsion des deux groupes de deux électrons (une paire) dans le BeH 2 molécule. Le dioxyde de carbone est également linéaire (voir Figure 3).,

la Figure 3. Carbonique.
AB3: trifluorure de bore (BF3)
le trifluorure de bore est constitué d’un atome central de bore avec trois liaisons simples avec des atomes de fluor (voir Figure 4). L’atome de bore a également un octet incomplet.
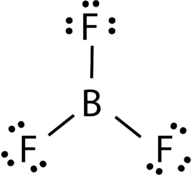
la Figure 4. Liaison au trifluorure de bore.
la géométrie de la molécule BF 3 est appelée plan trigonal (voir Figure 5). Les atomes de fluor sont positionnés aux sommets d’un triangle équilatéral., L’angle F-B-F est de 120° et les quatre atomes se trouvent dans le même plan.

la Figure 5. Le trifluorure de bore modèle.
AB4: le Méthane (CH4)
le Méthane est un composé organique qui est le principal composant du gaz naturel. Sa structure se compose d’un atome de carbone central avec quatre liaisons simples à des atomes d’hydrogène (voir Figure 6). Afin de maximiser leur distance les uns des autres, les quatre groupes d’électrons de liaison ne se trouvent pas dans le même plan., Au lieu de cela, chacun des atomes d’hydrogène se trouve aux coins d’une forme géométrique appelée tétraèdre. L’atome de carbone est au centre du tétraèdre. Chacune des faces d’un tétraèdre est un triangle équilatéral.

la Figure 6. Structure tétraédrique du méthane.
La géométrie moléculaire de la molécule de méthane est tétraédrique (voir la Figure 7). Les angles de Liaison H-C-H sont de 109,5°, ce qui est plus grand que les 90° qu’ils seraient si la molécule était plane., Lors du dessin d’une formule structurelle pour une molécule telle que le méthane, il est avantageux de pouvoir indiquer le caractère tridimensionnel de sa forme. La formule structurelle ci-dessous s’appelle un dessin en perspective. La liaison en pointillés doit être visualisée comme reculant dans la page, tandis que la liaison en triangle solide doit être visualisée comme sortant de la page.

la Figure 7. Le méthane point de vue du modèle.
Comment tous ces vêtements à tenir dans un si petit espace?,
lorsque nous voyageons, nous prenons souvent beaucoup plus de choses que nécessaire. Essayer de tout mettre dans une valise peut être un véritable défi. Nous devrons peut-être remballer ou tout simplement tout rentrer. Les atomes doivent souvent réorganiser où se trouvent les électrons afin de créer une structure plus stable.

Atome Central avec Un ou Plusieurs Lone Paires
Les géométries moléculaires des molécules changent lorsque l’atome central a un ou plusieurs lone paires d’électrons., Le nombre total de paires d’électrons, à la fois des paires de liaison et des paires solitaires, conduit à ce qu’on appelle la géométrie du domaine électronique. Lorsqu’une ou plusieurs des paires d’électrons de liaison sont remplacées par une paire unique, la géométrie moléculaire (forme réelle) de la molécule est modifiée. Conformément aux symboles A et B établis dans la section précédente, nous utiliserons E pour représenter une paire unique sur l’atome central (A). Un indice sera utilisé lorsqu’il y a plus d’une seule paire. Les paires isolées sur les atomes environnants (B) n’affectent pas la géométrie.,
AB3E: ammoniac, NH3
la molécule d’ammoniac contient trois liaisons simples et une seule paire sur l’atome d’azote central (voir Figure 8).

la Figure 8. Paire d’électrons isolés dans l’ammoniac.
la géométrie du domaine pour une molécule avec quatre paires d’électrons est tétraédrique, comme on l’a vu avec CH 4 . Dans la molécule d’ammoniac, l’une des paires d’électrons est une paire isolée plutôt qu’une paire de liaison. La géométrie moléculaire de NH 3 est appelée pyramidale trigonale (voir Figure 9).,

la Figure 9. Molécule d’ammoniac.
rappelons que l’angle de liaison dans la molécule tétraédrique CH 4 est de 109,5°. Encore une fois, le remplacement de l’une des paires d’électrons liées par une paire isolée comprime légèrement l’angle. L’angle H-N-H est d’environ 107°.
AB2E2: eau, H2O
Une molécule d’eau est constituée de deux paires de liaison et de deux paires isolées (voir Figure 10).

la Figure 10. Paire d’électrons solitaires sur l’eau.,
comme pour le méthane et l’ammoniac, la géométrie du domaine pour une molécule à quatre paires d’électrons est tétraédrique. Dans la molécule d’eau, deux des paires d’électrons sont des paires isolées plutôt que des paires de liaison. La géométrie moléculaire de la molécule d’eau est plié. L’angle de Liaison H-O-H est de 104,5°, ce qui est plus petit que l’angle de liaison dans le NH3 (voir Figure 11).

la Figure 11. La molécule d’eau.,
AB4E: tétrafluorure de soufre, SF4
la structure de Lewis pour SF 4 contient quatre liaisons simples et une paire unique sur l’atome de soufre (voir Figure 12).

la Figure 12. Paire d’électrons isolés dans SF4.
l’atome de soufre a cinq groupes d’électrons autour de lui, ce qui correspond à la géométrie du domaine bipyramidal trigonal, comme dans PCl 5 (Voir Figure 13). Rappelons que la géométrie bipyramidale trigonale a trois atomes équatoriaux et deux atomes axiaux attachés à l’atome central., En raison de la plus grande répulsion d’une paire Solitaire, c’est l’un des atomes équatoriaux qui sont remplacés par une paire Solitaire. La géométrie de la molécule est appelée tétraèdre déformé ou balançoire.

la Figure 13. Balle et bâton modèle pour SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- la présence d’électrons solitaires influence la forme tridimensionnelle de la molécule.
Pratique
Atome Central avec Pas de Lone Paires
Utiliser le lien ci-dessous pour répondre aux questions suivantes:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Quelle est la forme de PF 5 ?
- quels angles de DBO C-H prendrions-nous pour le méthane si la molécule était plane?
- Quelle molécule a la configuration d’un octaèdre?,
Atome Central avec Un ou Plusieurs Lone Paires
Utiliser le lien ci-dessous pour répondre aux questions suivantes:
- Quel est le principe général dans le traitement avec des molécules contenant plus de quatre paires d’électrons?
- dans l’image avec cinq paires d’électrons autour de l’atome central, pourquoi l’arrangement à droite est-il préféré?
- dans l’image avec six paires d’électrons, pourquoi la configuration avec les paires solitaires à 180o les unes par rapport aux autres est-elle plus stable?,
Examen
Atome Central avec Pas de Lone Paires
- Quels sont les angles de liaison dans le dioxyde de carbone?
- quelle molécule a des angles de liaison de 109,5 ° ?
- Quelle est la géométrie de la molécule BF 3?
Atome Central avec Un ou Plusieurs Lone Paires
- Pourquoi l’eau ont un penchant de la géométrie?
- pourquoi l’ammoniac n’est-il pas une molécule plane?
- Comment écririons – nous la configuration du tétrafluorure de xénon en utilisant le système ABE?















