17.3: acidobazické Indikátory
Vzdělávací Cíle
- vysvětlení funkce a barevné změny acidobazické indikátory
- Prokázat, jak vybrat správné ukazatele pro titrační experiment,
- Určení disociační konstanty Ka nebo Kai ukazatelů.
Některé organické látky mění barvu ve zředěném roztoku při vodíku koncentrace iontů dosáhne určité hodnoty., Například, fenolftalein je bezbarvá látka, v každém vodném roztoku se koncentrace iontů vodíku větší než 5,0 × 10-9 M (pH < 8.3). Ve více základních roztoků, kde koncentrace iontů vodíku je menší než 5,0 × 10-9 M (pH > 8.3), je červená nebo růžová. Látky, jako je fenolftalein, které lze použít k určení pH roztoku, se nazývají acidobazické ukazatele. Acidobazické ukazatele jsou buď slabé organické kyseliny nebo slabé organické báze.,
rovnováha v roztoku, acidobazické indikátor methyloranž, slabé kyseliny, může být reprezentován rovnicí do které používáme HIn jako jednoduchý zastoupení pro komplexní methyl orange molekuly:
\
\}{}}=4.0×10^{-4}\]
anion methyl orange, V−, je žlutá, a nonionized formě, HIn, je červená. Když přidáme kyselinu do roztoku methyloranže, zvýšená koncentrace iontů vodíku posouvá rovnováhu směrem k nonionized červená forma, v souladu s Le chatelierův princip. Pokud přidáme základnu, posuneme rovnováhu směrem k žluté formě., Toto chování je zcela analogické působení nárazníků.
barva indikátoru je viditelným výsledkem poměru koncentrací obou druhů v-a HIn. Pokud je většina indikátoru (obvykle asi 60-90% nebo více) přítomna jako V−, pak vidíme barvu in− ion, která by byla žlutá pro methyl oranžovou. Pokud je většina přítomna jako HIn,pak vidíme barvu molekuly HIn: červená pro methyl oranžovou., Pro methyl oranžovou, upravíme rovnice pro Ka a napsat:
\}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}\]
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:\: pH=p\mathit{K}_a+log\left(\dfrac{}{}\right)}\]
poslední vzorec je stejný jako Henderson-Hasselbalch rovnice, které mohou být použity k popisu rovnováhy ukazatelů.,
Když má stejnou číselnou hodnotu jako Ka, poměr k je rovno 1, což znamená, že 50% ukazatel je přítomen v červené formě (HIn) a 50% je v žluté iontové formě (V−), a řešení se objeví oranžové barvy. Když se koncentrace hydroniového iontu zvýší na 8 × 10-4 M (pH 3,1), roztok zčervená. Žádná změna barvy není viditelná pro další zvýšení koncentrace hydroniového iontu (snížení pH). Při koncentraci hydroniového iontu 4 × 10-5 M (pH 4.,4), většina ukazatel je v žluté iontové formě, a dále snížení koncentrace iontů vodíku (zvýšení pH) neprodukuje viditelné změně barvy. Rozsah pH mezi 3,1 (červená) a 4,4 (žlutá) je interval změny barvy methyl oranžové; výrazná změna barvy probíhá mezi těmito hodnotami pH.
jako indikátory lze použít mnoho různých látek v závislosti na konkrétní reakci, která má být sledována., Například, červené zelí šťáva obsahuje směs barevných látek, které se mění z tmavě červené na nízké pH, na světle modré na středně pokročilé pH na žlutou při vysokém pH (viz Obrázek \(\PageIndex{1}\)). Ve všech případech však musí mít dobrý indikátor následující vlastnosti:
- změna barvy musí být snadno detekována.
- změna barvy musí být rychlá.
- molekula indikátoru nesmí reagovat s titrovanou látkou.
- aby se minimalizovaly chyby, měl by mít indikátor pKin, který je v rámci jedné jednotky pH očekávaného pH v bodě ekvivalence titrace.,

Červené zelí šťáva obsahuje směs látek, jejichž barva závisí na pH. Každá zkumavka obsahuje roztok červené zelí šťávy ve vodě, ale pH roztoků se pohybuje od pH = 2.0 (zcela vlevo) na pH = 11.0 (úplně vpravo). Při pH = 7,0 je roztok modrý.,
byly vyvinuty syntetické indikátory, které splňují tato kritéria a pokrývají prakticky celý rozsah pH. Obrázek \(\PageIndex{2}\) ukazuje přibližný rozsah pH, ve kterém některé běžné indikátory mění barvu a jejich změnu barvy. Navíc některé ukazatele (jako je thymol modrá) jsou polyprotické kyseliny nebo báze, které mění barvu dvakrát při široce oddělených hodnotách pH.
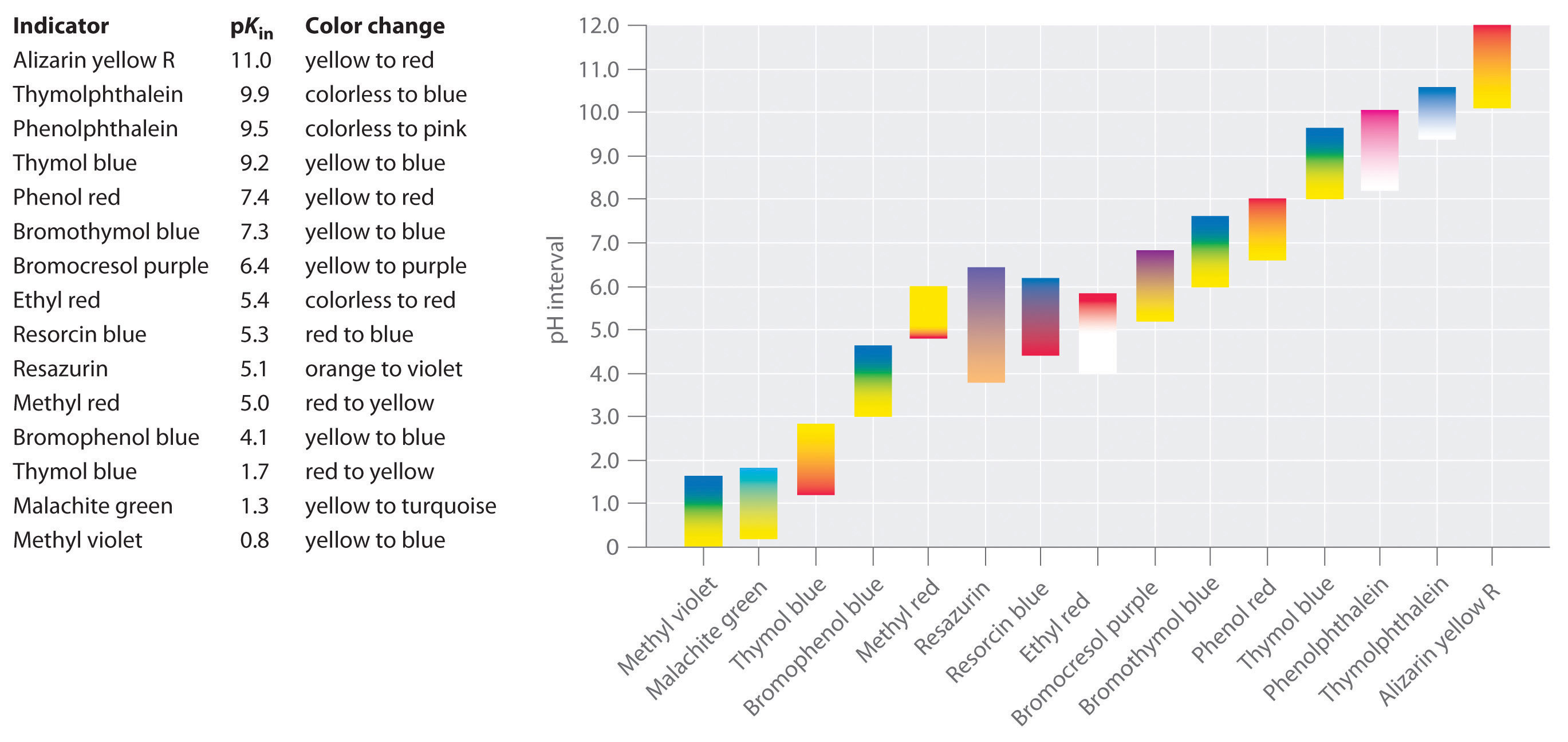
je důležité si uvědomit, že indikátor nezmění barvu náhle na určité hodnotě pH; místo toho, to vlastně prochází pH titrace, stejně jako jakékoliv jiné kyseliny nebo báze. Jako koncentrace HIn klesá a koncentrace V− zvyšuje, barva roztoku se pomalu mění z charakteristické barvy HIn se, že In−. Jak uvidíme v oddíle 16, poměr / se změní z 0.,1 při pH jedna jednotka pod pKin na 10 při pH jedna jednotka nad pKin. Většina indikátorů tedy mění barvu v rozmezí pH asi dvou jednotek pH.
uvedli jsme, že dobrý ukazatel by měl mít hodnotu pKin, která se blíží očekávanému pH v bodě ekvivalence. Pro silnou titraci kyseliny a silné báze není volba indikátoru zvlášť kritická kvůli velmi velké změně pH, ke které dochází kolem bodu ekvivalence., V kontrastu, použití nesprávné indikátor pro titraci slabé kyseliny nebo slabé báze může mít za následek relativně velké chyby, jak je znázorněno na Obrázku \(\PageIndex{3}\). Tento obrázek ukazuje, pozemky pH vs. objem základní přidány pro titraci 50,0 mL 0.100 M roztoku silné kyseliny (HCl) a slabé kyseliny (kyselina octová) s 0.100 M \(NaOH\). Rozsahy pH, nad nimiž jsou také zobrazeny dva společné ukazatele (methyl červená, \(pK_{in} = 5.0\) a fenolftalein, \(pK_{in} = 9.5\)) změna barvy., Vodorovné pruhy označují rozsahy pH, nad nimiž oba indikátory mění barvu přes titrační křivku HCl, kde je téměř vertikální. Proto oba indikátory mění barvu, když byl přidán v podstatě stejný objem \(NaOH\) (asi 50 mL), což odpovídá bodu ekvivalence. Naproti tomu titrace kyseliny octové poskytne velmi odlišné výsledky v závislosti na tom, zda se jako indikátor používá methyl červený nebo fenolftalein., Ačkoli rozsah pH, ve kterém fenolftalein mění barvu, je o něco větší než pH v bodě ekvivalence silné titrace kyseliny, chyba bude zanedbatelná kvůli sklonu této části titrační křivky. Stejně jako při titraci HCl se indikátor fenolftaleinu změní na růžovou, když se do roztoku kyseliny octové přidá asi 50 mL \(NaOH\). Naproti tomu methylová červená se začíná měnit z červené na žlutou kolem pH 5, což je blízko středu titrace kyseliny octové, nikoli bodu ekvivalence., Přidání pouze asi 25-30 mL \(NaOH\) proto způsobí změnu barvy indikátoru methyl red, což vede k obrovské chybě.
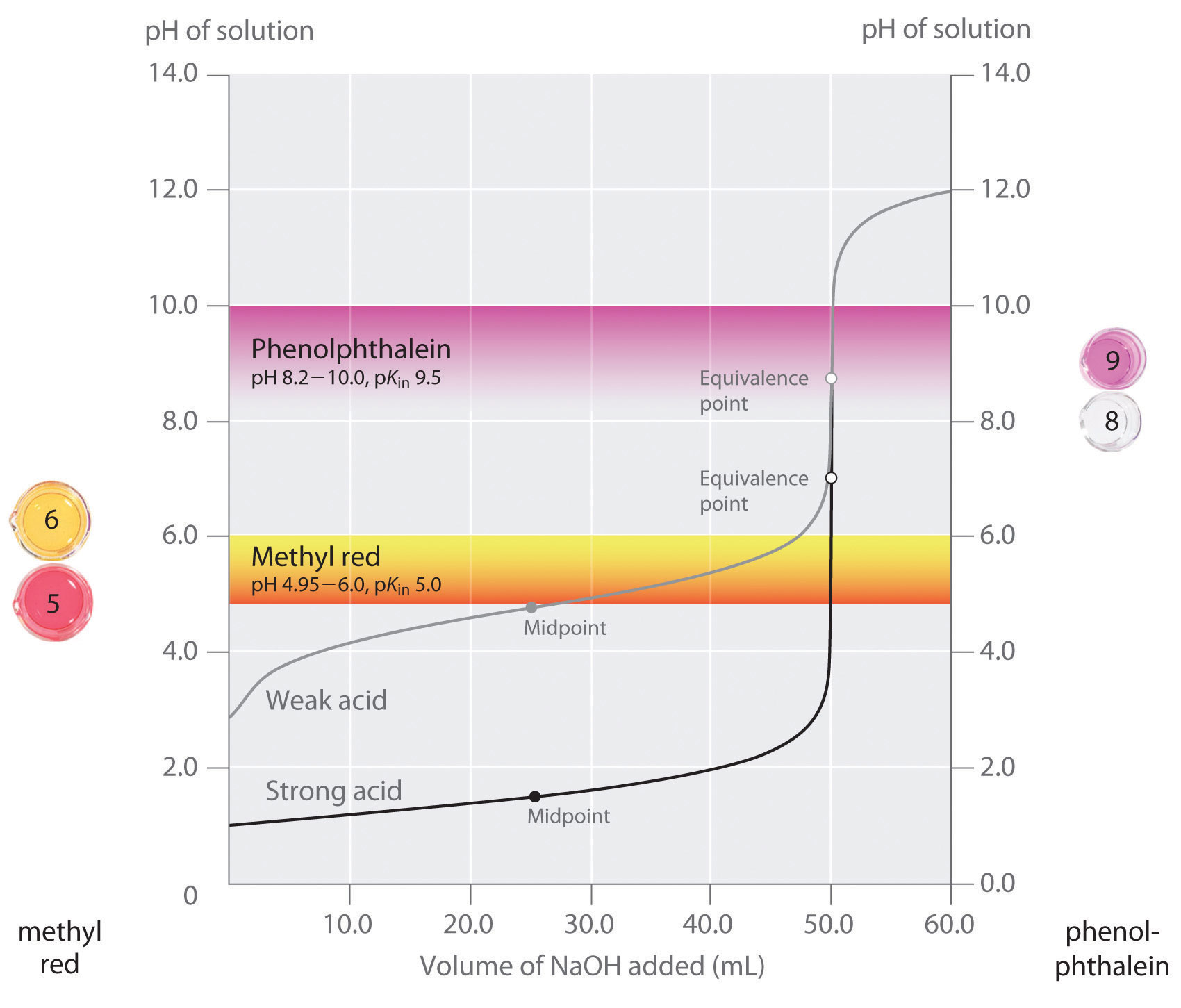
graf ukazuje výsledky získané pomocí dvou ukazatelů (methyl red a fenolftalein) pro titraci 0.100 M roztoků silné kyseliny (HCl) a slabé kyseliny (kyselina octová) s 0.100 M \(NaOH\)., Vzhledem k strmosti titrační křivky silné kyseliny kolem bodu ekvivalence se buď indikátor rychle změní barvu v bodě ekvivalence pro titraci silné kyseliny. V kontrastu, pKin pro methyl red (5.0) je velmi blízko k pKa kyseliny octové (4.76); střed změna barvy pro methylčerveně se vyskytuje v blízkosti středu titrace, spíše než na bod ekvivalence.
obecně platí, že pro titrace silné kyseliny se silnou bází (a vice versa), jakýkoliv indikátor s pK v rozmezí 4,0 a 10,0 bude dělat., Pro titraci slabé kyseliny, nicméně, pH ekvivalenčního bodu je větší než 7.0, takže se indikátor, jako je fenolftalein nebo thymolová modř, s pKin > 7.0, by měly být použity. Naopak, pro titraci slabé základny, kde pH na rovnovážný bod je nižší než 7.0, indikátor jako methylčerveně nebo bromokresolové modrá, s pKin < 7.0, by měly být použity.
Například \(\PageIndex{1}\)
V titraci slabé kyseliny se silnou základnou, který ukazatel by byl nejlepší volbou?,
- Methyl-Oranžová
- Bromokresolové Zeleně
- Phenolphtalein
Řešení
správná odpověď je C. Při titraci slabé kyseliny silnou základnu, konjugovaná báze slabé kyseliny bude hodnota pH na rovnovážný bod větší než 7. Proto byste chtěli, aby se indikátor změnil v tomto rozsahu pH. Jak methyl oranžová, tak bromokresol zelená mění barvu v kyselém rozmezí pH, zatímco fenolftalein se mění v základním pH.,
existuje mnoho různých ukazatelů s různými barvami a pKin hodnoty také poskytuje pohodlný způsob, jak odhadnout pH roztoku bez použití drahé elektronický pH metr a křehké pH elektrody. Papírové nebo plastové proužky napuštěné kombinace ukazatele se používají jako „papír pH“, který umožňuje odhad pH roztoku pouhým ponořením kus pH papíru do ní a porovnání výsledné barvy s normami vytištěné na obalu (viz Obrázek \(\PageIndex{4}\)).,
Shrnutí
acidobazické indikátory jsou látky, které mění barvu při určitém pH., Jsou to obvykle slabé kyseliny nebo báze, jejichž změny barvy odpovídají deprotonaci nebo protonaci samotného indikátoru.
Přispěvatelé a Pravomocí
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) a Richard Langley (Stephen F. Austin State University) s přispívajících autorů. Obsah učebnice produkovaný OpenStax College je licencován pod licencí Creative Commons Attribution License 4.0. Stáhněte si zdarma na http://cnx.org/contents/85abf193-2bd…[email protected]).
- {šablona.,Bez přispění ()}}















