chemie pro non-Majors (Čeština)
cíle učení
- popisují molekuly, jejichž tvary jsou ovlivněny teorií VSEPR.
- definovat osamělý pár.
- popisuje, jak osamělé párové elektrony ovlivňují molekulární geometrii.
jak funguje elektroskop?
elektroskop je zařízení používané ke studiu náboje. Když se kladně nabitý objekt (tyč) blíží k hornímu sloupku, elektrony proudí do horní části nádoby a zanechávají dva Zlaté listy postivley nabité., Listy se navzájem odpuzují, protože oba drží postivní, jako náboje. Teorie VSEPR říká, že elektronové páry, také soubor podobných nábojů, se navzájem odpuzují tak, že se tvar molekuly upraví tak, aby páry valenčních elektronů zůstaly co nejdále od sebe.

Centrální Atom s Ne Osamělé Páry
aby bylo možné snadno pochopit typy molekul možné, budeme používat jednoduchý systém pro identifikaci částí molekuly.,
A = centrální atom v molekule
B = atomy kolem centrálního atomu
Indexy po B se označují číslo B atomů, které jsou vázány na centrální atom. Například AB 4 je molekula s centrálním atomem obklopená čtyřmi kovalentně vázanými atomy. Opět nezáleží na tom, zda jsou tyto vazby jednoduché, dvojité nebo trojité.
AB2: beryllium hydrid (BeH2)
beryllium hydrid se skládá z centrálního berylliového atomu se dvěma jednoduchými vazbami na atomy vodíku. Připomeňme, že porušuje pravidlo oktetu.,
H-Be-H
v Závislosti na požadavku, že elektronové páry maximalizovat jejich vzdálenosti jeden od druhého, dva vazebné páry v BeH 2 molekuly uspořádají přímo na opačných stranách centrální Být atom. Výsledná geometrie je lineární molekula, znázorněná na obrázku 1 v modelu“ koule a hůl“.

Obrázek 1. Berylliový hydridový model.
úhel vazby od H-Be-H je díky své lineární geometrii 180°.,
oxid uhličitý je dalším příkladem molekuly, která spadá do kategorie AB 2. Jeho Lewisova struktura se skládá z dvojných vazeb mezi centrálním uhlíkem a atomy kyslíku (viz Obrázek 2).

Obrázek 2. Lepení oxidu uhličitého.
odpuzování mezi dvěma skupinami čtyř elektronů (dvou párů) se neliší od odpuzování dvou skupin dvou elektronů (jednoho páru) v molekule BeH 2. Oxid uhličitý je také lineární (viz obrázek 3).,

obrázek 3. Oxid.
AB3: Bor Trifluoride (BF3)
Bor trifluoride se skládá z centrální atom boru s tři jednoduché vazby na atomy fluoru (viz Obrázek 4). Atom boru má také neúplný oktet.
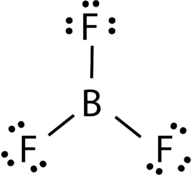
obrázek 4. Bór Trifluorid lepení.
geometrie molekuly BF 3 se nazývá trigonální rovinná (viz obrázek 5). Atomy fluoru jsou umístěny na vrcholcích rovnostranného trojúhelníku., Úhel F-B-F je 120° a všechny čtyři atomy leží ve stejné rovině.

obrázek 5. Model boru trifluoridu.
AB4: metan (CH4)
metan je organická sloučenina, která je primární složkou zemního plynu. Jeho struktura se skládá z centrálního atomu uhlíku se čtyřmi jednotlivými vazbami na atomy vodíku (viz obrázek 6). Aby se maximalizovala jejich vzdálenost od sebe, čtyři skupiny spojovacích elektronů neleží ve stejné rovině., Místo toho každý z atomů vodíku leží v rozích geometrického tvaru zvaného čtyřstěn. Atom uhlíku je ve středu čtyřstěnu. Každá tvář čtyřstěnu je rovnostranný trojúhelník.

obrázek 6. Čtyřstěnná struktura metanu.
molekulární geometrie molekuly metanu je čtyřstěnná (viz Obrázek 7). Úhly vazby H-C-H jsou 109,5°, což je větší než 90° , které by byly, kdyby molekula byla rovinná., Při kreslení strukturního vzorce pro molekulu, jako je metan, je výhodné uvést trojrozměrný charakter jejího tvaru. Níže uvedený strukturální vzorec se nazývá perspektivní kresba. Vazba tečkované čáry má být vizualizována jako ustupující do stránky, zatímco vazba pevného trojúhelníku má být vizualizována jako vycházející ze stránky.

Obrázek 7. Metan perspektivní model.
jak se všechny tyto oděvy vejdou do tak malého prostoru?,
když cestujeme, často bereme mnohem více věcí, než potřebujeme. Snažit se to všechno zapadnout do kufru může být skutečnou výzvou. Možná budeme muset přebalit nebo to všechno zmáčknout. Atomy často musí uspořádat, kde jsou elektrony, aby vytvořily stabilnější strukturu.

Centrální Atom s Jedním nebo Více Osamělé Páry
molekulární geometrie molekul změní, když centrální atom má jeden nebo více osamělý párů elektronů., Celkový počet elektronových párů, jak vazebných párů, tak osamělých párů, vede k tomu, co se nazývá geometrie elektronové domény. Když je jeden nebo více spojovacích párů elektronů nahrazeno osamělým párem, změní se molekulární geometrie (skutečný tvar) molekuly. V souladu se symboly A A B vytvořenými v předchozí části použijeme E k reprezentaci osamělého páru na centrálním atomu (a). Index bude použit, pokud existuje více než jeden osamělý pár. Osamělé páry na okolních atomech (B) neovlivňují geometrii.,
AB3E: amoniak, NH3
molekula amoniaku obsahuje tři jednotlivé vazby a jeden osamělý pár na centrálním atomu dusíku (viz Obrázek 8).

Obrázek 8. Osamělý pár elektronů v amoniaku.
geometrie domény pro molekulu se čtyřmi elektronovými páry je čtyřstěnná, jak bylo vidět u CH 4 . V molekule amoniaku je jeden z elektronových párů spíše osamělý pár než spojovací pár. Molekulární geometrie NH 3 se nazývá trigonální pyramidální (viz obrázek 9).,

obrázek 9. Molekula amoniaku.
připomeňme, že úhel vazby v molekule čtyřstěnného CH 4 je 109,5°. Opět platí, že nahrazení jednoho z vázaných elektronových párů osamělým párem mírně zkomprimuje úhel. Úhel H-N-H je přibližně 107°.
AB2E2: Voda, H2O
molekula vody se skládá ze dvou spojování párů a dva osamělé páry (viz Obrázek 10).

obrázek 10. Osamělý pár elektronů na vodě.,
pokud jde o metan a amoniak, geometrie domény pro molekulu se čtyřmi elektronovými páry je čtyřstěnná. V molekule vody, dva z elektronových párů jsou osamělé páry, spíše než lepení párů. Molekulární geometrie molekuly vody je ohnutá. Úhel vazby H-O-H je 104,5°, což je menší než úhel vazby v NH3 (viz obrázek 11).

obrázek 11. Molekula vody.,
AB4E: Síra Tetrafluoride, SF4
Lewis struktura pro SF 4 obsahuje čtyři jednoduché vazby a osamělého páru na atom síry (viz Obrázek 12).

Obrázek 12. Osamělý pár elektronů v SF4.
atom síry má kolem sebe pět elektronových skupin, což odpovídá geometrii trigonální bipyramidové domény, jako v PCl 5 (viz obrázek 13). Připomeňme, že trigonální bipyramidová geometrie má tři rovníkové atomy a dva axiální atomy připojené k centrálnímu atomu., Kvůli většímu odpuzování osamělého páru je to jeden z rovníkových atomů, které jsou nahrazeny osamělým párem. Geometrie molekuly se nazývá zkreslený čtyřstěn nebo houpačka.

obrázek 13. Míč a hůl model pro SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- přítomnost osamělých párových elektronů ovlivňuje trojrozměrný tvar molekuly.
Cvičení
Centrální Atom s Ne Osamělé Páry
Použijte níže uvedený odkaz a odpovězte na následující otázky:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Jaký je tvar PF 5 ?
- jaké úhly těla C-H bychom předpovídali pro metan, pokud by molekula byla rovinná?
- jaká molekula má konfiguraci oktahedronu?,
Centrální Atom s Jedním nebo Více Osamělé Páry
Použijte níže uvedený odkaz a odpovězte na následující otázky:
- Jaké jsou obecné zásady při řešení molekul, které obsahují více než čtyři elektronové páry?
- na obrázku s pěti elektronovými páry kolem centrálního atomu, proč je výhodné uspořádání vpravo?
- na obrázku se šesti elektronovými páry, proč je konfigurace s osamělými páry při 180o navzájem stabilnější?,
Recenze
Centrální Atom s Ne Osamělé Páry
- Jaké jsou vazebné úhly v oxidu uhličitém?
- jaká molekula má úhel vazby 109,5 ° ?
- jaká je geometrie molekuly BF 3?
centrální Atom s jedním nebo více osamělými páry
- proč má voda ohnutou geometrii?
- proč amoniak není planární molekula?
- jak bychom napsali konfiguraci pro xenonový tetrafluorid pomocí systému ABE?















