Hranic, v Endokrinologii
Úvod
tumor supresorového genu TP53 bylo nejvíce silně studoval lidský gen od svého objevu před téměř 40 lety (1). Hlavním důvodem tohoto stavu je kritická role p53 hraje v prevenci vývoje rakoviny, a to je široce považován za „strážce genomu.,“Na nějakou dobu to bylo obecně věřil, že p53 má roli v nádorové potlačení je na základě jeho schopnost navození apoptózy, buněčného cyklu zatčení a stárnutí pre-rakovinné buňky (2). Nyní je však stále jasnější, že p53 reguluje mnoho dalších cest v buňce a že tyto další cesty také hrají roli ve schopnosti p53 fungovat jako supresor nádoru (3). Zejména role p53 v regulaci genů zapojených do metabolismu a ferroptózy byla zapojena do jeho schopnosti potlačit vývoj nádoru., Ferroptosis je román buněčné smrti cestou první se vyznačuje v roce 2012 a může být nejlépe popsat jako železo-dependentní, kaspázy-samostatná forma buněčné smrti vedený vzniku peroxidace lipidů (4). Konkrétně, dva myší modely obsahující inženýrství, mutace v p53, které eliminují schopnost p53 na indukci apoptózy a senescence jak udržet schopnost potlačit spontánní vývoj nádoru; oba tyto mutanty zachovat schopnost transactivate genů v metabolismu a ferroptosis (5, 6)., Souhrn údajů implikujících p53 v regulaci metabolismu a ferroptózy je podrobně popsán níže.
Wild-Type (WT) p53 Pozitivně Reguluje Oxidativní Fosforylace a Potlačuje Metabolismus Glukózy
Wild-type p53 reguluje metabolické všestrannost buňky tím, že upřednostňují mitochondriální respirace v průběhu glykolýzy, v části přes transactivation z SCO2 (cytochrom c oxidáza shromáždění), který hraje přímou roli v oxidativní fosforylace (7)., p53 také přímo reguluje transaktivaci GLS2 (Glutamináza 2); tento enzym umožňuje použití glutaminu jako zdroje energie pro mitochondrie (8). Kromě toho, WT p53 negativně reguluje glykolýzu tím, že transkripčně potlačovat glukózových přenašečů GLUT1 a GLUT4, a transactivating RRAD a TIGAR; oba jsou inhibitory glykolýzy (9-11). Nakonec se p53 také přímo váže a inhibuje enzym glukóza-6-fosfát dehydrogenáza, čímž potlačuje metabolismus glukózy (12)., Z těchto a dalších studií je zřejmé, že v normálních, nestresovaných organismech p53 přímo reguluje metabolický stav v buňce (Obrázek 1). Není divu, že tento gen a mnoho jeho regulátorů se podílejí na metabolických onemocněních, včetně obezity a diabetu (13).
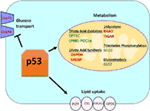
Obrázek 1. Úloha divokého typu (WT) p53 v metabolismu. Geny pozitivně regulované p53 jsou zobrazeny zeleně a geny negativně regulované p53 jsou zobrazeny červeně., p53 inhibuje transport glukózy, glykolýzu a syntézu mastných kyselin, zatímco podporuje vychytávání lipidů, oxidaci mastných kyselin, oxidační fosforylaci a glutaminolýzu.
Mutant p53 Pozitivně Reguluje Warburg Metabolismus (Aerobní Glykolýza)
na rozdíl od funkce WT p53, mutantů p53 v nádorových buňkách laskavosti aerobní glykolýzy, v části o posílení obchodu s lidmi z glukózový transportér GLUT1 do plazmatické membrány, čímž se zvyšuje glukózy import (14, 15)., Tyto mutace p53, snížené hladiny SCO2 a GLS2 a zvýšené hladiny GLUT1 a GLUT4 prospěch aerobní glykolýzy v průběhu oxidativní fosforylace. Tímto způsobem se předpokládá, že mutant p53 přispívá ke sklonu nádorových buněk k využití aerobní glykolýzy ve prospěch oxidační fosforylace nebo tzv. Jedním z charakteristických znaků rakoviny je deregulovaný metabolismus, obecně prokázaný tímto přechodem z aerobní glykolýzy na oxidační fosforylaci., I když to má za následek nižší a méně efektivní ATP výnos, to je věřil, že rakovinné buňky prospěch přesměrování glycolytic meziprodukty biosyntetické dráhy nutné pro rychlé dělení buněk (16). Tento metabolický přepínač také vede ke snížené apoptóze zprostředkované mitochondriemi a účinnější signalizaci prostřednictvím dostupných metabolitů v rakovinných buňkách (17).
Společný Genetický Varianta v TP53 Ovlivňuje jeho Funkci v Metabolismu
je běžné kódování regionu polymorfismus p53 v kodonu 72, kódování buď pro prolin (P72) nebo argininu (R72)., Tato aminokyselinová variace může ovlivnit funkci p53 s ohledem na osud buněk po stresu. V reakci na poškození DNA vyvolává P72 varianta p53 převážně zástavu buněčného cyklu, zatímco varianta R72 převážně indukuje buněčnou smrt nebo apoptózu (18, 19). Navzdory těmto rozdílům ve funkci nebyla variace kodonu 72 důsledně spojena s náchylností k rakovině (20). Naproti tomu v lidských studiích je tento polymorfismus významně spojen se zvýšeným indexem tělesné hmotnosti a rizikem diabetu (21, 22)., Tento předpoklad je podporován studiemi na myších, kde model myši pro tyto varianty kodonu 72 ukazuje zvýšený diabetes indukovaný dietou s vysokým obsahem tuku u myší s variantou R72 ve srovnání s P72. V těchto studiích byly cílové geny p53 TNFa a NPC1L1 identifikovány jako kritické regulátory ve zvýšení obezity vyvolané dietou u myší R72 (23). Zajímavé je, že varianta R72 také prokázala zvýšené přežití buněk v reakci na deprivaci živin (24)., Tyto nálezy vedly k hypotéze, že R72 varianta p53 vznikl a byl vybrán jako populace se stěhoval na sever, kde chladné počasí by vyžadovalo zvýšené hromadění tuku, ale kde přežití v reakci na nutriční deprivace by také být podle výběru (24).
p53 Reguluje Metabolismus Lipidů
i Když p53 je dobře známý pro regulaci glykolýzy a citrátového cyklu, p53 také bylo prokázáno, že hrají roli v regulaci metabolismu lipidů (25)., Předpokládá se, že WT p53 zvyšuje oxidaci mastných kyselin při inhibici syntézy mastných kyselin, čímž působí jako negativní regulátor syntézy lipidů (25). Existuje několik cílových genů p53 s rolemi v metabolismu lipidů. Sanchez Macedo a kolegové prokázali, že carnitin palmitoyltransferase 1C (CPT1C) je transkripčně regulována p53; tento enzym pomáhá při transportu aktivovaných mastných kyselin do mitochondrií., Na podporu role tohoto genu regulovaného p53 u rakoviny tato skupina ukázala, že myši s deficitem Cpt1c vykazují zpožděný vývoj nádoru a vyšší míru přežití (26). Lipin 1 (LPIN1) je další cílový Gen p53; LPIN1 je nezbytný pro správný vývoj adipocytů a je indukován za nízkých podmínek živin (27). Finck a kolegové ukázali, že LPIN1 interaguje s PGC-1α, další známý p53 cílových genů, které mají úlohu v metabolismu, a že tato interakce aktivuje expresi genů zapojených do podpory oxidace mastných kyselin (28).,
kromě přímé regulace transkripce genů zapojených do metabolismu lipidů může p53 také regulovat metabolismus lipidů způsobem zahrnujícím přímou interakci bílkovin a bílkovin. Například glukóza-6-fosfát dehydrogenázy, což je rychlost limitující enzym pentózového cyklu, váže a je přímo inhibována p53, což vede ke snížení produkce NADPH a v důsledku toho se snížil syntézu mastných kyselin (12)., Sterol regulační prvek vázající proteiny (SREBP) rodina transkripčních faktorů modulovat expresi genů podílejících se na cholesterolu, mastných kyselin, triacylglycerolu a fosfolipidové syntézy (29-31). WT p53 potlačuje SREBP funkce (32), zatímco mutantní formy p53 vázat přímo na SREBP a zvýšit jejich transkripční funkce, což vede ke zvýšené SREBP aktivity v lidských nádorů (33, 34). V důsledku toho mutant p53 koreluje s vyšší expresí genů sterol biosyntézy u lidských nádorů prsu (34, 35)., Konečně, AMP-aktivované protein kinázy (AMPK) je enzym, který se aktivuje za nízké úrovně živin nebo energie, stres a je známo, že inhibují syntézu mastných kyselin v interakci s acetyl-CoA carboxylase a SREBP-1 (36, 37). Zhou a jeho kolegové prokázali, že mutant p53 se přednostně váže a inhibuje AMPK, což vede ke zvýšené syntéze mastných kyselin. Výsledkem je, že mutantní proteiny p53 vedou ke zvýšené signalizaci AMPK, což přispívá k invazivnímu buněčnému růstu nádorových buněk (33). Méně prozkoumanou oblastí je role p53 v transportu lipidů., Bylo prokázáno, že p53 transkripčně reguluje apolipoproteinu B (pom r) a pom r editaci enzym komplex 1, což naznačuje roli p53 v regulaci aterogenní lipoproteiny (38). Microarray analýza lidských jater-odvozené buňky identifikovány phospholipid transfer protein, ATP binding cassette A12, a karboxylové ester lipázu jako tři p53 cílové geny, které hrají roli v lipidové dopravy (39, 40)., Celkově, i když je zřejmé, že p53 hraje klíčovou roli při zprostředkování syntézy a metabolismu lipidů, zůstává třeba určit přínos této cesty a těchto cílových genů p53 k potlačení nádoru p53 (Obrázek 1).
Ferroptosis je Román Buněčné Smrti Cestou vedený Peroxidace Lipidů
V roce 2012, Dixon a kolegové objevili nové formy regulované buněčné smrti zvané ferroptosis. Ferroptóza je železo-dependentní, kaspáza-nezávislá forma buněčné smrti vyplývající z akumulace oxidovaných lipidů (4, 41)., Tento proces je řízen inaktivace glutathion peroxidázy 4 (GPX4), enzymu, který je zodpovědný za konverzi smrtící lipidů hydroperoxides non-toxické lipidy alkoholy, které vyžaduje, glutathion, aby fungoval (41). Předpokládá se, že peroxidace polynenasycených mastných kyselin (PUFA) je hnacím impulsem pro buněčnou smrt ferroptózou. PUFA obsahují bis-allylové protony, které lze snadno abstrahovat a produkovat radikály, které budou reagovat s kyslíkem, vytvářet více radikálů a vést k řetězové reakci lipidů reaktivních druhů kyslíku (42)., Přesný mechanismus buněčné smrti ferroptózou zůstává neznámý, ale jedna hypotéza je, že poškození lipidů vede ke zničení plazmatické membrány (43). Spekulovalo se, že ferroptóza by mohla být mechanismem potlačení nádoru, který funguje tak, že eliminuje buňky, které jsou zbaveny živin nebo byly vystaveny environmentálnímu stresu nebo infekci.,
Farmakologické Regulace Ferroptosis
Ferroptosis může být vyvolán pomocí inhibitorů systému xc− jako erastin, nebo analogy, jako je glutamát a sorafenib, které inhibují import z cystinu, což vede k vyčerpání glutathionu a následné inaktivace GPX4. Alternativně, ferroptosis může být indukována (1S,3R)-RSL3 (dále jen RSL3), která se přímo váže a inhibuje GPX4 (4, 5, 42). Buthion sulfoximin, FIN56, FINO2, CCl4 a cisplatina jsou další látky, u kterých bylo prokázáno, že indukují ferroptózu v buňkách., Smrt ferroptosis může být zabráněno tím, že potlačuje peroxidaci lipidů, což může být dosaženo pomocí lipofilní antioxidanty, jako ferrostatin-1, liproxstatin-1, nebo vitamin E. chelátory Železa jako deferoxamin nebo cicloprox jsou dalším nástrojem, který používá k potlačení ferroptosis snížením hladiny železa. Vyčerpání PUFAs nebo přidání mononenasycených mastných kyselin do buněčných kultivačních médií může také zachránit buňky před ferroptózou (42, 44).,
Ferroptosis je Zapleten v p53-Zprostředkovanou Nádorové Potlačení
V roce 2012, Gu a jeho kolegové vyvinuli model, myši, ve které tři běžně acetylovaný lysin zbytky v DNA-vazebné domény p53 byly zmutoval na arginin, a proto nemohl být acetylovaný; tato myš je odkazoval se na jako 3KR myši. Zejména, buňky z 3KR myši jsou schopni podstoupit p53-dependentní apoptózy, buněčného cyklu zatčení, nebo senescence, a opravdu 3KR mutant p53 nedokáže transactivate většina p53 cílové geny., Zajímavé je, že tento myší model není spontánně vyvinout rakovina, což znamená, že p53 může potlačit vývoj nádoru nezávislý na stáří nebo apoptózy (45). Tato skupina zjistila, že mutant 3KR protein si zachovává schopnost podstoupit ferroptosis a regulaci metabolismu cystinu tím, že reguluje expresi cystinu dovozce SLC7A11; to naznačuje, že ferroptosis může být jedna cesta, která je základem p53-zprostředkovanou nádorové potlačení., Když divoký typ a 3KR MEFs byli léčeni ferroptosis induktor Erastin, téměř 50% buněčné smrti byla pozorována vzhledem k tomu, že p53 null MEFs vystavoval 20% buněčné smrti; to znamená, že p53 zvyšuje citlivost buněk k ferroptosis, a také to, že další klíčové regulátory také hrát roli v ferroptosis (5). Následně Gu a jeho kolegové identifikovali další acetylace stránky na lysin 98 p53, a oni generované myší model, v němž všechny čtyři acetylace stránky byly zmutoval na arginin (4KR)., Zajímavé je, že mutant 4KR nebyl schopen regulovat geny zapojené do ferroptózy, jako je SLC7A11, a na rozdíl od mutantu 3KR nebyl schopen potlačit vývoj nádoru (46). I když v současné době korelační, tyto údaje implikují roli p53 v ferroptóze ve své schopnosti potlačit vývoj nádoru.
V netransformované Buňky, p53 Pozitivně Reguluje Ferroptosis
kromě SLC7A11, několik dalších přímé p53 cílové geny byly objeveny hrát roli v ferroptosis. Patří mezi ně GLS2, PTGS2 a SAT1., Studie ze dvou samostatných skupin podporují roli GLS2 v ferroptóze, o které je známo, že snižuje glutathion a zvyšuje hladiny buněčných ROS. Jiang a kolegové použili ferroptosis inhibitory v kombinaci s glutaminolysis inhibitory inhibují Erastin vyvolané ferroptosis, což dokazuje, že ferroptosis vyžaduje glutaminolysis a GLS2 (47). Murphy a jeho kolegové ukázali, že polymorfní varianta p53 byl schopen vyvolat růst zatčení a stárnutí jak v lidské a myší buňky, ale nepodařilo potlačit SLC7A11 nebo transactivate GLS2., Tato varianta byla výrazně narušena při vyvolání ferroptózy a potlačení vývoje nádoru, což opět znamenalo roli p53 při potlačení nádoru zprostředkovaného ferroptózou (48). Dalším cílovým genem p53 s rolí v ferroptóze je PTGS2, gen kódující enzym cyklooxygenázu-2. Stockwell a jeho kolegové nejprve ukázali, že indukce ferroptózy pomocí Erastinu a RSL3 vedla k upregulaci PTGS2 (41). Zejména PTGS2 nebyl upregulován induktory ferroptózy v buňkách p53-null, což naznačuje, že toto nařízení je závislé na p53 (5)., V současné době je upregulace PTGS2 široce používána jako marker ferroptózy (5, 41).
nedávná studie skupiny Gu ukázala, že cílový Gen p53 SAT1 reguluje ferroptózu (49). Autoři identifikovali SAT1 jako přímý cíl p53 a ukázali, že umlčení SAT1 snižuje buněčnou smrt vyvolanou reaktivními druhy kyslíku v buňkách s WT p53, ale nemělo žádný účinek v buňkách p53-null. Mechanicky, tato skupina ukázala, že SAT1 zvyšuje úroveň a aktivitu arachidonate 15-lipoxygenase, železo-vazba enzym, který oxiduje Pufa a zvyšuje peroxidaci lipidů., Zejména tato studie ukázala, že ani p53, ani samotný SAT1 se nezdají být dostatečné k vyvolání ferroptózy. Místo toho, kombinovat data jsou více v souladu s předpokladem, že p53, díky regulaci genů, které přispívají k ferroptosis, reguluje citlivost buněk na této cestě, spíše než přímo indukuje ferroptosis. Zda p53 reguluje další geny zapojené do ferroptózy, se teprve určí (Obrázek 2).
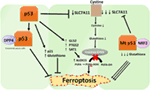
Obrázek 2. Různé role p53 v ferroptóze., Inhibice glutathionperoxidázy 4 (GPX4), klíčového enzymu, který katalyzuje konverzi polynenasycených mastných kyselin (PUFA) obsahujících peroxidy na alkoholy, je klíčovým hybatelem ferroptózy. V závislosti na kontextu může p53 potlačit ferroptózu (například v buňkách kolorektálního karcinomu) nebo podporovat ferroptózu. Mutant p53 senzibilizuje buňky na ferroptózu ještě více než divoký typ p53.,
V Některých Buňkách, p53 Negativně Reguluje Ferroptosis
studie, kterou nedávno zveřejnila Tarangelo a kolegové ukazují, že p53 negativně reguluje ferroptosis v nádorových buňkách (50). Tato skupina zjistila, že Předúprava buněk s Nutlin-3, sloučeninou, která stabilizuje p53, zpomaluje nástup ferroptózy u několika typů buněk. Bylo zjištěno, že zpožděný nástup ferroptózy závisí na cdkn1a (kódování p21), kritickém transkripčním cíli p53., Mechanismus, jehož prostřednictvím p21 zpoždění ferroptosis musí být ještě objasněn, ale předpokládá se, že zachování intracelulární glutathion může být faktorem, který přispívá k snížení ferroptosis citlivost. Autoři docházejí k závěru, že p53–p21 osa umožňuje rakovinné buňky přežít v podmínkách metabolického stresu, jako je cystin deprivace, potlačuje nástup ferroptosis (50). Nedávná studie ukázala, že inhibuje p53 ferroptosis v kolorektální nádorové buňky prostřednictvím vazby na enzym dipeptidyl-peptidázy-4 (DPP4), což je modulátor ferroptosis a metabolismus lipidů., Mechanicky, tato studie ukázala, že p53 působí proti ferroptosis tím izolovat DPP4 v jaderné enzymatické neaktivní bazén. Při absenci p53 je DPP4 volně interagován a tvoří komplex s NOX1; to vede ke zvýšené peroxidaci lipidů a ferroptóze. Inhibice DPP4 významně potlačuje ferroptózu, zatímco nadměrná exprese DPP4 vyvolává citlivost na Erastin, zejména v buňkách vyčerpaných p53 (51). Obousměrná kontrola ferroptózy p53 prostřednictvím mechanismů závislých na transkripci a nezávislých na transkripci může být závislá na kontextu nebo buněčném typu (Obrázek 2).,
P47S Polymorfismus TP53 Ovlivňuje Ferroptosis a Nádorové Suprese
kromě missense mutace, existuje několik funkčně významných single-nukleotidové polymorfismy (Snp) v genu TP53 a dalších proteinů známo, že regulace této dráhy (např. MDM2 a MDM4). Varianta Pro47Ser (dále S47) je druhým nejčastějším SNP nalezeným v kódovací oblasti p53 (po Pro72Arg), která mění aminokyselinovou sekvenci proteinu., Pro lepší objasnění dopad této varianty na p53 funkce a riziko rakoviny, Murphy group vytvořila zlidštění p53 knock-in mouse model, ve kterém exons 4-9 myší p53 byly nahrazeny lidského p53 exons obsahující buď divoký typ nebo S47 varianta (52 až 55). Většina myší S47 spontánně vyvinula nádory různých histologických typů, zejména rakoviny jater, ve věku 12 až 18 měsíců, na rozdíl od myší WT p53 (48)., U myších embryonálních fibroblastů a lidských lymfoblastoidních buněčných linií ukázala varianta S47 zhoršenou naprogramovanou buněčnou smrt v reakci na cisplatinu a další genotoxické napětí. Mechanicky je varianta S47 vadná pro transaktivaci genů zapojených do metabolismu, jako je Gls2 (glutamináza 2) a Sco2 (48). V souladu s úlohou Gls2 v ferroptosis, tato skupina zjistila, že S47 buňky byly výrazně odolné vůči ferroptosis indukující Erastin a RSL3 (47, 48). Tato vada může přispět k fenotypu náchylnému k nádoru pozorovanému u myší S47.,
Mutant p53 zvyšuje citlivost Nádorových Buněk k Ferroptosis
Wild-type p53 negativně reguluje expresi cystinu dovozce SLC7A11, který inhibuje citlivost na ferroptosis (5). Ačkoli se tato regulace vyskytuje v normálních buňkách, v nádorových buňkách se zdá, že v regulaci tohoto genu převládají další mediátory SLC7A11. Například, hlavní antioxidant transkripční faktor NRF2 také může regulovat expresi SLC7A11 na transkripční úrovni, a NRF2 byl zapletený jako klíčový hráč v ochraně nádorových buněk proti ferroptosis., Například inhibice NRF2 v hepatocelulárních rakovinných buňkách zvyšuje protinádorovou aktivitu Erastinu a sorafenibu in vivo (56). Mutantní formy p53 mohou inhibovat NRF2 funkci přímé interakce, a jedna skupina zjistila, že nádory s mutantní p53 obsahují velmi nízké hladiny SLC7A11, a tak ukázat, zvýšená citlivost na ferroptosis. Zejména nadměrná exprese SLC7A11 u mutantních modelů p53 vedla k rezistenci na léčiva, což naznačuje, že hladiny exprese SLC7A11 je třeba vzít v úvahu při cílení mutantních rakovin poháněných p53 sloučeninami vyvolávajícími ferroptózu (57)., Na podporu tohoto předpokladu, nedávné práce v tlustého střeva a konečníku (CRC) rakoviny, kde mutace nebo delece p53 je časté události, ukázala, že lidské CRC buněčné linie nesoucí mutantní p53 byly daleko citlivější na Erastin-zprostředkované buněčné smrti, kdy ve srovnání s CRC buněk s WT p53. Pro ověření těchto zjištění ukázali, že zaklepání mutace hotspotu p53 v buňkách HCT116 a SW48 obnovilo citlivost na Erastin (51). Tato data zdůrazňují nový mechanismus, pomocí kterého lze pomocí cílené terapie využít rakoviny poháněné mutantem p53.,
Závěr
role p53 v metabolismu je zcela jasné, a možná i intuitivně zřejmé: WT p53 limity metabolismus glukózy a lipidů, syntézu, zatímco mutovaný p53 se zdá opak. Přínos jeho metabolické role k potlačení nádoru p53 a schopnosti mutantu p53 řídit progresi nádoru zůstává jednoznačně prokázán. Úloha p53 v regulaci ferroptózy a přínos této funkce k potlačení nádoru je ještě méně jasná., Zatímco přesvědčivé data z myších modelech podporuje předpoklad, že p53 reguluje citlivost buněk na ferroptosis, to může být omezena na schopnost bazální p53 k potlačení spontánní vývoj nádoru, a v onkogenu-zdůraznil myší modely, je jasné, že senescence a apoptózy hrát dominantní roli. Podobně může p53 regulovat citlivost ferroptózy specifickým způsobem buněčného typu. Další studie na zvířecích modelech, s důrazem na ferroptosis v různých tkáních, je třeba udělat, aby se více plně pochopit roli p53 v ferroptosis a ferroptosis v nádorové suprese., Kromě toho je třeba získat jasnější představu o tom, jaké geny p53-target hrají roli v citlivosti na ferroptózu. Řešení těchto otázek by mělo poskytnout tolik potřebné nové cesty k boji proti nádorům s mutantem p53.
Autor Příspěvky
KG, SB, TB, AB-K, C-PK, a MM každý napsal jeden až dva odstavce tohoto článku. KG a SB udělal obrázek. KG a MM nastínil kapitolu.,
Prohlášení o střetu zájmů
autoři prohlašují, že výzkum byl proveden bez jakýchkoli obchodních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Recenzent Oaf a editor handling deklarovali svou sdílenou příslušnost.
Poděkování
Výzkum hlášeny v této publikaci byl podporován National Institutes of Health na základě Zadání Čísla CA102184 (MM), CA201430 (MM), TL1TR002344 (C-PK), a T32 CA009171 (TB)., Obsah je výhradně odpovědností autorů a nemusí nutně představovat oficiální názory národních zdravotnických ústavů.
3. Humpton TJ, Vousden KH. Regulace buněčného metabolismu a hypoxie p53. Studený Jarní Harb Pot Med (2016) 6(7):211-30. doi:10.1101 / cshperspect.a026146
CrossRef Plný Text | Google Scholar
10. Zhang C, Liu J, Wu R, Liang Y, Lin M, Liu J, et al., Tumor supresor p53 negativně reguluje glykolýzu stimulovanou hypoxií prostřednictvím cílového RRAD. Oncotarget (2014) 5(14):5535-46. doi:10.18632 / oncotarget.2137
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
17. Lee M, Yoon JH. Metabolická souhra mezi glykolýzou a mitochondriální oxidací: reverzní Warburgův účinek a jeho terapeutické důsledky. Svět J Biol Chem (2015) 6(3):148-61. doi:10.4331 / wjbc.v6.i3.,148
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dumont P, Leu JI, Della Pietra AC III, George DL, Murphy M. The codon 72 polymorphic variants of p53 have markedly different apoptotic potential. Nat Genet (2003) 33(3):357–65. doi:10.1038/ng1093
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Kung CP, Khaku S, Jennis M, Zhou Y, Murphy ME., Identification of TRIML2, a novel p53 target, that enhances p53 SUMOylation and regulates the transactivation of proapoptotic genes. Mol Cancer Res (2015) 13(2):250–62. doi:10.1158/1541-7786.MCR-14-0385
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Bitti ML, Saccucci P, Capasso F, Piccinini S, Angelini F, Rapini N, et al. Genotypes of p53 codon 72 correlate with age at onset of type 1 diabetes in a sex-specific manner. J Pediatr Endocrinol Metab (2011) 24(7–8):437–9. doi:10.1515/jpem.,2011.058
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Kung CP, Liu Q, Murphy ME. The codon 72 polymorphism of p53 influences cell fate following nutrient deprivation. Cancer Biol Ther (2017) 18(7):484–91. doi:10.1080/15384047.2017.1323595
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sanchez-Macedo N, Feng J, Faubert B, Chang N, Elia A, Rushing EJ, et al., Vyčerpání nového p53-cílového genu karnitin palmitoyltransferázy 1C zpomaluje růst nádoru v modelu nádoru neurofibromatózy typu I. Buněčná Smrt Se Liší (2013) 20(4):659-68. doi:10.1038 / cdd.2012.168
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
30. Ettinger SL, Sobel R, Whitmore TG, Akbari M, Bradley DR, Gleave ME, et al. Dysregulace proteinů vázajících element sterolové odpovědi a následných efektorů u karcinomu prostaty během progrese k nezávislosti androgenů., Cancer Res (2004) 64(6):2212–21. doi:10.1158/0008-5472.CAN-2148-2
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Clendening JW, Pandyra A, Boutros PC, El Ghamrasni S, Khosravi F, Trentin GA, et al. Dysregulation of the mevalonate pathway promotes transformation. Proc Natl Acad Sci U S A (2010) 107(34):15051–6. doi:10.1073/pnas.,0910258107
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Yang WS, Kim KJ, Gaschler MM, Patel M, Shchepinov MS, Stockwell BR. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis. Proc Natl Acad Sci U S A (2016) 113(34):E4966–75. doi:10.1073/pnas.1603244113
PubMed Abstract | CrossRef Full Text | Google Scholar
54., Luo JL, Yang Q, Tong WM, knihy totem a tabu M, Wang ZQ, Hollstein M. Knock-in myší chimérická lidská/myší p53 vyvíjet normálně, a ukázat, wild-type p53 odpovědi na DNA poškozující látky: nový biomedicínský výzkumný nástroj. Onkogen (2001) 20(3):320-8. doi:10.1038/sj.onc.1204080
PubMed Abstraktní | CrossRef Plný Text | Google Scholar
57. Liu DS, Duong CP, Haupt S, Montgomery KG, dům CM, Azar WJ, et al. Inhibice osy systému XC-/glutathion se selektivně zaměřuje na rakovinu s akumulací mutant-p53., Nat Commun (2017) 8:14844. doi:10.1038/ncomms14844
PubMed Abstract | CrossRef Full Text | Google Scholar















