Chemie für Nicht-Majors (Deutsch)
Lernziele
- Beschreiben Molekülen, deren Formen sind beeinflusst von der VSEPR-Theorie.
- Definieren lone paar.
- Beschreiben Sie, wie einsame Paarelektronen die molekulare Geometrie beeinflussen.
Wie funktioniert ein Elektroskop funktioniert?
Ein Elektroskop ist ein Gerät zur Untersuchung der Ladung. Wenn sich ein positiv geladenes Objekt (der Stab) dem oberen Pfosten nähert, fließen Elektronen an die Oberseite des Glases und lassen die beiden Goldblätter postivley geladen., Die Blätter stoßen sich gegenseitig ab, da beide postive halten, wie Gebühren. Die VSEPR-Theorie besagt, dass Elektronenpaare, auch eine Menge ähnlicher Ladungen, sich so abstoßen, dass sich die Form des Moleküls so anpasst, dass die Valenzelektronenpaare so weit wie möglich voneinander entfernt bleiben.

Zentralatom ohne einzelne Paare
Um die möglichen Molekültypen leicht zu verstehen, verwenden wir ein einfaches System, um die Teile eines Moleküls zu identifizieren.,
A = zentrales Atom in einem Molekül
B = Atome, die das zentrale Atom umgeben
Abonniert, nachdem das B die Anzahl der B-Atome bezeichnet, die an das zentrale A-Atom gebunden sind. Zum Beispiel ist AB 4 ein Molekül mit einem Zentralatom, das von vier kovalent gebundenen Atomen umgeben ist. Auch hier spielt es keine Rolle, ob es sich bei diesen Anleihen um Einzel -, Doppel-oder Dreifachanleihen handelt.
AB2: Berylliumhydrid (BeH2)
Berylliumhydrid besteht aus einem zentralen Berylliumatom mit zwei Einzelbindungen an Wasserstoffatome. Denken Sie daran, dass es gegen die Oktettregel verstößt.,
H-Be-H
Entsprechend der Anforderung, dass Elektronenpaare ihren Abstand zueinander maximieren, ordnen sich die beiden Bindungspaare in den BeH 2-Molekülen auf direkt gegenüberliegenden Seiten des zentralen Be-Atoms an. Die resultierende Geometrie ist ein lineares Molekül, das in der Abbildung 1 in einem „Ball and Stick“ – Modell gezeigt wird.

Abbildung 1. Berylliumhydrid-Modell.
Der Bindungswinkel von H-Be-H beträgt aufgrund seiner linearen Geometrie 180°.,
Kohlendioxid ist ein weiteres Beispiel für ein Molekül, das unter die Kategorie AB 2 fällt. Seine Lewis-Struktur besteht aus Doppelbindungen zwischen dem zentralen Kohlenstoff und den Sauerstoffatomen (siehe Abbildung 2).

Abbildung 2. Kohlendioxid-Bindung.
Die Abstoßung zwischen den beiden Gruppen von vier Elektronen (zwei Paare) unterscheidet sich nicht von der Abstoßung der beiden Gruppen von zwei Elektronen (ein Paar) im BeH 2-Molekül. Kohlendioxid ist ebenfalls linear (siehe Abbildung 3).,

Abbildung 3. Kohlendioxid.
AB3: Bortrifluorid (BF3)
Bortrifluorid besteht aus einem zentralen Boratom mit drei Einzelbindungen an Fluoratome (siehe Abbildung 4). Das Bor-atom hat auch ein unvollständiges Oktett.
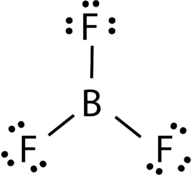
Abbildung 4. Bortrifluoridbindung.
Die Geometrie des BF 3-Moleküls wird trigonal planar genannt (siehe Abbildung 5). Die Fluoratome befinden sich an den Eckpunkten eines gleichseitigen Dreiecks., Der F-B-F-Winkel beträgt 120° und alle vier Atome liegen in derselben Ebene.

Abbildung 5. Bortrifluorid-Modell.
AB4: Methan (CH4)
Methan ist eine organische Verbindung, die der Hauptbestandteil von Erdgas ist. Seine Struktur besteht aus einem zentralen Kohlenstoffatom mit vier Einzelbindungen an Wasserstoffatome (siehe Abbildung 6). Um ihren Abstand voneinander zu maximieren, liegen die vier Gruppen von Bindungselektronen nicht in derselben Ebene., Stattdessen liegt jedes der Wasserstoffatome an den Ecken einer geometrischen Form, die Tetraeder genannt wird. Das Kohlenstoffatom befindet sich im Zentrum des Tetraeders. Jede Fläche eines Tetraeders ist ein gleichseitiges Dreieck.

Abbildung 6. Tetraedrische Struktur von Methan.
Die molekulare Geometrie des Methanmoleküls ist tetraedrisch (siehe Abbildung 7). Die H-C-H-Bindungswinkel sind 109,5°, was größer ist als die 90°, die sie wären, wenn das Molekül planar wäre., Beim Zeichnen einer Strukturformel für ein Molekül wie Methan ist es vorteilhaft, den dreidimensionalen Charakter seiner Form angeben zu können. Die folgende Strukturformel wird als perspektivische Zeichnung bezeichnet. Die gepunktete Linienbindung soll als Zurücktreten in die Seite visualisiert werden, während die feste Dreiecksbindung als Herauskommen aus der Seite visualisiert werden soll.

Abbildung 7. Methan-Perspektive-Modell.
Wie können all diese Kleider auf so kleinem Raum passen?,
Wenn wir Reisen, wir oft nehmen viel mehr Zeug, als wir brauchen. Der Versuch, alles in einen Koffer zu stecken, kann eine echte Herausforderung sein. Wir müssen vielleicht umpacken oder einfach alles zusammendrücken. Atome müssen sich oft dort neu anordnen, wo sich die Elektronen befinden, um eine stabilere Struktur zu erzeugen.

Zentralatom mit einem oder mehreren Einzelpaaren
Die Molekulargeometrien von Molekülen ändern sich, wenn das Zentralatom ein oder mehrere Einzelpaare von Elektronen hat., Die Gesamtzahl der Elektronenpaare, sowohl Bindungspaare als auch Einzelpaare, führt zu der sogenannten Elektronendomänengeometrie. Wenn eines oder mehrere der Verbindungspaare von Elektronen durch ein einzelnes Paar ersetzt wird, wird die molekulare Geometrie (tatsächliche Form) des Moleküls verändert. In Übereinstimmung mit den im vorherigen Abschnitt festgelegten A-und B-Symbolen werden wir E verwenden, um ein einsames Paar auf dem Zentralatom (A) darzustellen. Ein Index wird verwendet, wenn mehr als ein einzelnes Paar vorhanden ist. Einsame Paare auf den umgebenden Atomen (B) beeinflussen die Geometrie nicht.,
AB3E: Ammoniak, NH3
Das Ammoniakmolekül enthält drei Einzelbindungen und ein einzelnes Paar am zentralen Stickstoffatom (siehe Abbildung 8).

Abbildung 8. Lone Paar Elektronen in Ammoniak.
Die Domänengeometrie für ein Molekül mit vier Elektronenpaaren ist tetraedrisch, wie bei CH 4 zu sehen war . Im Ammoniakmolekül ist eines der Elektronenpaare eher ein einzelnes Paar als ein Bindungspaar. Die molekulare Geometrie von NH 3 wird als trigonalpyramidal bezeichnet (siehe Abbildung 9).,

Abbildung 9. Ammoniakmolekül.
Denken Sie daran, dass der Bindungswinkel im tetraedrischen CH4-Molekül 109,5°beträgt. Auch hier komprimiert der Ersatz eines der gebundenen Elektronenpaare durch ein einsames Paar den Winkel leicht. Der H-N-H-Winkel beträgt ungefähr 107°.
AB2E2: Wasser, H2O
Ein Wassermolekül besteht aus zwei Bindungspaaren und zwei Einzelpaaren (siehe Abbildung 10).

Abbildung 10. Lone Paar Elektronen auf dem Wasser.,
Bei Methan und Ammoniak ist die Domänengeometrie für ein Molekül mit vier Elektronenpaaren tetraedrisch. Im Wassermolekül sind zwei der Elektronenpaare eher Einzelpaare als Bindungspaare. Die molekulare Geometrie des Wassermoleküls ist gebogen. Der H-O-H-Bindungswinkel beträgt 104,5°, was kleiner ist als der Bindungswinkel in NH3 (siehe Abbildung 11).

Abbildung 11. Wassermolekül.,
AB4E: Schwefeltetrafluorid, SF4
Die Lewis-Struktur für SF 4 enthält vier Einzelbindungen und ein einzelnes Paar am Schwefelatom (siehe Abbildung 12).

Abbildung 12. Lone Paar Elektronen in SF4.
Das Schwefelatom hat fünf Elektronengruppen um es herum, was der trigonalen bipyramidalen Domänengeometrie entspricht, wie in PCl 5 (siehe Abbildung 13). Denken Sie daran, dass die trigonale bipyramidale Geometrie drei äquatoriale Atome und zwei axiale Atome hat, die an das Zentralatom gebunden sind., Aufgrund der größeren Abstoßung eines einsamen Paares ist es eines der äquatorialen Atome, die durch ein einsames Paar ersetzt werden. Die Geometrie des Moleküls wird als verzerrtes Tetraeder oder Wippe bezeichnet.

Abbildung 13. Ball und stick-Modell für SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- Das Vorhandensein einsamer Paarelektronen beeinflusst die dreidimensionale Form des Moleküls.
Zentrales Atom ohne einzelne Paare
Verwenden Sie den folgenden Link, um die folgenden Fragen zu beantworten:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Wie ist die Form von PF 5 ?
- Welche C-H-Bod-Winkel würden wir für Methan vorhersagen, wenn das Molekül planar wäre?
- Welches Molekül hat die Konfiguration eines Oktaeders?,
Zentralatom mit einem oder mehreren Einzelpaaren
Verwenden Sie den folgenden Link, um die folgenden Fragen zu beantworten:
- Was ist das allgemeine Prinzip im Umgang mit Molekülen, die mehr als vier Elektronenpaare enthalten?
- Warum wird im Bild mit fünf Elektronenpaaren um das Zentralatom die Anordnung rechts bevorzugt?
- Warum ist im Bild mit sechs Elektronenpaaren die Konfiguration mit den einsamen Paaren bei 180o zueinander stabiler?,
Zentralatom ohne einzelne Paare
- Was sind die Bindungswinkel in Kohlendioxid?
- Welches Molekül hat Bindungswinkel von 109,5 ° ?
- Was ist die Geometrie des BF 3 Moleküls?
Zentralatom mit einem oder mehreren einsamen Paaren
- Warum hat Wasser eine gebogene Geometrie?
- Warum ist Ammoniak kein planares Molekül?
- Wie würden wir die Konfiguration für Xenontetrafluorid mit dem ABE-System schreiben?
Zentralatom ohne einzelne Paare
- Was sind die Bindungswinkel in Kohlendioxid?
- Welches Molekül hat Bindungswinkel von 109,5 ° ?
- Was ist die Geometrie des BF 3 Moleküls?
Zentralatom mit einem oder mehreren einsamen Paaren
- Warum hat Wasser eine gebogene Geometrie?
- Warum ist Ammoniak kein planares Molekül?
- Wie würden wir die Konfiguration für Xenontetrafluorid mit dem ABE-System schreiben?















