Grenzen in der Pflanzenwissenschaft
Einführung
Der korrekte Verlauf der Fruchtreife ist unerlässlich, um sowohl eine optimale Fruchtqualität als auch eine lange Haltbarkeit zu erreichen, wichtige Merkmale, die die Preismärkte und Endgewinne bestimmen. Die Reifung ist jedoch ein komplexer Prozess, an dem viele Faktoren beteiligt sind, einschließlich der hormonellen Kontrolle, die biochemische und physiologische Veränderungen reguliert, die endgültige organoleptische und ernährungsphysiologische Fruchteigenschaften verleihen., Traditionell wurden fleischige Früchte nach dem Reifeprozess in klimakterische und nichtklimakterische Früchte eingeteilt. Klimakterische Früchte wie Tomaten oder Bananen erfordern einen Anstieg der Atemfrequenz und der Ethylenproduktion, um den Reifungsprozess in einer autokatalytischen Reaktion zu entfesseln (Barry und Giovannoni, 2007; Liu et al., 2015)., Antagonistisch zeigen nicht-klimakterische Früchte wie Zitrusfrüchte oder Trauben weder vor Beginn der Reifung noch vor Beginn der Atmung einen Ausbruch, und bei diesen Früchten wird die Reifung hauptsächlich durch die fortschreitende Akkumulation der Phytohormonabszessäure kontrolliert (ABA; Rodrigo et al., 2006; Castellarin et al., 2011). Dennoch verstärken neue Studien die Vorstellung, dass der Reifungsprozess nicht nur von der Produktion eines Phytohormons abhängt, sondern eher das Ergebnis eines kontrollierten Hormonhaushalts zu sein scheint (Symons et al., 2012; Teribia et al., 2016; Li et al., 2019).,
Auxine, Salicylsäure (SA) und Melatonin sind Phytohormone, die an der Signalisierung und Regulation vieler entscheidender Prozesse in Pflanzen beteiligt sind. Auxine wurden weithin als Wachstums-und Entwicklungsregulatoren mit mehreren Funktionen in Pflanzen beschrieben (siehe Taylor-Teeples et al., 2016); SA löst die Abwehrreaktion gegen biotrophe und hemi-biotrophe Krankheitserreger aus (Loake und Grant, 2007) und spielt unter abiotischem Stress eine wichtige Rolle (Dong et al., 2014; Wani et al., 2017), Blüte und Zellzykluskontrolle (Carswell et al., 1989; Eberhard et al.,, 1989); und Melatonin hat nicht nur Auxin-ähnliche Funktionen (Chen et al., 2009; Zuo et al., 2014; Wen et al., 2016), aber es wurde auch vorgeschlagen, in einigen Pflanzen als potenzielles Antioxidans zu wirken (Arnao und Hernández-Ruiz, 2015) und als Regulator der Pflanzenreaktionen auf Krankheitserreger (Chen et al., 2018). Interessanterweise haben diese drei Hormone einen gemeinsamen Vorläufer-Chorismat -, Daher tritt ein metabolisches Kreuzgespräch zwischen ihnen auf, und eine Reihe von Genen muss fein reguliert werden, um den Chorismatstoffwechsel in Richtung dieser Verbindungen abzulenken., In den letzten Jahren haben sich mehrere Reviews mit der Biosynthese und Rolle von Auxin befasst (Paul et al., 2012), SA (Asghari und Aghdam, 2010) und melatonin (Feng et al., 2014; Arnao-und Hernández-Ruiz, 2018) in den Früchten. Ihre Biosynthese und Funktionen wurden jedoch meist getrennt beschrieben. Hier werden wir die gemeinsamen und differentiellen Aspekte der Biosynthese, des Stoffwechsels und der Funktion von Auxin, SA und Melatonin beim Wachstum und Reifen von klimakterischen und nicht-klimakterischen Früchten diskutieren., Ein Schwerpunkt wird auf die metabolische Ablenkung gelegt Schlüsselpunkte in ihrer Biosynthese von Chorismat, die regulatorische Rolle während der Reifung von klimakterischen und nicht-klimakterischen Früchten, und ihre Rolle bei der Modulation der Biosynthese von bioaktiven Verbindungen, die weitgehend bestimmt Fruchtqualität.
Chorismat-abgeleitete Phytohormone
Chorismat ist das Endprodukt des Shikimate-Weges und spielt eine Schlüsselrolle bei der Biosynthese von Phytohormonen (Abbildung 1)., Chorismat führt zu aromatischen Aminosäuren, einschließlich Tryptophan, und durch mehrere Reaktionen, einschließlich der Umwandlung von Tryptophan in Indol-3-Pyruvinsäure durch die Tryptophanaminotransferase (TA); es kann die Auxin Indol-3-Essigsäure (IAA) erzeugen. TA wurde als universelles Schlüsselenzym für die IAA-Biosynthese nicht nur in vegetativen Organen vorgeschlagen (Enríquez-Valencia et al., 2018) aber auch bei der Entwicklung von Fortpflanzungsorganen (Reyes-Olalde et al., 2017), einschließlich Fruchtwachstum und Reifung (Estrada-Johnson et al., 2017)., Wenn dagegen Isochorismatsynthase (ICS) aktiviert wird, kann Chorismat in Isochorismat umgewandelt und letzteres in SA umgewandelt werden. Trotz der Tatsache, dass dieser Weg zuerst in Bakterien identifiziert wurde, ist er derzeit auch in Pflanzen gut etabliert (Wildermuth et al., 2001; Uppalapati et al., 2007; Catinot et al., 2008; Garcion et al., 2008; Abreu und Munné-Bosch, 2009). Schließlich kann Tryptophan durch das Enzym Tryptophan-Decarboxylase (TDC) in Tryptamin umgewandelt werden., Obwohl dies ein weiterer der mehreren Wege der IAA-Biosynthese ist (Tryptamin wird zu Indol-3-Acetaldehyd und später zu IAA), wurde vorgeschlagen, dass TDC auch das erste ratenbegrenzende Enzym im Melatoninweg ist (Kang et al., 2007). TDC wurde erstmals in der Familie der Apocynaceae identifiziert (De Luca et al., 1989) später in einer Reihe von Anlagensystemen beschrieben werden (Byeon et al., 2012, 2014; Zhao et al., 2013; Wei et al., 2018)., Nach der Decarboxylierung wird Tryptamin durch die Tryptamin-5-Hydroxylase in Serotonin umgewandelt und dann verwandelt sich Serotonin in N-Acetyl-Serotonin, um schließlich Melatonin im Cytosol zu produzieren (Abbildung 1).
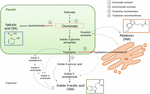
Abbildung 1. Biosynthese von Indol-3-Essigsäure (IAA), Salicylsäure (SA) und melatonin (Mel) aus chorismat. Alle drei Verbindungen haben einen gemeinsamen Endvorläufer (Chorismat, orange quadriert) vom Shikimate-Weg., Wichtige Umleitungsstellen sind mit roten Pfeilen gekennzeichnet und die entsprechenden Abschnitte sind in einer Abstiegsabweichungsreihenfolge von Shikimate nummeriert. Fett gestrichelte Pfeile zeigen mehr als einen Schritt zwischen Verbindungen an. Dünne gestrichelte Pfeile zeigen Wege an, die noch nicht gut definiert sind.
Schlüsselumleitende Enzyme, die zur Synthese der Chorismat-Weghormone führen, wurden kürzlich in fleischigen Früchten identifiziert (Abbildung 1). ICS, dessen Expression nachweislich entscheidend für die biotische Belastungstoleranz ist (Garcion et al.,, 2008; Zeng und Er, 2010), wurde in Tomaten und Äpfeln identifiziert. Zhu et al. (2016) berichtete über die Überexpression von ICS1 (Isochorismatsynthase 1) unter Kühllagerbedingungen in Tomaten, während Zhang et al. (2017) fand die Aktivierung eines Transkriptionsfaktors, der an dem pathogenbezogenen SA-Signalweg beteiligt ist, der die ICS-Expression in Äpfeln induziert. Es wurde berichtet, dass eine erhöhte TDC – Aktivität in unreifen Pfefferfrüchten bei Infektion durch Krankheitserreger auftritt-durch erhöhte TDC1-und TDC2-Expression (Park et al., 2013) – und in der Wachstumsphase in Maulbeerfrüchten (Wang et al., 2016)., Schließlich wurde TA sowohl bei der Prä – als auch bei der Véraison in Weinreben identifiziert (Böttcher et al., 2013; Gouthu und Deluc, 2015) sowie während der Erdbeerreife (Estrada-Johnson et al., 2017). Es ist jedoch bemerkenswert, dass die in klimakterischen Früchten beschriebenen Gene und Enzyme (dh ICS) nicht in nichtklimakterischen Früchten (dh TDC und TA) und umgekehrt identifiziert wurden; Daher sind weitere Studien unerlässlich, um diese Wissenslücken zu schließen und besser zu verstehen, wie diese Diversionspunkte während der Fruchtreife gemeinsam reguliert werden.,
Rolle von Chorismat-abgeleiteten Phytohormonen in klimakterischen und nicht-klimakterischen Früchten
Das Aufdecken der Mechanismen der Fruchtentwicklung war eine der größten Herausforderungen in der jüngsten Agronomieforschung für ihre wirtschaftlichen Auswirkungen. In diesem Zusammenhang wurden Phytohormone als verantwortliche Treiber der Fruchtreife hervorgehoben, insbesondere Ethylen und ABA in klimakterischen bzw. nichtklimakterischen Früchten. Dass diese Phytohormone jedoch die Fruchtentwicklung allein regulieren konnten, erwies sich bald als viel zu einfach., Nach umfangreichen Forschungen und mit der Verbesserung der analytischen Chemie und molekularen Techniken wurden mehrere andere Hormone als potenzielle Regulatoren der Fruchtentwicklung und-reifung bestätigt, einschließlich Phytohormone aus Chorismat.
Auxine vernetzen sich mit anderen Hormonen Während der Fruchtbildung, des Wachstums und der Reifung
Auxine sind eine Gruppe von Pflanzenhormonen, die eine wesentliche Rolle bei der Fruchtentwicklung spielen, indem sie sowohl ihren eigenen Einfluss ausüben als auch die Expression anderer Phytohormone modulieren., Der endogene Gehalt der IAA ist besonders hoch bei Fruchtmengen und während der ersten Wachstumsentwicklungsstadien, wonach die IAA-Mengen vor Beginn der Reifung sowohl im Klimakterium als auch im Klimakterium tendenziell abnehmen (Zaharah et al., 2012) und nicht-klimakterische Früchte (Symons et al., 2012; Teribia et al., 2016), mit anscheinend einigen Ausnahmen, wie Pfirsiche (Tatsuki et al., 2013) und einige Pflaumensorten (El-Sharkawy et al., 2014; Abbildung 2A). Es hat sich gezeigt, dass die IAA ist beteiligt an der Obst-set-initiation in Kombination mit Gibberelline (Mezzetti et al., 2004; Serrani et al., 2010; Bermejo et al., 2018; Hu et al.,, 2018). Eine Beeinträchtigung der IAA-Biosynthese oder-signalisierung führt im Allgemeinen zu einer Parthenokarpie der Früchte, kann jedoch auch zu einer abnormalen Reifung bei einigen Früchten führen (Wang et al., 2005; Liu J. et al., 2018; Reig et al., 2018). Hoher Gehalt an IAA in den Anfangsstadien der Fruchtentwicklung fördert das Fruchtwachstum aufgrund von Auxin-Implikationen bei der Zellteilung in Kombination mit Zytokininen und bei der Kontrolle der Zellexpansion in Kombination mit Gibberellinen (Liao et al., 2018)., Während dieser Zeit ermöglicht der hormonelle Übersprechen zwischen Auxinen und Gibberellinen zusätzlich eine normale Fruchtformung in einer fein abgestimmten Regulation, die durch Auxin-Reaktionsfaktoren vermittelt wird (ARFs; Liao et al., 2018; Liu, S. et al., 2018).
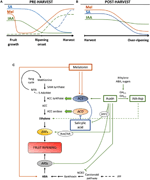
Abbildung 2. Rolle von IAA, SA und Mel bei der Entwicklung von klimakterischen und nicht-klimakterischen Früchten. Modell, das die Wechselwirkungen von IAA, SA und Mel während der Reifung von klimakterischen und nicht-klimakterischen Früchten während (A) vor und (B) nach der Ernte zusammenfasst., Gestrichelte Linien zeigen die Dynamik des Phytohormongehalts in einigen Früchten an (siehe Diskussionstext). (C) Überblick über die Wechselwirkung von IAA, SA und Mel mit Ethylen-und Abscisinsäure (ABA) – Biosynthese in klimakterischen und nicht-klimakterischen Früchten. Auxin ist ein positiver Regulator der Ethylen-Biosynthese durch die Aktivierung von ACC-Synthase-Genen (ACS) und induziert die Expression von Ethylen-responsiven Faktoren (ERFs). Auxin unterdrückt auch die ABA-Produktion durch 9-cis-Epoxycarotenoiddioxygenase (NCED) – Repression und hemmt ABA-responsive Stressgene (ARS) durch das ARF2-Protein., Endogene IAA-Gehalte können durch GH3-Proteine reduziert werden, deren Synthese durch Ethylen, ABA und Zucker gefördert wird. Diskontinuierliche Linie zeigt die mögliche Rolle von IAA durch IAA-Asp als Reifefaktor, der Ethylen in einigen Früchten verstärkt. Melatonin erhöht die ABA – und Ethylenproduktion, obwohl ACS abhängig vom Melatoningehalt gehemmt werden kann. SA wirkt als Inhibitor von Ethylen-Repressions-ACC-Oxidase (ACO) – Genen, obwohl es die Expression von ACS fördern kann., MTA, 50-Methylthioadenosin; S-AdoMet, S-Adenosyl-Methionin; SAM-Synthase, S-Adenosyl-Methionin-Synthase; ACC, 1-Aminocyclopropan-1-Carbonsäure; IPP, Isopentenyldiphosphat.
Es wurde berichtet, dass Reduktionen des endogenen IAA-Gehalts vor Beginn der Reifung in mehreren Früchten auftreten. Diese Reduktionen standen im Zusammenhang mit der IAA-Konjugation mit Asparaginsäure (IAA-Asp) durch IAA-Amido-Synthetasen, GH3-1 und GH3-2 (Abbildung 2C)., In der Tat zeigten GH3-1 und GH3-2 eine höhere Expression während der frühen Fruchtentwicklung und insbesondere während der Reifung, sowohl in klimakterischen Früchten wie Tomaten (Sravankumar et al., 2018) und äpfel (Onik et al., 2018), sowie in nicht-klimakterischen Früchten, wie Traubenbeeren (Böttcher et al., 2010, 2011) und Himbeeren (Bernales et al., 2019)., Interessanterweise zeigten Traubenbeeren nach ABA-und Ethephonanwendung eine verstärkte GH3-1-Expression, was die Beteiligung von Ethylen an der Kontrolle des IAA-Gehalts nach Beginn der Reifung auch bei nichtklimakterischen Früchten erklären könnte (Böttcher et al., 2010). Tatsächlich zeigen mehrere Studien die enge Wechselwirkung zwischen Auxinen und Ethylen bei der Fruchtreife mit einem gegenseitigen Einfluss zwischen ihnen (Tadiello et al., 2016a; Busatto et al., 2017)., Bei klimakterischen Früchten ist ein erhöhter Gehalt an IAA erforderlich, um die Expression von ACC-Synthase-Genen (ACS) zu aktivieren, die für ACC-Synthase kodieren, was wiederum dazu führt, dass die Ethylenproduktion den Reifungsprozess auslöst (Abbildung 2C; Tatsuki et al., 2013). Früchte wie Tomaten (Li et al., 2016) oder Bananen (Choudhury et al.,, 2008), bei denen in der Regel vor Beginn der Reifung reduzierte IAA-Gehalte auftreten, zeigen eine Reifeverzögerung, wenn IAA oder Analoga exogen angewendet werden, während Früchte wie Pfirsiche, deren IAA-Gehalt bis zur vollständigen Reifung progressiv ansteigt, eine beschleunigte Reifung zeigen, wenn Auxine angewendet werden (Tadiello et al., 2016b). Daher muss eine enge, komplexe und differentielle Regulation der Auxin-Ethylen-Wechselwirkungen in verschiedenen Früchten während der Preharvest-Reifung bestehen., Darüber hinaus nimmt der IAA-Gehalt vor Beginn der Reifung in einigen nicht-klimakterischen Früchten ab, um die 9-cis-Epoxycarotenoiddioxygenase (NCED) zu de-reprimieren und die ABA-Synthese zu starten (Abbildung 2C; Jia et al., 2016). Interessanterweise wird dieser Prozess auch durch IAA-Konjugation durch verstärkte GH3-1-Aktivität vermittelt (Böttcher et al., 2010). Dennoch Estrada-Johnson et al. (2017) zeigte, dass, obwohl der IAA-Gehalt während der Erdbeerreife abnimmt, die Expression von FaAux/IAA-und FaARF-Genfamilien in roten Gefäßen induziert wird, was auf die Beteiligung der Auxin-Signalgebung in vollständig reifen Früchten hindeutet.,
Während der Nachernte bleibt der Auxin-Gehalt in der Regel invariant oder nimmt aufgrund oxidativer Prozesse ab, die zu einer geringen, aber fortschreitenden Verringerung des endogenen Gehalts der IAA führen können (Abbildung 2B). Auxin-Behandlungen nach der Ernte verzögern die Überreifung in einigen Früchten (Chen et al., 2016; Moro et al., 2017) und erhöhen den Gehalt einiger organischer Säuren unter Beibehaltung der Fruchtsäure (Li et al., 2017), was darauf hindeutet, dass Auxin auch eine bedeutende Rolle bei der Kontrolle der Fruchtreife während der Nachernte spielt.,
Mehrere Rollen von Salicylsäure während der Fruchtentwicklung und-reifung
Salicylsäure ist ein weiteres Phytohormon aus Chorisat, das hauptsächlich mit seiner schützenden Wirkung unter biotischem Stress in Verbindung gebracht wurde, um die Verluste vor der Ernte und nach der Ernte durch pathogene Fruchtinfektionen zu kontrollieren (Babalar et al., 2007; Cao et al., 2013). Im Allgemeinen sind die endogenen Gehalte an freiem SA zu Beginn der Fruchtentwicklung höher und nehmen dann progressiv ab (Oikawa et al., 2015). Lu et al. (2015) berichtete einen sekundären Anstieg der SA während der zweiten Wachstumsphase von Pfirsichfrüchten., Die exogene Anwendung von SA in Bananen verzögerte den Reifeprozess, wodurch das Atmungssystem und das Verhältnis von Fruchtfleisch zu Schale verringert wurden, sowie die Aktivität von Enzymen im Zusammenhang mit dem Abbau der Zellwand und dem antioxidativen System (Srivastava und Dwivedi, 2000). Darüber hinaus erhöhte die Behandlung von Süßkirschenbäumen mit Salicylsäure und Acetylsalicylsäure (ASS) das Gewicht, die Festigkeit und die Farbe von Kirschen im kommerziellen Stadium (Giménez et al., 2014). Exogene Anwendung von SA oder Metylsalicylat (MeSA) während der Nachernte, verzögerte Überreifung in Früchten wie Kiwis (Zhang et al.,, 2003) und Süßkirschen (Valero et al., 2011). Darüber hinaus linderten Behandlungen mit Salicylsäure oder ASS die Kälteverletzung von Granatäpfeln (Sayyari et al., 2011), Tomaten (Ağdam et al., 2014) und avocados (Glowacz et al., 2017). SA interagiert auch mit Ethylen durch Hemmung der ACC-oxidase (ACO), Ausdruck (Shi und Zhang, 2012). Überraschenderweise wird auch nach SA-Anwendung in dosisregulierter Weise ein erhöhter Gehalt an ACS-Expression in Birnen festgestellt (Shi et al., 2013; Shi und Zhang, 2014). Daher ist die Regulierung der Ethylenproduktion in Abhängigkeit von SA fein geregelt (Abbildung 2C).,
Melatonin: Ein aufstrebender Regulator für die Kontrolle der Fruchtentwicklung
Melatonin ist auch ein Pflanzenhormon aus dem Chorismat-abgeleiteten Weg, das in den letzten Jahren viel Aufmerksamkeit erlangt hat (Hernández-Ruiz et al., 2005; Arnao-und Hernández-Ruiz, 2018; Sharif et al., 2018). In jüngster Zeit wurde Melatonin als wichtiger Faktor für Fruchtsäfte in ähnlicher Weise wie IAA-Effekte hervorgehoben (Abbildung 2A; Liu S. et al., 2018). Außerdem wurde die zirkadiane Produktion dieses Phytohormons beobachtet (Kolář et al., 1997)., Während der Reifung am Baum zeigten Trauben, die mit Melatonin behandelt wurden, eine höhere Synchronizität und ein erhöhtes Gewicht, wenn sie vollständig reifen (Meng et al., 2015). Darüber hinaus eine weitere aktuelle Studie von Xu et al. (2018) beschrieben, dass Melatonin die Reifung von Traubenbeeren durch seine Wechselwirkung mit ABA und Ethylen sowie Wasserstoffperoxid fördern könnte. Es wurde gezeigt, dass Melatonin während der Kühllagerung von Früchten eine Kühltoleranz verleiht, die hauptsächlich mit seiner antioxidativen Aktivität zusammenhängt (Cao et al., 2018; Agdam et al., 2019)., Während der Nachernte zeigten Tomaten eine erhöhte Ethylenemission nach Anwendung von Melatonin bei 50 µM (Sun et al., 2015), im Gegensatz zu Birnen, bei denen die exogene Anwendung von Melatonin bei 100 µM die Ethylenproduktion hemmte (Zhai et al., 2018) oder Bananenfrüchte, bei denen Melatonin bei 50-200 µM die Expression von ACS und ACO hemmte (Abbildung 2C; Hu et al., 2017). Obwohl verschiedene Wirkungen der Melatoninanwendung mit einem Dosierungseffekt zusammenhängen können, sind weitere Untersuchungen erforderlich, um die Rolle von Melatonin bei der Kontrolle der Fruchtentwicklung besser zu verstehen.,
Cross-Talk von Chorismat-abgeleiteten Phytohormonen bei der Kontrolle der Fruchtentwicklung
Es wurde gezeigt, dass während der Fruchtentwicklung und-reifung ein hormoneller Crosstalk zwischen Chorismat-abgeleiteten Phytohormonen auftritt. Breitel et al. (2016) fanden heraus, dass Auxine über ARF2 mit SA interagieren können (Abbildung 2C) und dass die Überexpression von ARF2 in Tomaten zu einem geringeren SA-Gehalt und einer signifikanten Reifeverzögerung führte., Dies deutet darauf hin, dass Auxine die SA-Produktion während der Fruchtentwicklung einschränken könnten, was einen Kompromiss zwischen dem Fruchtwachstum (vermittelt durch Auxin) und der Aktivierung der biotischen Abwehrkräfte (vermittelt durch SA) erklären könnte. Darüber hinaus führte die exogene Anwendung von SA auf Papayafrüchte zu einer veränderten Expression mehrerer IAA-Gene, von denen einige herunterreguliert und andere hochreguliert wurden (Liu et al., 2017)., In diesem Fall, die Ergebnisse waren nicht schlüssig, was wirklich geschieht endogen in den vermeintlichen übersprechen zwischen auxin und SA während der Fruchtreife und weitere Forschung ist erforderlich, in diesem und anderen klimakterischen Früchten. In jedem Fall ist klar, dass IAA und SA eng miteinander verbunden sind, nicht nur metabolisch, sondern auch funktionell. Schließlich haben mehrere Studien über den Einfluss von Melatonin auf die Biosynthese und/oder Signalisierung von IAA und SA berichtet (überprüft in Arnao und Hernández-Ruiz, 2018), obwohl unseres Wissens keine dieser Studien durchgeführt wurde weder in klimakterischen noch in nicht-klimakterischen Früchten.,
Modulation bioaktiver Verbindungen Biosynthese durch Chorismat-abgeleitete Phytohormone
Bioaktive Verbindungen (einschließlich phenolischer Verbindungen, Isoprenoide und antioxidativer Vitamine) wurden nicht nur weithin als verantwortlich für spezifische organoleptische Eigenschaften von Lebensmitteln untersucht, sondern auch für ihre schützende Wirkung in menschlichen Zellen gegen oxidative Prozesse bei der Entwicklung neurodegenerativer und kardiovaskulärer Erkrankungen und bestimmter Krebsarten (Liu et al., 1999; Mueller et al., 2010; Stör-und Ronnenberg, 2010; Björkman et al., 2011)., Phenolische Verbindungen tragen wesentlich dazu bei, bestimmte Aromen wie Tannine – verantwortlich für den Bitterkeits – oder Adstringenzgeschmack bestimmter Früchte-und Farben wie Anthocyanpigmente-zu vermitteln, die für rote, blaue und violette Fruchtfarben verantwortlich sind (Croteau et al., 2000). Die Relevanz phenolischer Verbindungen für den menschlichen Verzehr wurde mit einer schützenden Wirkung gegen oxidative Prozesse in Bezug auf die Gesundheit des Herz-Kreislauf-und Zentralnervensystems sowie einem verringerten Risiko für Krebserkrankungen des Gastrointestinaltrakts in Verbindung gebracht (Björkman et al., 2011)., Carotinoide, zu Isoprenoiden gehörende Tetraterpene, spielen eine Rolle beim Schutz vor photooxidativen Prozessen und als organische Pigmente; Sie sind verantwortlich für die orange-gelbe Farbe von Früchten (Tapiero et al., 2004). Es wird angenommen, dass Carotinoide aus der Nahrung aufgrund ihrer Rolle als Antioxidantien gesundheitliche Vorteile bei der Verringerung des Risikos für Augenkrankheiten und bestimmte Krebsarten bieten (Johnson, 2002). Die Vitamine C und E, einschließlich Ascorbinsäure und Tocopherole, sind wesentliche Qualitätsfaktoren für die Ernährung bei Früchten mit vielen biologischen Aktivitäten beim Menschen (Miret und Müller, 2017)., In Anbetracht der relevanten Rolle all dieser bioaktiven Verbindungen als gesundheitsfördernde Verbindungen in Früchten ist die Modulation ihrer Akkumulation sowohl bei klimakterischen als auch bei nichtklimakterischen Früchten von größter Bedeutung (Vasconsuelo und Boland, 2007). Die meisten dieser bioaktiven Verbindungen werden während der Fruchtreife auf hohem Niveau akkumuliert, wenn weniger schmackhafte grüne Früchte zu einer ernährungsphysiologisch reichen, farbigen und schmackhaften Frucht zusammenlaufen (Daood et al., 1996; Ranalli et al., 1998; Dumas et al., 2003; Singh et al., 2011)., Nach Beginn kann die Reifung jedoch nicht zum Stillstand kommen und führt im Allgemeinen zu einer Überreifung, die sich negativ auf die Fruchtqualität auswirkt (Kumar et al., 2014). Daher bleibt die Minimierung des Fruchtverlusts nach der Ernte bei gleichzeitiger Erzielung eines hohen Gehalts an bioaktiven Verbindungen eine der größten zu lösenden Herausforderungen.
Auxin wurde als wichtiger Regulator der Carotinoidbiosynthese während der Reifung von klimakterischen Tomatenfrüchten identifiziert. Die Reifung in Tomaten ist mit dem Abbau von Chlorophyll und der Verschiebung von Xanthophyllen zu Carotinen (β-Carotin und Lycopin) verbunden (Fraser et al., 1994)., IAA scheint die Tomatenreife zu verzögern, indem Ethylen und mehrere vorgeschaltete Carotinoidtranskripte, einschließlich Psy, Ziso, Pds, Ziso sowie Chlasen 1-3, unterdrückt und andererseits die Akkumulation von β-Lyc1-und Crtr-β1-Transkripten gefördert werden, was zu höheren Gehältern an Xanthophyllen und Chlorophyll a führt (Su et al., 2015). Darüber hinaus scheint Auxin in einigen nicht-klimakterischen Früchten wie Kirschen-und Traubenbeeren auch die Anthocyanbiosynthese zu modulieren und dadurch die Fruchtreife zu kontrollieren. Teribia et al., (2016) berichtete über eine negative Korrelation zwischen IAA-und Anthocyaningehalten, die darauf hinweist, dass die Anthocyaninakkumulation beginnt, wenn der IAA-Gehalt abnimmt. Darüber hinaus verzögerte die Anwendung der synthetischen Auxin-ähnlichen Verbindung Benzothiazol-2-Oxyessigsäure (BTOA) die Hochregulation von Genen, die Enzyme der Anthocyanbiosynthese wie Chalconsynthase und UDP-Glucose fördern:Flavonoid-3-O-Glucosyltransferase in Traubenbeeren (Davies et al., 1997).,
Es wurde berichtet, dass Behandlungen vor und nach der Ernte mit Salicylaten, einschließlich SA und seinen Derivaten ASS und MeSA, die Akkumulation bioaktiver Verbindungen regulieren, was zu einer verbesserten antioxidativen Aktivität sowohl in klimakterischen als auch in nichtklimakterischen Früchten führt. Es ist bekannt, dass mehrere Früchte wie Pflaumen, Kirschen und Aprikosen ein kurzes Leben mit einer raschen Qualitätsverschlechterung nach der Ernte haben. Daher wird ständig nach Behandlungen gesucht, die die Fruchtqualität verbessern und erhalten, und insbesondere nach dem Gehalt an bioaktiven Verbindungen mit positiven gesundheitlichen Auswirkungen., Die Behandlung von Pflaumen mit SA, ASS und MeSA führte zu signifikant höheren Gehältern an Ascorbinsäure, Anthocyanen und Phenolverbindungen sowohl bei der Ernte als auch nach längerer Kühllagerung (40 Tage bei 4°C; Martínez-Esplá et al., 2017). Ähnliche Ergebnisse konnten bei Preharvest-Behandlungen mit SA, ASS und MeSA in Süßkirschen beobachtet werden (Giménez et al., 2014, 2015, 2017). Darüber hinaus hielt die Behandlung nach der Ernte mit SA, ASS oder MeSA den gesamten Phenolgehalt sowie den Anthocyaningehalt während der Kühllagerung in Granatapfel aufrecht (Sayyari et al., 2011), Süßkirsche (Valero et al.,, 2011), Kornelkirsche (Dokhanieh et al., 2013) und Aprikose (Wang et al., 2015). Diese Ergebnisse legen nahe, dass Salicylate an der Aktivierung der Phenylalanin-Ammoniak-Lyase beteiligt sein können, dem Hauptenzym, das am Biosyntheseweg phenolischer Verbindungen beteiligt ist (Martínez-Esplá et al., 2017).
Kürzlich wurde gezeigt, dass Melatonin die Fruchtreife reguliert und bioaktive Verbindungen moduliert. Behandlungen nach der Ernte mit Melatonin in Pfirsichfrüchten erhöhten die Kühltoleranz durch Aktivierung antioxidativer Systeme., Kühlende Verletzungen treten bei Pfirsichfrüchten bei Lagerung bei niedriger Temperatur (zwischen 2 und 7,6°C) auf, die durch Fleischbräunung, abnormale Reifung und höhere Fäulnisempfindlichkeit gekennzeichnet sind (Lurie und Crisosto, 2005). Cao et al. (2018)berichtete, dass Pfirsiche, die mit Melatonin behandelt wurden, eine höhere Transkript-Häufigkeit von Ascorbinsäure-Biosynthese-Genen PpGME, ppGpp und PpGLDH am siebten und PpGMPH am 21. und 28., Darüber hinaus induzierte Melatonin einen Anstieg der Aktivitäten von G6PDH, SKDH und PAL, den essentiellen Enzymen für die Biosynthese phenolischer Verbindungen. Die Autoren schlagen vor, dass die Melatoninbehandlung Pfirsichfrüchte bis zu einem gewissen Grad vor Kälteschäden schützt, indem sie spezifisch die Biosynthese phenolischer Verbindungen aktiviert (Gao et al., 2018). Darüber hinaus ergab eine etikettenfreie Differentialproteomikanalyse die Wirkung von Melatonin auf die Förderung der Fruchtreife und der Anthocyanansammlung nach der Ernte in Tomatenfrüchten (Sun et al., 2016)., Die Autoren berichteten, dass exogenes Melatonin acht Enzyme erhöhte, die mit dem Anthocyanweg in Verbindung standen, darunter unter anderem Flavonol-3-Hydroxylase, Flavanon-3-Beta-Hydroxylase, Anthocyanidinsynthase/Leucoanthocyanidin-Dioxygenase und Anthocyanidin-3-O-Glucosyltransferase. Darüber hinaus erhöhte die Behandlung nach der Ernte mit Melatonin die Gesamtphenole und Anthocyane in Erdbeerfrüchten (Aghdam und Fard, 2016) und verzögerte den Verlust von Gesamtphenolen, Flavonoiden und Anthocyanen in Litschifrüchten (Zhang et al., 2018)., Behandlungen mit Melatonin erhöhten den Gehalt an Phenolen, Anthocyanen und Flavonoiden in Traubenbeeren (Xu et al., 2017). Darüber hinaus wurde berichtet, dass Melatonin die Ansammlung von Lycopin und die Ethylenproduktion in Tomaten erhöht, was darauf hindeutet, dass Melatonin den Gehalt an Lycopin erhöhen kann, indem es die Ethylenbiosynthese und-signalgebung beeinflusst (Sun et al., 2015)., Die Beteiligung von Ethylen an der Melatonin-induzierten Regulation bioaktiver Verbindungen wurde auch in Traubenbeeren beobachtet, wo die Doppelblockbehandlung von Ethylen reduzierte Wirkungen von Melatonin auf den Polyphenolgehalt zeigte (Xu et al., 2017).
Schlussfolgerung
Es wird der Schluss gezogen, dass Chorismat-abgeleitete Phytohormone, einschließlich Auxin, SA und Melatonin, nicht nur einen gemeinsamen Vorläufer haben, sondern eine wesentliche Rolle bei der Regulierung des Fruchtwachstums und der Reifung spielen., Eine metabolische und funktionelle Kreuzung zwischen ihnen und anderen Phytohormonen erfolgt räumlich-zeitlich, um die Entwicklung von klimakterischen und nicht-klimakterischen Früchten fein zu regulieren. Die Unterschiede in der Dynamik innerhalb von klimakterischen und nicht-klimakterischen Früchten zeigen, dass die Reaktion von Chorismat-abgeleiteten Hormonen nicht universell, sondern eher stark speziesspezifisch ist. Darüber hinaus modulieren Chorismat-abgeleitete Phytohormone auch die Ansammlung bioaktiver Verbindungen und beeinflussen so die Fruchtqualität., Weitere Untersuchungen sind jedoch erforderlich, um besser zu verstehen, wie (i) andere Hormone wie Ethylen und ABA ihre Biosynthese an wichtigen metabolischen Umlenkungspunkten modulieren, (ii) sie auf funktioneller und molekularer Ebene interagieren und (iii) Sie modulieren gemeinsam bioaktive Verbindungen Biosynthese und beeinflussen folglich nicht nur das Fruchtwachstum und die Reifung, sondern auch die Qualität klimakterischer und nichtklimakterischer Früchte.
Autorenbeiträge
SM-B konzipierte und gestaltete die Rezension mit Hilfe von MP-L. MP-L, PM, MM und SM-B schrieb das Manuskript., MP-L bereitete Zahlen mit Hilfe von PM vor. Alle Autoren trugen zur Diskussion von Ideen bei, überarbeiteten und genehmigten das endgültige Manuskript.
Finanzierung
Diese Arbeit wurde durch einen ICREA Academia Award finanziert, der SM-B von der katalanischen Regierung verliehen wurde.
Interessenkonflikterklärung
Die Autoren erklären, dass die Untersuchung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Böttcher, C., Chef, P. K., and Davies, C. (2011)., Acylsubstratpräferenzen einer IAA-Amido-Synthetase erklären Variationen in der Traubenreife (Vitis vinifera L.), die durch verschiedene auxinische Verbindungen verursacht werden, was auf die Bedeutung der Auxin-Konjugation in der Pflanzenentwicklung hinweist. J. Exp. Bot. 62, 4267–4280. doi: 10.1093/jxb/err134
PubMed Abstract | CrossRef Full Text | Google Scholar
Glowacz, M., Bill, M., Tinyane, P. P., und Sivakumar, D. (2017)., Aufrechterhaltung der Postharvest-Qualität von kalt gelagerten „Hass“ – Avocados durch Veränderung des Fettsäuregehalts und der Zusammensetzung unter Verwendung natürlicher flüchtiger Verbindungen – Methyljasmonat und Methylsalicylat. J. Sci. Lebensmittel. Agric. 97, 5186–5193. doi: 10.1002/jsfa.8400
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, W., und Er, S. Y. (2010). Eine herausragende Rolle des Flagellin-Rezeptors FLAGELLIN-SENSING2 bei der Vermittlung der stomatalen Reaktion auf Pseudomonas syringae pv – DC3000 bei Arabidopsis. Pflanzenphysiol. 153, 1188–1198. doi: 10.1104/pp. 110.,157016
PubMed Abstract | CrossRef Full Text | Google Scholar















