Wie Influenza (Grippe) Impfstoffe hergestellt werden
- Eibasierte Grippeimpfstoffe
- Zellbasierte Grippeimpfstoffe
- Rekombinante Grippeimpfstoffe
Für die Vereinigten Staaten gibt es drei verschiedene Influenza-Impfstoffproduktionstechnologien, die von der US Food and Drug Administration (FDA)zugelassen sind externes Symbol:
- Grippeimpfstoff auf Eibasis,
- Grippeimpfstoff auf Zellbasis und
- rekombinanter Grippeimpfstoff.,
Alle handelsüblichen Grippeimpfstoffe in den USA werden von privaten Herstellern hergestellt. Verschiedene Hersteller verwenden unterschiedliche Produktionstechnologien, aber alle Grippeimpfstoffe erfüllen die Sicherheits-und Wirksamkeitsanforderungen der FDA. Verschiedene Impfstoffe haben unterschiedliche Indikationen. Siehe Influenza-Impfstoffe-Vereinigte Staaten, Influenza-Saison 2019-2020 für spezifische Indikationen.
Grippeimpfstoffe auf Eibasis
Die gebräuchlichste Art, Grippeimpfstoffe herzustellen, ist die Verwendung eines Herstellungsprozesses auf Eibasis
, der seit mehr als 70 Jahren verwendet wird., Die Herstellung von Impfstoffen auf Eibasis wird verwendet, um sowohl einen inaktivierten (abgetöteten) Impfstoff (normalerweise als „Grippeschuss“ bezeichnet) als auch einen abgeschwächten (geschwächten) Lebendimpfstoff (normalerweise als „Nasenspray-Grippeimpfstoff“bezeichnet) herzustellen.
Der eibasierte Produktionsprozess beginnt mit CDC oder einem anderen Laborpartner im WHO Global Influenza Surveillance and Response System, das Herstellern im privaten Sektor Kandidaten-Impfstoffviren (CVVs) zur Verfügung stellt, die gemäß den geltenden FDA-Vorschriften in Eiern angebaut werden., Diese CVVs werden dann in befruchtete Hühnereier injiziert und mehrere Tage inkubiert, damit sich die Viren replizieren können. Die Flüssigkeit, die das Virus enthält, wird aus den Eiern geerntet. Für inaktivierte Influenza-Impfstoffe (d. H. Grippeschüsse) werden die Impfviren dann inaktiviert (abgetötet) und das Virus-Antigen wird gereinigt. Der Herstellungsprozess wird mit Qualitätsprüfung, Abfüllung und Vertrieb fortgesetzt. Für den Nasenspray-Grippeimpfstoff (d. H. Den Live Attenuated Influenza Vaccine – LAIV) sind die Start-CVVs lebende, aber geschwächte Viren, die einen anderen Produktionsprozess durchlaufen., FDA testet und genehmigt alle Influenza-Impfstoffe vor der Freigabe und Versand.
Es gibt verschiedene Hersteller, die diese Produktionstechnologie verwenden, um Grippeimpfstoffe für den Einsatz in den USA herzustellen. Diese Produktionsmethode erfordert eine große Anzahl von Hühnereiern zur Herstellung von Impfstoffen und kann länger dauern als andere Produktionsmethoden.
Grippeimpfstoffe auf Zellbasis
Es gibt auch einen zellbasierten Produktionsprozess für Grippeimpfstoffe, der 2012 von der FDA zugelassen wurde. Bis vor kurzem begann dieser Produktionsprozess auch mit eiergezüchteten CVVs gemäß den FDA-Vorschriften., August 2016 erteilte die FDA eine Genehmigung für Seqirus, den einzigen von der FDA zugelassenen Hersteller von Grippeimpfstoffen auf Zellbasis in den USA, um mit der Verwendung von CVVs aus Zellwachstum zu beginnen. Zellbasierte Herstellung wird verwendet, um inaktivierte Grippeimpfstoffe (z. B. die Grippeimpfung) herzustellen.
Der Prozess der Erstellung zellbasierter Grippeimpfstoffe umfasst mehrere Schritte. Zunächst verwendet CDC oder einer seiner Laborpartner Influenzaviren, die in Zellen gezüchtet wurden, um CVVs herzustellen, die dann einem Impfstoffhersteller zur Verfügung gestellt werden., Als nächstes geimpft der Impfstoffhersteller die CVVs in kultivierte Säugetierzellen (anstelle in Eier) und ermöglicht es den CVVs, sich für einige Tage zu replizieren (d. H. Kopien zu erstellen). Dann wird die virushaltige Flüssigkeit aus den Zellen gesammelt und das Virusantigen gereinigt. Der Herstellungsprozess wird mit Reinigung und Prüfung fortgesetzt. Schließlich testet und genehmigt die FDA die Impfstoffe vor der Freigabe und dem Versand.
Die Produktion von Grippeimpfstoffen auf Zellbasis erfordert keine Hühnereier, da die zur Herstellung des Impfstoffs verwendeten Impfstoffviren in tierischen Zellen gezüchtet werden., Zellbasierte Technologie hat auch das Potenzial für eine schnellere Inbetriebnahme des Herstellungsprozesses von Grippeimpfstoffen.
Während Viren, die im zellbasierten Impfstoff der vergangenen Saison verwendet wurden, in Zellen gezüchtet wurden, wurden einige der dem Hersteller zur Verfügung gestellten Viren vor der Saison 2019-2020 ursprünglich in Eiern gewonnen. Für die Influenza-Saison 2019-2020 sind alle vier Grippeviren, die in dem zellbasierten Impfstoff verwendet werden, zellabhängig, wodurch der Impfstoff eifrei wird.
Weitere Informationen finden Sie auf der CDC-Webseite für zellbasierte Grippeimpfstoffe.,
Rekombinante Grippeimpfstoffe
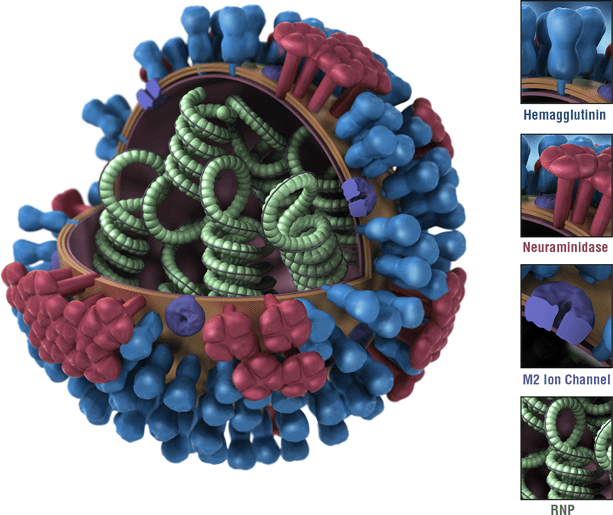
Dies ist ein Bild eines Influenzavirus. Die Oberflächenproteine des Virus Hämagglutinin (HA) sind blau dargestellt. Die Bestandteile eines Influenzavirus sind Antigene. Antigene sind Merkmale des Influenzavirus, die vom Immunsystem erkannt werden und eine schützende Immunantwort auslösen. Die meisten Grippeimpfstoffe sind so konzipiert, dass sie eine Immunantwort gegen die Verwendung zirkulierender Influenza-Impfstoffe auslösen.,
Es gibt eine dritte Produktionstechnologie für Grippeimpfstoffe, die 2013 für den US-Markt zugelassen wurde und bei der rekombinante technologieexternes Symbol. Rekombinante Grippeimpfstoffe erfordern keine CVV-Probe (Candidate Vaccine Virus) zur Herstellung. Stattdessen werden rekombinante Impfstoffe synthetisch hergestellt. Um einen rekombinanten Impfstoff herzustellen, erhalten Grippewissenschaftler Zuerst DNA, d. H. Genetische Anweisungen, um ein Oberflächenprotein namens Hämagglutinin (HA) herzustellen, das auf Influenzaviren gefunden wird., HA ist ein Antigen, das ein Merkmal eines Grippevirus ist, das das menschliche Immunsystem dazu veranlasst, Antikörper zu bilden, die spezifisch auf das Virus abzielen. Diese DNA zur Herstellung von Grippevirus-HA-Antigen wird dann mit einem Baculovirus kombiniert, einem Virus, das Wirbellose infiziert. Dies führt zu einem „rekombinanten“ Virus. Die Rolle des Baculovirus besteht darin, die DNA-Anweisungen zur Herstellung des Virus-HA-Antigens in eine Wirtszelle zu transportieren. Sobald das rekombinante Virus in eine von der Food and Drug Administration (FDA) qualifizierte Wirtszelllinie eintritt, werden die Zellen angewiesen, das HA-Antigen schnell zu produzieren., Dieses Antigen wird in großen Mengen gezüchtet, gesammelt, gereinigt und dann als rekombinanter Grippeimpfstoff verpackt. Diese Impfstoffe werden dann von der FDA auf Qualität und Wirksamkeit getestet, bevor die FDA die Freigabe der Impfstoffpartien an die Öffentlichkeit genehmigt.
Diese Produktionsmethode erfordert kein Impfvirus aus Eiern und verwendet im Produktionsprozess überhaupt keine Hühnereier. Während es andere Impfstoffe auf dem US-Markt gibt, die ähnliche rekombinante Herstellungsverfahren verwenden, gibt es nur einen Influenza-Impfstoff, der mit rekombinanter Technologie hergestellt wird, die derzeit von der FDA für den Einsatz in den USA zugelassen ist., Dieser Produktionsprozess ist der schnellste, da er nicht durch die Auswahl von Impfstoffviren begrenzt ist, die für das Wachstum in Eiern oder die Entwicklung von zellbasierten Impfstoffviren geeignet sind.
CDC und FDA überwachen die Sicherheit aller in den USA zugelassenen Impfstoffe, einschließlich saisonaler Influenza-Impfstoffe. Weitere Informationen zur Sicherheit der ei-basierten, zellbasierten und rekombinanten Influenza, einschließlich unerwünschter Ereignisse, Kontraindikationen und Vorsichtsmaßnahmen, Screening und sicherer Impfstoffverabreichung, finden Sie unter Saisonale Influenza-Impfstoffsicherheit: Eine Zusammenfassung für Kliniker.,
- Die Entwicklung und Revolution von Grippeimpfstoffenexternes Symbol auf der Website der US Food and Drug Administration.
- Grippeimpfstoffforschungexternes Symbol auf der Website des National Institute of Allergy and Infectious Diseases Institute, NIH.
- Influenza-Impfstoff Fortschritte















