Drusen maculaire précoce et glomérulopathie C3 (anciennement drusen associé à la glomérulonéphrite membranoproliférative de type II)
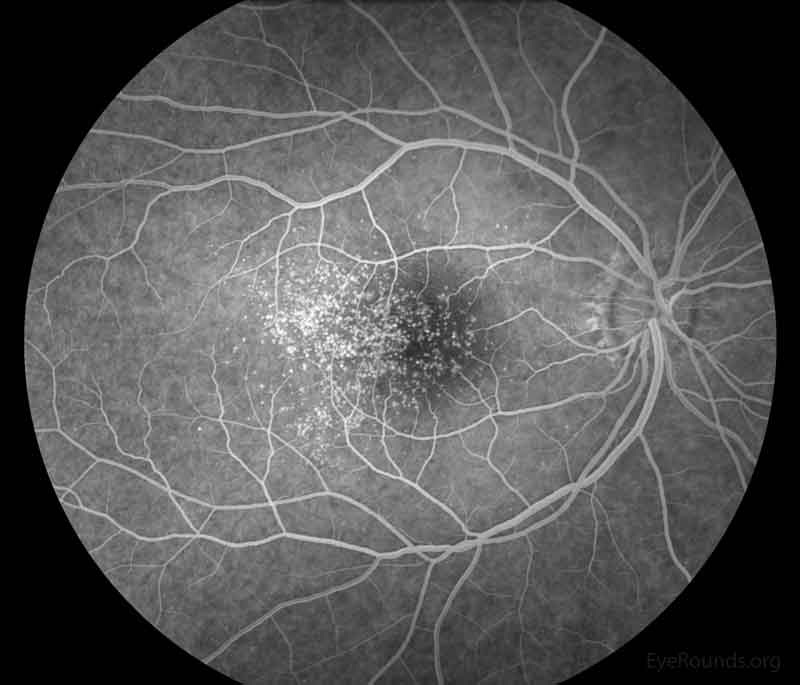
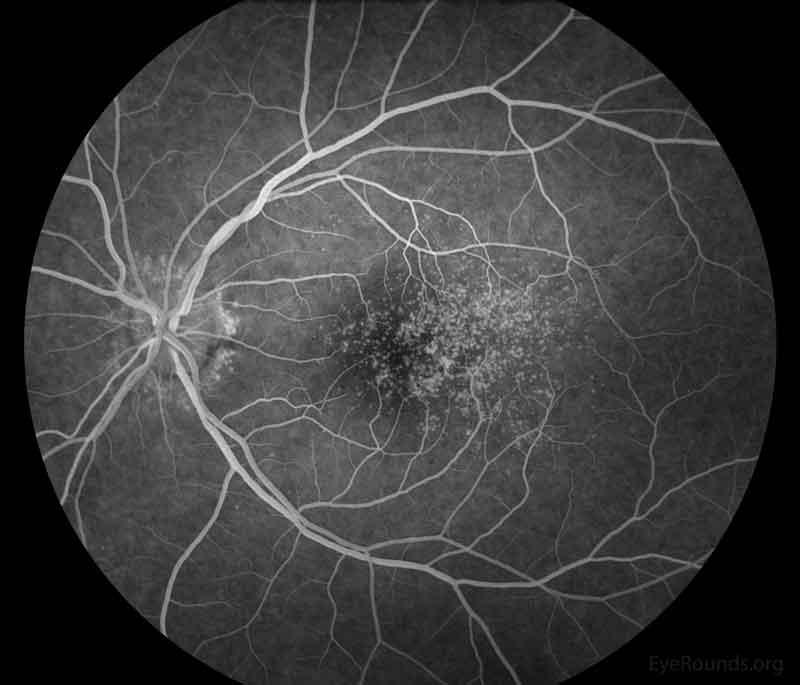 Figure 3: angiographie représentative à la fluorescéine photos des deux yeux. Il y a plus de drusen hyperfluorescents que vu sur l’examen fundoscopique.,
Figure 3: angiographie représentative à la fluorescéine photos des deux yeux. Il y a plus de drusen hyperfluorescents que vu sur l’examen fundoscopique., diagnostic différentiel
- dégénérescence maculaire liée à l’âge (cas connexe/tutoriel connexe)
- drusen associé à la Glomérulopathie (y compris les glomérulopathies C3)
- dystrophie maculaire de type Pattern (mutation PRPH2, mutation ABCA4)
- drusen radial autosomique dominant (a. k. a., dystrophie maculaire de Caroline du Nord (mutation PRDM13)
- dystrophie maculaire de Sorsby (mutation TIMP3)
- drusen cuticulaire
évolution clinique
la patiente est restée visuellement asymptomatique, et elle a continué à surveiller son évolution fonction rénale régulièrement avec son néphrologue. Après un conseil attentif des données limitées sur le traitement et le pronostic de drusen chez les patients sans DMLA, elle a décidé de redémarrer ses vitamines AREDS., Elle a concentré ses efforts sur la réduction de ses facteurs de risque, y compris le contrôle de la pression artérielle, du poids, de l’alimentation et de l’évitement du tabagisme. De plus, on lui a fourni une grille Amsler pour surveiller les nouveaux symptômes visuels. En raison de sa distance avec L’Université de L’Iowa, la patiente a décidé de suivre localement et de ne revenir que si elle développait des symptômes visuels.
elle est retournée à la clinique deux ans plus tard avec de nouvelles ombres et des reflets dans l’œil gauche plus grands que le droit, qui ont commencé après une récente crise ischémique transitoire. Elle a également reçu un nouveau diagnostic de syndrome des anticorps antiphospholipides., Aucune cause structurelle oculaire n’a été identifiée et son drusen est resté stable sans complications.
diagnostic
drusen associé à la Glomérulopathie (anciennement drusen associé à la glomérulonéphrite membranoproliférative de type II)
DISCUSSION
étiologie/épidémiologie
la classification de la glomérulopathie a récemment subi des changements et la littérature commence à adopter une nouvelle terminologie. Auparavant, la maladie rénale sous-jacente associée à drusen dans la rétine était appelée glomérulonéphrite membranoproliférative de type II (MPGN)., Avec une nouvelle compréhension de la maladie, la maladie rénale sous-jacente qui comprenait MPGN a été reclassifiée en glomérulopathies C3 avec des sous-groupes nommés maladie du dépôt dense (DDD) et glomérulonéphrite C3 (C3GN). Le DDD et le C3GN relèvent tous deux de la maladie à médiation complémentaire, par rapport à la maladie à médiation complexe immunitaire. La maladie rétinienne associée a moins de consensus de terminologie et est appelée drusen associé à la glomérulopathie, drusen associé à la glomérulonéphrite, drusen précoce ou drusen laminaire basal.
Les glomérulopathies C3 sont des troubles rares., Le rapport femme-homme pour la maladie rénale est de 1:1 et la maladie rétinienne est de 2,7:1 à 1:1,5. L’âge moyen d’apparition de la maladie rénale est de 30±19 ans pour le C3GN et de 19±18 ans pour le DDD. Les changements rétiniens apparaissent tôt avec l’âge moyen de 41±21 ans dans une série et dès l’adolescence dans une autre.
physiopathologie
Le dérèglement majeur de la glomérulopathie C3 et de la maladie rétinienne associée est la voie alternative du complément. La mutation la plus fréquente concerne le facteur de complément H (CFH, chromosome 1q32-q32.,1), mais d’autres gènes de la voie du complément ont été associés à la maladie, notamment CFI, MCP, CFB et CFHR5. Ces mutations sont souvent une perte de fonction des inhibiteurs du complément et conduisent ainsi à une augmentation de l’activité de la cascade du complément.
CFH joue un rôle intégral en tant que protéine dans la voie alternative du complément, et il agit pour lier C3b et augmenter la dégradation de la convertase C3bBb. Le CFH fonctionne également comme cofacteur du facteur I du complément (CFI), qui inhibe également le C3b., Les mutations de L’HFC ont été associées à un certain nombre de maladies, notamment la maladie D’Alzheimer, la dégénérescence maculaire liée à l’Âge, Les glomérulopathies C3, Le drusen cuticulaire et la susceptibilité à la méningocoque. Par exemple, la mutation Y402H de CFH est associée à un risque multiplié par 3 de dégénérescence maculaire liée à l’âge. Cette variante Y402H de CFH montre une association encore plus élevée chez ceux avec drusen cuticulaire. Un autre trouble maculaire qui se présente avec drusen, le drusen radial autosomique dominant, n’est pas associé à des mutations CFH., Dans le drusen associé à la glomérulopathie, un diagnostic moléculaire n’est pas toujours disponible dans les études publiées, mais une mutation CFH a été trouvée chez tous les patients avec des données moléculaires disponibles dans une étude.
l’œil (c’est-à-dire l’interface choriocapillaris/membrane de Bruch/épithélium pigmentaire rétinien) et le rein (c’est-à-dire l’interface touffe capillaire/épithélium membranaire glomérulaire) n’ont pas les régulateurs liés à la membrane de la cascade du complément, ce qui indique que les deux sont probablement affectés par un processus commun de la maladie., Sans ces régulateurs, la cascade du complément mal activée entraîne des dommages et une accumulation ultérieure de dépôts dans la rétine chez les patients atteints de glomérulonéphrite, et est souvent confondue avec la dégénérescence maculaire liée à l’âge chez un patient beaucoup trop jeune pour la maladie. Sur l’histopathologie, ces dépôts sont morphologiquement similaires aux dépôts dans le rein. Il y a du matériel PAS-positif dans les vaisseaux sanguins choroïdiens et dans la membrane de Bruch sur une choroïde amincie., Fait intéressant, les dépôts de deux types de glomérulonéphrite (glomérulonéphrite membraneuse et glomérulonéphrite post-streptococcique) présentent une similitude étendue sur l’évaluation histochimique, immunohistochimique et ultrastructurale par rapport au drusen de la dégénérescence maculaire liée à l’âge (Tableau 1)., Malgré la similitude clinique des drusen associés à la glomérulopathie et des drusen de la DMLA, la DMLA et la maladie rénale n’ont pas de coïncidence élevée et peuvent refléter une activation plus locale de la cascade du complément confinée à la rétine dans la DMLA qui est influencée à la fois par la génétique et l’environnement.
 Tableau 1: Comparaison des Types de Drusen. Les diverses caractéristiques sur l’évaluation histochimique, immunochimique et ultrastructurale des patients atteints de drusen lié à l’âge, de glomérulonéphrite membraneuse et de glomérulonéphrite post-streptococcique., Tableau apparaît dans Mullins et coll. 2001 . Reproduit avec permission.
Tableau 1: Comparaison des Types de Drusen. Les diverses caractéristiques sur l’évaluation histochimique, immunochimique et ultrastructurale des patients atteints de drusen lié à l’âge, de glomérulonéphrite membraneuse et de glomérulonéphrite post-streptococcique., Tableau apparaît dans Mullins et coll. 2001 . Reproduit avec permission. signes/symptômes
Les Patients atteints de drusen associé à une glomérulopathie restent souvent asymptomatiques. Dans une série de 23 patients atteints de glomérulonéphrite médiée par le complément, neuf patients et 17 yeux présentaient des caractéristiques rétiniennes liées à la maladie rénale, mais seulement cinq patients (22%) et six yeux (13%) présentaient une perte de vision. La métamorphopsie peut signaler la membrane néovasculaire choroïdienne sous-jacente (CNVM), qui se développe chez 10% des individus. Comme pour la DMLA, il existe des rapports de perte de vision due à une atrophie géographique de la rétine., La perte de Vision peut également indiquer une choriorétinopathie séreuse centrale associée (CSCR), qui peut se développer en raison de l’utilisation concomitante de stéroïdes et non de la maladie rénale/rétinienne sous-jacente.
lors de l’examen du fond d’œil dilaté, la découverte rétinienne la plus courante dans la glomérulopathie C3 est le drusen laminaire basal. Ces drusen sont souvent présents lors du premier examen du patient, mais chez certains jeunes patients adolescents, le drusen peut être absent. Ces drusen sont nombreuses, petites lésions jaunes regroupées dans la partie temporale de la macula, et sont symétriques entre les deux yeux., Plus le patient a la maladie, plus le nombre et la taille du drusen et plus le risque de complications, indépendamment de l’âge du patient. Dans une série, tous les patients atteints de CNVM ont eu la glomérulopathie pendant > 15 ans.
tests/analyses en laboratoire
le diagnostic différentiel des résultats observés dans le drusen associé à la glomérulopathie comprend la dégénérescence maculaire liée à l’âge, la dystrophie maculaire à motif, le drusen radial autosomique dominant, la dystrophie maculaire de Caroline du Nord, la dystrophie maculaire de Sorsby, le drusen cuticulaire et les glomérulopathies C3., En règle générale, l’apparition du fond d’œil lors d’un examen dilaté dans le cadre d’une maladie rénale est souvent très favorable au diagnostic. Drusen dans une distribution typique chez un jeune patient avec une glomérulopathie C3 prouvée par biopsie est presque certainement due à la maladie rénale sous-jacente du patient.
des tests fonctionnels supplémentaires ne sont souvent pas effectués ni requis, mais il existe des rapports de tests fonctionnels anormaux dans le drusen associé à la glomérulopathie., L’électro-oculographie (EOG) peut avoir de faibles rapports D’Arden avec une électrorétinographie normale (ERG), comme indiqué chez une série de trois patients présentant l’apparence typique du fond d’œil. Une perte légère du champ visuel, des anomalies de la vision des couleurs lors du test Farnsworth D-15, une adaptation prolongée à l’obscurité et des ERGs retardés mais d’amplitude normale ont été rapportés dans une autre étude.
Les Patients subiront souvent des analyses d’urine pour une hématurie et présenteront une protéinurie et une hématurie de la gamme néphrotique., Dans le bilan diagnostique ultérieur, la biopsie rénale est un outil de diagnostic important, et les patients atteints de glomérulopathie C3 auront un dépôt de C3 dans la membrane basale glomérulaire sur des préparations d’immunofluorescence. D’autres caractéristiques sur la biopsie incluent l’aspect variable de microscope à lumière, l’aspect microscopique électronique, et le dépôt d’immunoglobuline.
imagerie
la modalité la plus utile dans le diagnostic et la surveillance du drusen associé à la glomérulopathie C3 est la tomographie par cohérence optique (OCT)., L’OCT peut aider à visualiser le drusen laminaire basal et les détachements associés de l’épithélium pigmentaire rétinien (EPR). Parfois, l’angiographie à la fluorescéine (FA) est utilisée et peut montrer un plus grand nombre de lésions dans la rétine que celles observées sur OCT. Cependant, L’OCT est préféré en raison de sa modalité non invasive.
Traitement/Gestion/lignes Directrices
Un néphrologue doit gérer le traitement de la maladie rénale. Le traitement de la maladie vise souvent les thérapies anti-complément, les inhibiteurs de l’enzyme de conversion de l’angiotensine (IEC) et les bloqueurs des récepteurs de l’angiotensine (ARB)., Des traitements supplémentaires peuvent inclure des agents hypolipidémiants, un traitement plasmatique et un traitement anti-cellulaire. Même avec le traitement, la fonction rénale est variable.
le traitement des complications des maladies oculaires dues à la glomérulopathie C3 manque de preuves solides, et de nombreuses décisions de traitement proviennent de la connaissance du traitement de maladies plus courantes telles que la dégénérescence maculaire liée à l’âge. La thérapie photodynamique (PDT) est souvent un pilier du traitement de la CNVM. Cependant, le traitement n’est pas utilisé pour le CNVM juxtafovéal en raison de la perte de vision potentielle., Des cas ont été rapportés concernant le succès du traitement par le ranibizumab et l’aflibercept, des traitements anti-vasculaires utilisant le facteur de croissance endothélial (VEGF).
Les vitamines AREDS sont souvent utilisées dans la DMLA non exsudative pour prévenir la progression vers la DMLA néovasculaire. Cependant, aucune donnée concernant l’utilisation de ces suppléments dans le drusen associé à la glomérulopathie n’est disponible., En raison des similitudes entre le drusen associé à la glomérulopathie et la DMLA en physiopathologie et en histoire naturelle, certains patients choisiront d’utiliser ces suppléments, mais la prudence doit être conseillée en raison de leur insuffisance rénale et de l’absence de preuves de traitement vérifiées.
Les recommandations concernant les patients visuellement asymptomatiques sont controversées sans accord sur la nécessité d’examens de dépistage. La maladie rénale n’est pas corrélée à la gravité de la maladie rétinienne, et un seuil pour les examens de la vue ne peut donc pas être établi., Malgré cela, comme pour tout patient, des examens dilatés réguliers doivent être effectués pour détecter rapidement d’autres maladies oculaires.,Drusen sur OCT et FA
symptômes
- fréquemment visuellement asymptomatiques
- Métamorphopsie
- vision floue
- hématurie
traitement/prise en charge
- observation de la maladie oculaire asymptomatique
- implication du néphrologue pour la maladie rénale
- PDT ou anti-VEGF (hors étiquette) pour cnvm
format de citation suggéré
Janson BJ, oetting ta, Sohn eh., Drusen maculaire précoce et glomérulopathie C3 (anciennement drusen associé à la glomérulonéphrite membranoproliférative de type II). EyeRounds.org. publié le 9 octobre 2017; disponible à partir de http://EyeRounds.org/cases/259-GA-Drusen.htm















