frontières en science végétale
Introduction
Une progression correcte de la maturation des fruits est essentielle pour atteindre à la fois une qualité optimale des fruits et une longue durée de Cependant, la maturation est un processus complexe où de nombreux facteurs sont impliqués, y compris le contrôle hormonal, qui régule les changements biochimiques et physiologiques qui confèrent aux fruits des propriétés organoleptiques et nutritionnelles finales., Traditionnellement, les fruits charnus ont été classés selon leur processus de maturation en fruits climatériques et non climatériques. Les fruits climatériques tels que les tomates ou les bananes nécessitent une augmentation du taux de respiration et de la production d’éthylène pour déclencher le processus de maturation dans une réponse autocatalytique (Barry et Giovannoni, 2007; Liu et al., 2015)., Antagoniquement, les fruits non climatériques comme les agrumes ou les raisins ne présentent pas d’éclatement ni dans l’éthylène ni dans la respiration avant le début de la maturation, et dans ces fruits, la maturation est principalement contrôlée par l’accumulation progressive de l’acide abscissique phytohormone (ABA; Rodrigo et al., 2006; Castellarin et coll., 2011). Néanmoins, de nouvelles études renforcent l’idée que le processus de maturation n’est pas seulement régi par la production d’une phytohormone mais semble plutôt être le résultat d’un équilibre hormonal contrôlé (Symons et al., 2012; Teribia et coll., 2016; Li et coll., 2019).,
les auxines, l’acide salicylique (SA) et la mélatonine sont des phytohormones impliquées dans la signalisation et la régulation de nombreux processus cruciaux chez les plantes. Les auxines ont été largement décrites comme des régulateurs de croissance et de développement ayant de multiples fonctions chez les plantes (voir Taylor-Teeples et al., 2016); SA déclenche la réponse de défense contre les agents pathogènes biotrophiques et hémi-biotrophiques (Loake et Grant, 2007) et joue un rôle important dans le stress abiotique (Dong et al., 2014; Wani et coll., 2017), contrôle de la floraison et du cycle cellulaire (Carswell et al., 1989; Eberhard et coll.,, 1989, respectivement); et la mélatonine n’a pas seulement été trouvée pour avoir des fonctions de type auxine (Chen et al., 2009; Zuo et coll., 2014; Wen et coll., 2016) mais il a également été suggéré d’agir comme un antioxydant potentiel chez certaines plantes (Arnao et Hernández-Ruiz, 2015) et un régulateur des réponses des plantes aux agents pathogènes (Chen et al., 2018). Fait intéressant, ces trois hormones partagent un précurseur commun-le chorismate -, donc un échange métabolique se produit entre elles, et un certain nombre de gènes doivent être finement régulés pour détourner le métabolisme du chorisme vers ces composés., Au cours des dernières années, plusieurs examens ont porté sur la biosynthèse et le rôle de l’auxine (Paul et al., 2012), SA (Asghari et d’Agdam, 2010) et de la mélatonine (Feng et coll., 2014; Arnao et Hernández-Ruiz, 2018) dans fruits. Cependant, leur biosynthèse et leurs fonctions ont pour la plupart été décrites séparément. Ici, nous discuterons des aspects communs et différentiels de la biosynthèse, du métabolisme et de la fonction de l’auxine, de la SA et de la mélatonine dans la croissance et la maturation des fruits climatériques et non climatériques., L’accent sera mis sur le détournement métabolique des points clés de leur biosynthèse à partir du chorismate, le rôle régulateur lors de la maturation des fruits climatériques et non climatériques, et leur rôle dans la modulation de la biosynthèse des composés bioactifs, qui détermine en grande partie la qualité des fruits.
Phytohormones dérivées du Chorismate
Le Chorismate est le produit final de la voie du shikimate et joue un rôle clé dans la biosynthèse des phytohormones (Figure 1)., Le Chorismate donne naissance à des acides aminés aromatiques, dont le tryptophane, et à travers plusieurs réactions, notamment la conversion du tryptophane en acide indole-3-pyruvique par la tryptophane aminotransférase (TA); il peut générer l’acide auxine indole-3-acétique (IAA). TA a été proposé comme une enzyme clé universelle à la biosynthèse IAA non seulement dans les organes végétatifs (Enríquez-Valencia et al., 2018), mais aussi dans le développement des organes reproducteurs (Reyes-Olalde et coll., 2017), y compris la croissance et la maturation des fruits (Estrada-Johnson et al., 2017)., En revanche, lorsque l’isochorismate synthase (ICS) est activée, le chorismate peut être converti en isochorismate et ce dernier peut être transformé en SA. Bien que cette voie ait été identifiée pour la première fois chez les bactéries, elle est également actuellement bien établie chez les plantes (Wildermuth et al., 2001; Uppalapati et coll., 2007; Catinot et coll., 2008; Garcion et coll., 2008; Abreu et Munné-Bosch, 2009). Enfin, le tryptophane peut se transformer en tryptamine par l’enzyme tryptophane décarboxylase (TDC)., Bien qu’il s’agisse d’une autre des multiples voies de biosynthèse de L’AAI (la tryptamine se transforme en indole-3-acétaldéhyde et plus tard en AAI), la TDC a également été proposée Pour être la première enzyme limitant le taux dans la voie de la mélatonine (Kang et al., 2007). LE TDC a été identifié pour la première fois dans la famille des Apocynaceae (De Luca et al., 1989) qui seront décrits plus tard dans un certain nombre de systèmes végétaux (Byeon et al., 2012, 2014; Zhao et coll., 2013; Wei et coll., 2018)., Après décarboxylation, la tryptamine est convertie en sérotonine par la tryptamine-5-hydroxylase, puis la sérotonine se transforme en N-acétyl-sérotonine pour finalement donner de la mélatonine dans le cytosol (Figure 1).
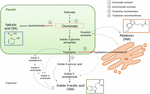
la Figure 1. Biosynthèse de l’acide indole-3-acétique (IAA), de l’acide salicylique (SA) et de la mélatonine (Mel) à partir du chorismate. Les trois composés partagent un précurseur final commun (chorismate, carré en orange) de la voie du shikimate., Les principaux points de dérivation sont indiqués par des flèches rouges et les enzymes correspondantes sont numérotées dans un ordre de divergence de descente à partir du shikimate. Les flèches pointillées en gras indiquent plus d’une étape entre les composés. De fines flèches pointillées indiquent des voies qui ne sont pas encore bien définies.
des enzymes de dérivation de clé qui mènent à la synthèse des hormones de la voie du chorismate ont été récemment identifiées dans les fruits charnus (Figure 1). ICS, dont l’expression s’est avérée cruciale pour la tolérance au stress biotique (Garcion et al.,, 2008; Zeng et Il, 2010), a été identifié dans les tomates et les pommes. Zhu et coll. (2016) ont signalé la surexpression D’ICS1 (isochorismate synthase 1) dans des conditions d’entreposage au froid chez la tomate, tandis que Zhang et al. (2017) ont trouvé l’activation d’un facteur de transcription impliqué dans la voie de signalisation SA liée aux agents pathogènes induisant l’expression de ICS dans les pommes. On a signalé une augmentation de l’activité du TDC chez les poivrons non mûrs lors de l’infection par des agents pathogènes – par une augmentation de L’expression du TDC1 et du tdc2 (Park et al., 2013) – et au stade de croissance dans le fruit du mûrier (Wang et al., 2016)., Enfin, le TA a été identifié dans la vigne, à la fois à pre-et à véraison (Böttcher et al., 2013; Gouthu et Deluc, 2015, respectivement) ainsi que pendant la maturation des fraises (Estrada-Johnson et al., 2017). Il convient cependant de noter que les gènes et les enzymes décrits dans les fruits climatériques (c.-À-D. ICS) n’ont pas été identifiés dans les fruits non climatériques (c.-à-d. TDC et TA) et vice versa; par conséquent, d’autres études sont impératives pour combler ces lacunes de connaissances et mieux comprendre comment ces points de dérivation sont réglementés conjointement pendant la maturation des fruits.,
rôle des Phytohormones dérivées du Chorismate dans les Fruits climatériques et Non climatériques
démêler les mécanismes de développement des fruits a été l’un des défis majeurs de la recherche agronomique récente pour ses implications économiques. Dans ce contexte, les phytohormones ont été signalées comme des moteurs responsables de la maturation des fruits, en particulier l’éthylène et L’ABA dans les fruits climatériques et non climatériques, respectivement. Cependant, le fait que ces phytohormones puissent réguler à elles seules le développement des fruits s’est vite avéré beaucoup trop simple., Après des recherches approfondies et avec l’amélioration de la chimie analytique et des techniques moléculaires, plusieurs autres hormones ont été confirmées comme régulateurs potentiels du développement et de la maturation des fruits, y compris les phytohormones dérivées du chorismate.
les auxines se croisent avec D’autres Hormones pendant la nouaison, la croissance et la maturation
les auxines sont un groupe d’hormones végétales qui jouent un rôle essentiel dans le développement des fruits, exerçant leur propre influence et modulant l’expression d’autres phytohormones., Les teneurs endogènes en AAI sont particulièrement élevées lors de la nouaison et pendant les stades de développement de la croissance initiale, après quoi les quantités d’AAI ont tendance à diminuer avant le début de la maturation, à la fois dans les climatériques (Zaharah et al., 2012) et les fruits non climatériques (Symons et al., 2012; Teribia et coll., 2016), avec apparemment quelques exceptions, comme les pêches (Tatsuki et al., 2013) et certaines variétés de prunes (El-Sharkawy et al., 2014; Figure 2A). Il a été démontré que L’AAI est impliquée dans l’initiation de la nouaison en combinaison avec les gibbérellines (Mezzetti et al., 2004; Serrani et coll., 2010; Bermejo et coll., 2018; Hu et coll.,, 2018). L’altération de la biosynthèse ou de la signalisation des AAI conduit généralement à la parthénocarpie des fruits, bien qu’elle puisse également entraîner une maturation anormale de certains fruits (Wang et al., 2005; Liu J. et coll., 2018; Reig et coll., 2018). Une teneur élevée en AAI aux stades initiaux du développement des fruits favorise la croissance des fruits en raison de l’implication de l’auxine dans la division cellulaire en combinaison avec les cytokinines et dans le contrôle de l’expansion cellulaire en combinaison avec les gibbérellines (Liao et al., 2018)., Pendant cette période, la diaphonie hormonale entre les auxines et les gibbérellines permet en outre une mise en forme normale des fruits dans une régulation affinée médiée par des facteurs de réponse Auxines (ARF; Liao et al., 2018; Liu S. et coll., 2018).
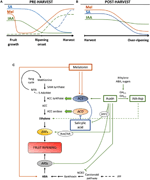
la Figure 2. Rôle de L’AAI, de la SA et de la Mel lors du développement des fruits climatériques et non climatériques. Modèle résumant les interactions de L’AAI, de L’AS et de la Mel pendant la maturation des fruits climatériques et non climatériques pendant (A) la pré – et (B) la post-récolte., Les lignes pointillées indiquent une dynamique alternative du contenu des phytohormones dans certains fruits (voir le texte pour la discussion). (C) vue d’ensemble de l’interaction de l’AAI, SA, et Mel avec de l’éthylène et de l’acide abscissique (ABA) biosynthèse dans climatériques et non climatériques fruits. L’auxine est un régulateur positif de la biosynthèse de l’éthylène par l’activation des gènes ACC synthase (ACS) et induisant l’expression de facteurs réactifs à l’éthylène (ERF). L’auxine réprime également la production D’ABA par la répression de la 9-cis-époxycaroténoïde dioxygénase (CNED) et inhibe les gènes de stress réactifs à L’ABA (ARS) par la protéine ARF2., Les teneurs en AAI endogènes peuvent être réduites par les protéines GH3, dont la synthèse est favorisée par l’éthylène, L’ABA et les sucres. La ligne discontinue indique le rôle possible de L’AAI par L’AAI-Asp en tant que facteur de maturation améliorant l’éthylène dans certains fruits. La mélatonine améliore la production D’ABA et d’éthylène, bien que L’ACS puisse être inhibée en fonction du contenu en mélatonine. SA agit comme un inhibiteur de l’éthylène réprimant les gènes ACC oxydase (ACO), bien qu’il puisse favoriser l’expression de L’ACS., MTA, 50-méthylthioadénosine; S-AdoMet, S-adénosyl-méthionine; Sam synthase, S-adénosyl-méthionine synthase; ACC, acide 1-aminocyclopropane-1-carboxylique; IPP, isopentényl diphosphate.
des Réductions de endogènes de l’AAI contenus ont été signalés avant le début de la maturité dans plusieurs fruits. Ces réductions ont été liées à la conjugaison de L’IAA avec l’acide aspartique (IAA-Asp) par les IAA-amido synthétases, GH3-1 et GH3-2 (Figure 2C)., En effet, le GH3 – 1 et le GH3-2 ont montré une expression plus élevée au début du développement des fruits et plus particulièrement au début de la maturation, tant chez les fruits climatériques, tels que les tomates (Sravankumar et al., 2018) et les pommes (Onik et coll., 2018), ainsi que dans les fruits non climatériques, comme les baies de raisin (Böttcher et al., 2010, 2011) et les framboises (Bernales et coll., 2019)., Fait intéressant, les baies de raisin ont montré une expression accrue de GH3-1 après L’application D’ABA et d’éthéphon, ce qui pourrait expliquer l’implication de l’éthylène dans le contrôle des teneurs en AAI après le début de la maturation, même dans les fruits non climatériques (Böttcher et al., 2010). En fait, plusieurs études mettent en évidence l’interaction étroite entre les auxines et l’éthylène dans la maturation des fruits, avec une influence réciproque entre eux (Tadiello et al., 2016a; Busatto et coll., 2017)., Pour les fruits climatériques, une teneur accrue en AAI est nécessaire pour activer l’expression des gènes ACC synthase (ACS), codant pour L’ACC synthase, ce qui, à son tour, conduira à la production d’éthylène déclenchant le processus de maturation (Figure 2c; Tatsuki et al., 2013). Fruits comme les tomates (Li et al., 2016) ou des bananes (Choudhury et coll.,, 2008), qui présentent généralement une teneur en AAI réduite avant le début de la maturation, montrent un retard de maturation lorsque L’AAI ou des analogues sont appliqués de manière exogène, tandis que les fruits comme les pêches, dont la teneur en AAI augmente progressivement jusqu’à maturité complète, montrent une maturation accélérée lorsque les auxines sont appliquées (Tadiello et al., 2016b). Par conséquent, une régulation serrée, complexe et différentielle des interactions entre l’auxine et l’éthylène doit exister dans divers fruits pendant la maturation pré-récolte., De plus, les teneurs en AAI diminuent avant le début de la maturation dans certains fruits non climatériques pour désépresser la 9-cis-époxycaroténoïde dioxygénase (CNED) et commencer la synthèse de L’ABA (Figure 2c; Jia et al., 2016). Fait intéressant, ce processus est également médié par la conjugaison IAA grâce à une activité accrue de GH3-1 (Böttcher et al., 2010). Néanmoins, Estrada-Johnson et coll. (2017) ont montré que, bien que la teneur en AAI diminue pendant la maturation de la fraise, l’expression des familles de gènes FaAux/IAA et FaARF est induite dans les récipients rouges, suggérant l’implication de la signalisation de l’auxine dans les fruits complètement mûrs.,
après la récolte, les teneurs en auxine restent généralement invariantes ou ont tendance à diminuer en raison des processus oxydatifs qui peuvent donner lieu à des réductions faibles, mais progressives, des teneurs endogènes en AAI (Figure 2b). Les traitements à l’auxine après la récolte retardent la surmaturité de certains fruits (Chen et al., 2016; Moro et coll., 2017) et augmenter le contenu de certains acides organiques, en maintenant l’acidité des fruits (Li et al., 2017), suggérant ainsi que l’auxine joue également un rôle important dans le contrôle de la maturation des fruits après la récolte.,
rôles multiples de L’acide salicylique pendant le développement et la maturation des fruits
l’acide salicylique est une autre phytohormone dérivée du chorismate qui a été principalement liée à son effet protecteur sous stress biotique pour contrôler les pertes pré-récolte et post-récolte dérivées de l’infection pathogène des fruits (Babalar et al., 2007; Cao et coll., 2013). En général, les teneurs endogènes en SA libre sont plus élevées au début du développement du fruit, puis diminuent progressivement (Oikawa et al., 2015). Lu et coll. (2015) ont signalé une augmentation secondaire de L’As au cours de la deuxième phase de croissance des fruits de pêche., L’application exogène de SA dans les bananes a retardé le processus de maturation en réduisant l’éclatement respiratoire et le rapport pulpe / pelure, ainsi que l’activité Décroissante des enzymes liées à la dégradation de la paroi cellulaire et au système antioxydant (Srivastava et Dwivedi, 2000). De plus, le traitement des Cerisiers à l’acide salicylique et acétylsalicylique (AAS) a amélioré le poids, la fermeté et la couleur des cerises au stade commercial (Giménez et al., 2014). Application exogène de SA ou de salicylate de métyle (MeSA) au cours de la post-récolte, retardée surmaturation dans des fruits comme les kiwis (Zhang et al.,, 2003), et les cerises douces (Valero et coll., 2011). En outre, les traitements à base de salicylique ou D’AAS ont atténué les blessures par refroidissement des grenades (Sayyari et al., 2011), les tomates (Agdam et coll., 2014), et les avocats (Glowacz et coll., 2017). L’as interagit également avec l’éthylène par inhibition de l’expression de L’ACC oxydase (ACO) (Shi et Zhang, 2012). Étonnamment, une augmentation de l’expression de L’ACS dans les poires est également observée après l’application de la SA de manière régulée par la dose (Shi et al., 2013; Shi et Zhang, 2014). Par conséquent, la régulation de la production d’éthylène dépendante de L’AS est finement réglementée (Figure 2C).,
mélatonine: un régulateur émergent pour le contrôle du développement des fruits
La mélatonine est également une hormone végétale issue de la voie dérivée du chorismate qui a attiré beaucoup d’attention ces dernières années (Hernández-Ruiz et al., 2005; Arnao et Hernández-Ruiz, 2018; Sharif et coll., 2018). Récemment, la mélatonine a été soulignée comme un facteur important pour la nouaison, de la même manière que les effets de L’AAI (Figure 2A; Liu S. et al., 2018). En outre, la production circadienne de cette phytohormone a été observée (Kolář et al., 1997)., Pendant la maturation sur arbre, les raisins traités avec de la mélatonine ont montré une synchronicité plus élevée et un poids accru à maturité complète (Meng et al., 2015). De plus, une autre étude récente de Xu et al. (2018) ont décrit que la mélatonine pourrait favoriser la maturation des baies de raisin grâce à son interaction avec L’ABA et l’éthylène, ainsi que le peroxyde d’hydrogène. Il a été démontré que la mélatonine confère une tolérance au refroidissement lors de l’entreposage au froid des fruits, ce qui semble être principalement lié à son activité antioxydante (Cao et al., 2018; Agdam et coll., 2019)., Au cours de la post-récolte, les tomates ont montré une augmentation des émissions d’éthylène après l’application de mélatonine à 50 µM (Sun et al., 2015), contrairement aux poires, où l’application exogène de mélatonine à 100 µM inhibait la production d’éthylène (Zhai et al., 2018), ou des fruits de banane, où la mélatonine à 50-200 µM inhibait l’expression de L’ACS et de L’ACO (Figure 2c; Hu et al., 2017). Bien que différents effets de l’application de mélatonine puissent être liés à un effet de dosage, d’autres recherches sont nécessaires pour mieux comprendre le rôle de la mélatonine dans le contrôle du développement des fruits.,
une discussion croisée des Phytohormones dérivées du Chorismate dans le contrôle du développement des fruits
Il a été démontré que la diaphonie hormonale entre les phytohormones dérivées du chorismate se produit pendant le développement et la maturation des fruits. Breitel et coll. (2016) ont constaté que les auxines peuvent interagir avec L’as par L’intermédiaire de L’ARF2 (Figure 2c) et que la surexpression de L’ARF2 dans la tomate a entraîné une teneur plus faible en SA et un retard de maturation important., Cela indique que les auxines pourraient limiter la production de SA pendant le développement des fruits, ce qui pourrait expliquer un compromis entre la croissance des fruits (médiée par l’auxine) et l’activation des défenses biotiques (médiée par la SA). De plus, l’application exogène de SA sur les fruits de papaye a entraîné une expression altérée de plusieurs gènes IAA, certains d’entre eux étant régulés à la baisse tandis que d’autres sont régulés à la hausse (Liu et al., 2017)., Dans ce cas, les résultats n’étaient pas concluants de ce qui se produit réellement de manière endogène dans le croisement putatif entre l’auxine et L’AS pendant la maturation des fruits et des recherches supplémentaires sont nécessaires pour ce fruit et d’autres fruits climatériques. Dans tous les cas, il est clair que IAA et SA sont étroitement liés, non seulement métaboliquement mais aussi fonctionnellement. Enfin, plusieurs études ont rapporté l’influence de la mélatonine sur la biosynthèse et/ou la signalisation de L’AAI et de la SA (examinées dans Arnao et Hernández-Ruiz, 2018), bien qu’à notre connaissance, aucune de ces études n’ait été réalisée ni dans les fruits climatériques ni dans les fruits non climatériques.,
Modulation des composés bioactifs biosynthèse par des Phytohormones dérivées du Chorismate
Les composés bioactifs (y compris les composés phénoliques, les isoprénoïdes et les vitamines antioxydantes) ont été largement étudiés comme responsables de propriétés organoleptiques spécifiques des aliments, mais aussi de leurs effets protecteurs dans les cellules humaines contre les processus oxydatifs dans le développement de maladies neurodégénératives et cardiovasculaires et de certains types de cancer (Liu et al., 1999; Mueller et coll. De 2010; l’Esturgeon et de Ronnenberg, 2010; Björkman et coll., 2011)., Les composés phénoliques contribuent de manière significative à conférer des arômes spécifiques, tels que les tanins-responsables du goût amer ou astringent de certains fruits,et les couleurs, telles que les pigments anthocyaniques – responsables des couleurs des fruits rouges, bleus et violets (Croteau et al., 2000). La pertinence des composés phénoliques pour la consommation humaine a été associée à un effet protecteur contre les processus oxydatifs en relation avec la santé cardiovasculaire et du système nerveux central ainsi qu’à un risque réduit de cancers du tractus gastro-intestinal (Björkman et al., 2011)., Les caroténoïdes, tétraterpènes appartenant aux isoprénoïdes, jouent un rôle dans la protection contre les processus photo-oxydatifs et en tant que pigments organiques; ils sont responsables de la couleur jaune orangé des fruits (Tapiero et al., 2004). On pense que les caroténoïdes alimentaires offrent des avantages pour la santé en diminuant le risque de maladie oculaire et de certains types de cancers en raison de leur rôle en tant qu’antioxydants (Johnson, 2002). Les vitamines C et E, y compris l’acide ascorbique et les tocophérols, respectivement, sont des facteurs de qualité nutritionnelle essentiels dans les fruits ayant de nombreuses activités biologiques chez l’homme (Miret et Müller, 2017)., Compte tenu du rôle pertinent de tous ces composés bioactifs en tant que composés favorisant la santé dans les fruits, la modulation de leur accumulation est d’une importance primordiale dans les fruits climatériques et non climatériques (Vasconsuelo et Boland, 2007). La plupart de ces composés bioactifs sont accumulés à des niveaux élevés pendant la maturation des fruits, lorsque les fruits verts moins appétissants se transforment en un fruit riche, coloré et savoureux sur le plan nutritionnel (Daood et al., 1996; Ranalli et coll., 1998; Dumas et coll., 2003; Singh et coll., 2011)., Cependant, une fois commencée, la maturation ne peut pas être calée et conduit généralement à une sur-maturation qui affecte négativement la qualité du fruit (Kumar et al., 2014). Par conséquent, minimiser la détérioration des fruits après la récolte tout en obtenant une teneur élevée en composés bioactifs reste l’un des plus grands défis à résoudre.
l’auxine a été identifiée comme un régulateur important de la biosynthèse des caroténoïdes pendant la maturation des fruits de la tomate climatérique. La maturation de la tomate est associée à la dégradation de la chlorophylle et au déplacement des xanthophylles en carotènes (β-carotène et lycopène) (Fraser et al., 1994)., L’IAA semble retarder la maturation de la tomate en réprimant l’éthylène et plusieurs transcriptions de caroténoïdes en amont, y compris Psy, Ziso, Pds, Critiso ainsi que les Chlases 1-3 et, d’autre part, en favorisant l’accumulation de transcriptions β-Lyc1 et Crtr-β1, entraînant une teneur plus élevée en xanthophylles et en chlorophylle a (Su et al., 2015). En outre, dans certains fruits non climatériques tels que les cerises et les baies de raisin, l’auxine semble également moduler la biosynthèse des anthocyanes et contrôler ainsi les processus de maturation des fruits. Teribia et coll., (2016) ont signalé une corrélation négative entre les AAI et les teneurs en anthocyanes indiquant que l’accumulation d’anthocyanes commence lorsque les teneurs en AAI diminuent. De plus, l’application du composé synthétique de type auxine benzothiazole – acide 2-oxyacétique (BTOA) a retardé la régulation ascendante des gènes qui favorisent la biosynthèse des anthocyanes tels que la chalcone synthase et L’UDP-glucose:flavonoïde 3-O-glucosyltransférase dans les baies de raisin (Davies et al., 1997).,
Les traitements pré et post – récolte avec des salicylates, y compris SA et ses dérivés ASA et MeSA, ont été signalés pour réguler l’accumulation de composés bioactifs conduisant à une activité antioxydante améliorée dans les fruits climatériques et non climatériques. Plusieurs fruits tels que la prune, la cerise et l’abricot sont connus pour avoir une durée de vie courte avec une détérioration rapide de la qualité après la récolte. Par conséquent, il y a une recherche constante de traitements qui améliorent et maintiennent la qualité des fruits, et en particulier la teneur en composés bioactifs ayant des effets bénéfiques sur la santé., Les traitements des prunes avec SA, ASA et MeSA ont entraîné des teneurs significativement plus élevées en acide ascorbique, anthocyanes et composés phénoliques à la récolte et après un entreposage au froid prolongé (40 jours à 4°c; Martínez-Esplá et al., 2017). Des résultats similaires ont pu être observés pour les traitements préharvest avec SA, ASA et MeSA chez les cerises douces (Giménez et al., 2014, 2015, 2017). En outre, le traitement post-récolte avec SA, ASA ou MeSA a maintenu les teneurs phénoliques totales ainsi que les teneurs en anthocyanes pendant l’entreposage au froid dans la grenade (Sayyari et al., 2011), cerise douce (Valero et al.,, 2011), la cerise cornélienne (Dokhanieh et al., 2013), et de l’abricot (Wang et coll., 2015). Ces résultats suggèrent que les salicylates pourraient être impliqués dans l’activation de la phénylalanine ammoniac lyase, qui est la principale enzyme impliquée dans la voie biosynthétique des composés phénoliques (Martínez-Esplá et al., 2017).
récemment, il a été démontré que la mélatonine régule la maturation des fruits et module les composés bioactifs. Les traitements Post-récolte avec de la mélatonine dans les fruits de pêche ont augmenté la tolérance au refroidissement en activant les systèmes antioxydants., La blessure par refroidissement survient chez les fruits de pêche pendant l’entreposage à basse température (entre 2 et 7,6°c), caractérisée par un brunissement de la chair, une maturation anormale et une sensibilité plus élevée à la pourriture (Lurie et Crisosto, 2005). Cao et al. (2018) ont rapporté que les pêches traitées avec de la mélatonine présentaient une abondance de transcription plus élevée des gènes de biosynthèse de l’acide ascorbique PpGME, PpGPP et PpGLDH au septième et PpGMPH aux 21e et 28e jours de stockage par rapport au contrôle, entraînant une augmentation de la teneur en acide ascorbique., De plus, la mélatonine induit des augmentations des activités de G6PDH, SKDH et PAL, qui sont les enzymes essentielles à la biosynthèse des composés phénoliques. Les auteurs suggèrent que le traitement à la mélatonine protège les fruits de pêche dans une certaine mesure des blessures de refroidissement en activant spécifiquement la biosynthèse des composés phénoliques (Gao et al., 2018). De plus, une analyse protéomique différentielle sans étiquette a révélé l’effet de la mélatonine sur la promotion de la maturation des fruits et de l’accumulation d’anthocyanes après la récolte dans les fruits de tomates (Sun et al., 2016)., Les auteurs ont rapporté que la mélatonine exogène augmentait huit enzymes liées à la voie des anthocyanes, notamment la flavonol-3-hydroxylase, la flavanone 3 bêta-hydroxylase, l’anthocyanidine synthase/leucoanthocyanidine dioxygénase et l’anthocyanidine 3-O-glucosyltransférase. De plus, le traitement post-récolte à la mélatonine a augmenté les phénols totaux et les anthocyanes dans les fraises (Aghdam et Fard, 2016) et retardé la perte de phénols totaux, de flavonoïdes et d’anthocyanes dans les fruits de litchi (Zhang et al., 2018)., Les traitements à la mélatonine ont augmenté la teneur en phénols, anthocyanes et flavonoïdes dans les baies de raisin (Xu et al., 2017). De plus, la mélatonine a été rapportée pour améliorer l’accumulation de lycopène et la production d’éthylène dans les tomates, suggérant que la mélatonine peut augmenter la teneur en lycopène en affectant la biosynthèse et la signalisation de l’éthylène (Sun et al., 2015)., La participation de l’éthylène dans la régulation induite par la mélatonine des composés bioactifs a également été observée dans les baies de raisin, où le traitement à double bloc de l’éthylène a montré des effets réduits de la mélatonine sur les contenus en polyphénols (Xu et al., 2017).
Conclusion
Il est conclu que les phytohormones dérivées du chorismate, y compris l’auxine, la SA et la mélatonine, non seulement partagent un précurseur commun, mais jouent un rôle essentiel dans la régulation de la croissance et de la maturation des fruits., Un échange métabolique et fonctionnel entre eux et avec d’autres phytohormones se produit de manière spatiotemporelle pour réguler finement le développement des fruits climatériques et non climatériques. Les différences dans la dynamique des fruits climatériques et non climatériques montrent que la réponse des hormones dérivées du chorismate n’est pas universelle mais plutôt fortement spécifique à l’espèce. De plus, les phytohormones dérivées du chorismate modulent également l’accumulation de composés bioactifs, influençant ainsi la qualité des fruits., D’autres recherches sont cependant nécessaires pour mieux comprendre comment (i) d’autres hormones, telles que l’éthylène et L’ABA, modulent leur biosynthèse en étudiant les points clés de déviation métabolique, (ii) elles interagissent aux niveaux fonctionnel et Moléculaire, et (iii) elles modulent conjointement la biosynthèse des composés bioactifs et, par conséquent, influencent non seulement la croissance et la maturation des fruits, mais aussi la qualité des fruits climatériques et non climatériques.
contributions des auteurs
SM-B a conçu et conçu la revue avec L’aide de MP-L. MP-L, PM, MM et SM-B ont écrit le manuscrit., MP-L a préparé des chiffres avec L’aide de PM. Tous les auteurs ont contribué à la discussion des idées, ont révisé et approuvé le manuscrit final.
Financement
Ce travail a été financé par un prix ICREA Academia décerné à SM-B par le gouvernement Catalan.
déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Böttcher, C., Boss, P. K., et Davies, C. (2011)., Les préférences de substrat acyle d’une IAA-amido synthétase expliquent les variations dans la maturation des baies de raisin (Vitis vinifera L.) causées par différents composés auxiniques indiquant l’importance de la conjugaison des auxines dans le développement des plantes. J. Exp. Bot. 62, 4267–4280. doi: 10.1093/jxb/err134
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
Glowacz, M., le projet de Loi, M., Tinyane, P. P., et Sivakumar, D. (2017)., Maintenir la qualité post-récolte des avocats « Hass » stockés à froid en modifiant la teneur en acides gras et la composition en utilisant des composés volatils naturels – jasmonate de méthyle et salicylate de méthyle. J. Sci. Aliment. Aris. 97, 5186–5193. doi: 10.1002 / jsfa.8400
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
Zeng, W., et Il a, S. Y. (2010). Un rôle de premier plan de la flagelline des récepteurs de la FLAGELLINE SENSING2 dans la médiation de la réponse stomatique à Pseudomonas syringae pv tomato DC3000 chez Arabidopsis. Plant Physiol. 153, 1188–1198. doi: 10.1104 / pp. 110.,157016
PubMed Abstract | CrossRef Full Text | Google Scholar















