chemie voor niet-Majors (Nederlands)
leerdoelstellingen
- beschrijven moleculen waarvan de vormen worden beïnvloed door de VSEPR-theorie.
- definieer lone pair.
- beschrijf hoe eenzame paarelektronen de moleculaire meetkunde beïnvloeden.
Hoe werkt een elektroscoop?
een elektroscoop is een apparaat dat gebruikt wordt om lading te bestuderen. Wanneer een positief geladen object (de staaf) nadert de bovenste paal, elektronen stromen naar de top van de pot verlaten de twee gouden bladeren postivley geladen., De bladeren stoten elkaar af omdat beide houd positie, zoals ladingen. De VSEPR-theorie zegt dat elektronenparen, ook een reeks soortgelijke ladingen, elkaar zo zullen afstoten dat de vorm van het molecuul zich aanpast zodat de valentieelektronenparen zo ver mogelijk van elkaar verwijderd blijven.

Centraal atoom zonder eenzame paren
om de soorten moleculen die mogelijk zijn gemakkelijk te begrijpen, zullen we een eenvoudig systeem gebruiken om de delen van elk molecuul te identificeren.,
A = centraal atoom in een molecuul
B = atomen rondom het centrale atoom
Subscripten na de B geeft het aantal B-atomen aan dat gebonden is aan het centrale atoom A. AB 4 is bijvoorbeeld een molecuul met een centraal atoom omgeven door vier covalent gebonden atomen. Nogmaals, het maakt niet uit of die bindingen enkele, dubbele of drievoudige bindingen zijn.
AB2: Berylliumhydride (BeH2)
Berylliumhydride bestaat uit een centraal berylliumatoom met twee enkelvoudige bindingen met waterstofatomen. Bedenk dat het in strijd is met de octet regel.,
H-Be-h
volgens de eis dat elektronenparen hun Afstand tot elkaar maximaliseren, zullen de twee bindingsparen in de beh 2-moleculen zich direct tegenover het centrale Be-atoom schikken. De resulterende geometrie is een lineair molecuul, weergegeven in Figuur 1 in een” bal en stok ” model.

figuur 1. Beryllium hydride model.
De bindingshoek van H-Be-H is 180° vanwege de lineaire geometrie.,
kooldioxide is een ander voorbeeld van een molecuul dat onder de categorie AB 2 valt. De Lewis-structuur bestaat uit dubbele bindingen tussen de centrale koolstof-en zuurstofatomen (zie Figuur 2).

Figuur 2. Koolstofdioxide binding.
de afstoting tussen de twee groepen van vier elektronen (twee paren) is niet anders dan de afstoting van de twee groepen van twee elektronen (één paar) in het BeH 2-molecuul. Koolstofdioxide is ook lineair (zie Figuur 3).,

Figuur 3. Kooldioxide.
AB3: Boortrifluoride (BF3)
Boortrifluoride bestaat uit een centraal booratoom met drie enkelvoudige bindingen met fluoratomen (zie Figuur 4). Het booratoom heeft ook een onvolledig octet.
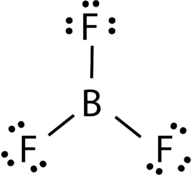
Figuur 4. Boor trifluoride binding.
de geometrie van het BF 3-molecuul wordt trigonaal vlak genoemd (zie Figuur 5). De fluor atomen zijn gepositioneerd op de hoekpunten van een gelijkzijdige driehoek., De hoek F-B-F is 120° en alle vier de atomen liggen in hetzelfde vlak.

Figuur 5. Boortrifluoride model.
AB4: methaan (CH4)
methaan is een organische verbinding die het primaire bestanddeel van aardgas is. De structuur bestaat uit een centraal koolstofatoom met vier enkelvoudige bindingen met waterstofatomen (zie Figuur 6). Om hun Afstand tot elkaar te maximaliseren, liggen de vier groepen bindingselektronen niet in hetzelfde vlak., In plaats daarvan ligt elk van de waterstofatomen op de hoeken van een geometrische vorm die een tetraëder wordt genoemd. Het koolstofatoom bevindt zich in het midden van de tetraëder. Elk vlak van een tetraëder is een gelijkzijdige driehoek.

Figuur 6. Tetraëdrische structuur van methaan.
De moleculaire geometrie van het methaanmolecuul is tetraëdrisch (zie Figuur 7). De H-C-H bindingshoeken zijn 109,5°, die groter is dan 90° dat zij zouden zijn als de molecule vlak was., Bij het tekenen van een structuurformule voor een molecuul zoals methaan is het voordelig om het driedimensionale karakter van zijn vorm aan te geven. De structuurformule hieronder wordt een perspectieftekening genoemd. De stippellijnbinding moet worden gevisualiseerd als terugwijkend in de pagina, terwijl de vaste driehoekbinding moet worden gevisualiseerd als komende uit de pagina.

Figuur 7. Methaan perspectief model.
Hoe kunnen al deze kledingstukken in zo ‘ n kleine ruimte passen?,
wanneer we reizen, nemen we vaak veel meer spullen mee dan we nodig hebben. Proberen om het allemaal in een koffer te passen kan een echte uitdaging zijn. We moeten het misschien opnieuw inpakken of er gewoon in knijpen. Atomen moeten vaak herschikken waar de elektronen zich bevinden om een stabielere structuur te creëren.

Centraal atoom met één of meer eenzame paren
De moleculaire geometrieën van moleculen veranderen wanneer het centrale atoom één of meer eenzame paren elektronen heeft., Het totale aantal elektronenparen, zowel bindingsparen als eenzame paren, leidt tot wat de elektronendomeinmeetkunde wordt genoemd. Wanneer één of meer van de bonding paren van elektronen wordt vervangen door een enkel paar, wordt de moleculaire geometrie (werkelijke vorm) van het molecuul veranderd. In overeenstemming met de A-en B-symbolen die in de vorige sectie zijn vastgesteld, zullen we E gebruiken om een enkel paar op het centrale atoom (A) voor te stellen. Een subscript zal worden gebruikt wanneer er meer dan één enkel paar is. Eenzame paren op de omringende atomen (B) hebben geen invloed op de geometrie.,
AB3E: ammoniak, NH3
het ammoniakmolecuul bevat drie enkelvoudige bindingen en één enkel paar op het centrale stikstofatoom (zie Figuur 8).

Figuur 8. Eenzame paar elektronen in ammoniak.
de domeingeometrie voor een molecuul met vier elektronenparen is tetrahedraal, zoals werd gezien met CH 4 . In het ammoniakmolecuul is één van de elektronenparen een eenzaam paar in plaats van een bindingspaar. De moleculaire geometrie van NH 3 wordt trigonaal piramidaal genoemd (zie Figuur 9).,

figuur 9. Ammoniakmolecuul.
bedenk dat de bindingshoek in het tetrahedrale CH 4-molecuul 109,5°is. Nogmaals, de vervanging van een van de gebonden elektronenparen door een eenzaam paar comprimeert de hoek enigszins. De H-N-H hoek is ongeveer 107°.
AB2E2: Water, H2O
een watermolecuul bestaat uit twee bindingsparen en twee eenzame Paren (zie Figuur 10).

Figuur 10. Eenzame paar elektronen op water.,
voor methaan en ammoniak is de domeingeometrie voor een molecuul met vier elektronenparen tetraëdrisch. In het watermolecuul zijn twee van de elektronenparen eenzame paren in plaats van bindingsparen. De moleculaire geometrie van het watermolecuul is gebogen. De H-O-H bindingshoek is 104,5°, wat kleiner is dan de bindingshoek in NH3 (zie Figuur 11).

Figuur 11. Watermolecule.,
AB4E: Zwaveltetrafluoride, SF4
De Lewis-structuur voor SF 4 bevat vier enkelvoudige bindingen en een enkel paar op het zwavelatoom (zie Figuur 12).

Figuur 12. Eenzame paar elektronen in SF4.
het zwavelatoom heeft vijf elektronengroepen eromheen, wat overeenkomt met de trigonale bipyramidale domeingeometrie, zoals in PCl 5 (Zie figuur 13). Bedenk dat de trigonale bipyramidale meetkunde drie equatoriale atomen en twee axiale atomen aan het centrale atoom heeft., Door de grotere afstoting van een enkel paar, is het een van de equatoriale atomen die vervangen worden door een enkel paar. De geometrie van het molecuul wordt een vervormde tetraëder of WIP genoemd.

Figuur 13. Bal en stick model voor SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- de aanwezigheid van elektronen van een enkel paar beïnvloedt de driedimensionale vorm van het molecuul.
praktijk
Centraal atoom zonder eenzame paren
Gebruik de link hieronder om de volgende vragen te beantwoorden:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Wat is de vorm van PF 5 ?
- welke C-H bod hoeken zouden we voorspellen voor methaan als het molecuul vlak was?
- welk molecuul heeft de configuratie van een octaëder?,
Centraal atoom met één of meer eenzame paren
Gebruik onderstaande link om de volgende vragen te beantwoorden:
- Wat is het algemene principe bij de behandeling van moleculen die meer dan vier elektronenparen bevatten?
- op de foto met vijf elektronenparen rond het centrale atoom, waarom heeft de opstelling rechts de voorkeur?
- in de afbeelding met zes elektronenparen, waarom is de configuratie met de eenzame paren bij 180o naar elkaar stabieler?,
overzicht
Centraal atoom zonder eenzame paren
- Wat zijn de bindingshoeken in kooldioxide?
- welk molecuul heeft bindingshoeken van 109,5 ° ?
- Wat is de geometrie van het BF 3-molecuul?
Centraal atoom met één of meer eenzame paren
- Waarom heeft water een gebogen geometrie?
- Waarom is ammoniak geen vlak molecuul?
- Hoe schrijven we de configuratie voor xenon tetrafluoride met behulp van het ABE systeem?















