grenzen in endocrinologie
introductie
het tumorsuppressorgen TP53 is het zwaarst bestudeerde menselijke gen sinds zijn ontdekking bijna 40 jaar geleden (1). De belangrijkste reden achter deze status is de kritieke rol p53 speelt in het verhinderen van kankerontwikkeling, en het wordt wijd beschouwd als de “beschermer van het genoom.,”Sinds enige tijd is het algemeen aangenomen dat p53′ s rol in tumorafschaffing is op grond van zijn vermogen om de apoptose, celcyclus arrestatie, en senescentie van pre-kankercellen veroorzaken (2). Nochtans, is het nu meer en meer duidelijk dat p53 vele andere wegen in de cel regelt en dat deze andere wegen ook rollen in p53 ‘ s capaciteit spelen om als tumorontstoringsapparaat (3) te functioneren. In het bijzonder, is de rol van p53 in de verordening van genen betrokken bij metabolisme en ferroptosis betrokken bij zijn capaciteit om tumorontwikkeling te onderdrukken., Ferroptosis is een nieuwe celdoodweg die voor het eerst in 2012 wordt gekarakteriseerd en kan het best worden beschreven als een ijzer-afhankelijke, caspase-onafhankelijke vorm van celdood die door de vorming van lipideperoxidatie wordt gedreven (4). Specifiek, behouden twee muismodellen die gemanipuleerde veranderingen in p53 bevatten die de capaciteit van p53 elimineren om apoptosis en senescentie te veroorzaken beide het vermogen om spontane tumorontwikkeling te onderdrukken; beide mutanten behouden het vermogen om genen in metabolisme en ferroptosis te transacteren (5, 6)., Een samenvatting van de gegevens die p53 impliceren in de regulatie van metabolisme en ferroptosis wordt hieronder beschreven.
Wild-Type (WT) p53 reguleert de oxidatieve fosforylering positief en onderdrukt het glucosemetabolisme
Wild-type p53 reguleert de metabolische veelzijdigheid van cellen door de mitochondriale ademhaling te begunstigen boven de glycolyse, deels via de transactivatie van SCO2 (cytochroom c-oxidase assemblage), die een directe rol speelt in oxidatieve fosforylering (7)., p53 regelt ook direct de transactivatie van GLS2 (Glutaminase 2); dit enzym staat glutamine gebruik toe als energiebron voor de mitochondriën (8). Bovendien reguleert WT p53 de glycolyse negatief door transcriptioneel de glucosetransporters GLUT1 en GLUT4 te onderdrukken en door rrad en TIGAR te transactiveren; beide zijn remmers van glycolyse (9-11). Tenslotte bindt p53 ook direct en remt het enzym glucose-6-fosfaatdehydrogenase, waardoor het glucosemetabolisme wordt onderdrukt (12)., Het is duidelijk uit deze en andere studies dat in normale, onbeklemde organismen, p53 direct de metabolische toestand in een cel reguleert (figuur 1). Het is niet verrassend dat dit gen en veel van zijn regulatoren betrokken zijn bij metabole ziekten, waaronder obesitas en diabetes (13).
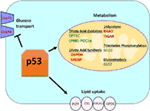
figuur 1. De rol van wild-type (WT) p53 in het metabolisme. De genen die positief door p53 worden geregeld worden getoond in groen, en de genen die negatief door p53 worden geregeld worden getoond in rood., p53 remt glucosetransport, glycolyse en vetzuursynthese terwijl het lipidebegrijpen, vetzuuroxidatie, oxidatieve phosphorylation, en glutaminolyse bevordert.
Mutant p53 reguleert het Warburg-metabolisme (aerobe glycolyse)
in tegenstelling tot de functie van WT p53, bevordert mutant p53 in tumorcellen aerobe glycolyse, deels door het versterken van het transport van glucosetransporter GLUT1 naar het plasmamembraan, waardoor de glucoseimport toeneemt (14, 15)., Na de mutatie van p53, begunstigen de verminderde niveaus van SCO2 en GLS2 en de verhoogde niveaus van GLUT1 en GLUT4 aërobe glycolyse boven oxidatieve fosforylatie. Op deze manier, wordt mutant p53 verondersteld om aan de neiging van tumorcellen bij te dragen om aërobe glycolyse ten gunste van oxydatieve phosphorylation, of zogenaamd Warburg metabolisme (15) te gebruiken. Een van de kenmerken van kanker is gedereguleerd metabolisme, over het algemeen aangetoond door deze overgang van aërobe glycolyse naar oxidatieve fosforylering., Hoewel dit resulteert in een lagere en minder efficiënte ATP opbrengst, wordt aangenomen dat kankercellen profiteren door glycolytische tussenproducten om te leiden naar biosynthetische wegen die nodig zijn voor snelle celdeling (16). Deze metabolische schakelaar leidt ook tot verminderde mitochondria-gemedieerde apoptose en efficiënter signaleren door beschikbare metabolites in kankercellen (17).
een gemeenschappelijke genetische Variant in TP53 beïnvloedt zijn functie in metabolisme
Er is een gemeenschappelijk coderingsgebied polymorfisme van p53 bij codon 72, coderend voor proline (P72) of arginine (R72)., Deze aminozuurvariatie kan p53-functie met betrekking tot cel lot na spanning beà nvloeden. In reactie op DNA-schade, triggert de P72-variant van p53 voornamelijk de arrestatie van de celcyclus, terwijl de R72-variant voornamelijk celdood of apoptose veroorzaakt (18, 19). Ondanks deze verschillen in functie is de codon 72 variatie niet consistent geassocieerd met kankergevoeligheid (20). In menselijke studies daarentegen wordt dit polymorfisme significant geassocieerd met een verhoogde body mass index en risico op diabetes (21, 22)., Dit uitgangspunt wordt ondersteund door studies in muizen, waar een muismodel voor deze codon 72 varianten verhoogde hoog-vet dieet-geïnduceerde diabetes in muizen met de R72 variant toont, in vergelijking met P72. In deze studies werden de p53-doelgenen TNFa en NPC1L1 geïdentificeerd als kritische regulatoren in de toename van dieet-geïnduceerde obesitas bij R72-muizen (23). Interessant is dat de R72-variant ook een verhoogde overleving van cellen geeft als reactie op nutriëntengebrek (24)., Deze bevindingen hebben geleid tot de hypothese dat de R72 variant van p53 ontstond en werd geselecteerd voor als populaties naar het noorden gemigreerd, waar koud weer verhoogde vetophoping zou vereisen, maar waar overleving in reactie op nutriëntengebrek ook onder selectie zou zijn (24).
p53 reguleert het lipidenmetabolisme
hoewel p53 bekend staat om het reguleren van de glycolyse en de citroenzuurcyclus, is ook aangetoond dat p53 een rol speelt bij het reguleren van het lipidenmetabolisme (25)., Men gelooft dat WT p53 vetzuuroxidatie verbetert terwijl het remmen van vetzuursynthese, dus handelend als een negatieve regulator van lipidesynthese (25). Er zijn verscheidene p53 doelgenen met rollen in lipidemetabolisme. Sanchez-Macedo en collega ‘ s toonden aan dat carnitine palmitoyltransferase 1C (CPT1C) transcriptioneel wordt gereguleerd door p53; dit enzym helpt bij het transport van geactiveerde vetzuren naar de mitochondriën., Ter ondersteuning van een rol voor dit p53-geregeld gen in kanker, toonde deze groep aan dat cpt1c-deficiënte muizen vertraagde tumorontwikkeling en hogere overlevingspercentages vertonen (26). Lipine 1 (lpin1) is een ander p53-doelgen; LPIN1 is noodzakelijk voor een goede adipocyte-ontwikkeling en wordt geïnduceerd onder omstandigheden met weinig voedingsstoffen (27). Finck en collega ‘ s toonden aan dat LPIN1 interageert met PGC-1α, een ander bekend p53-doelgen met een rol in het metabolisme, en dat deze interactie de expressie activeert van genen die betrokken zijn bij het bevorderen van vetzuuroxidatie (28).,
naast het rechtstreeks reguleren van de transcriptie van genen die betrokken zijn bij het lipidenmetabolisme, kan p53 ook het lipidenmetabolisme reguleren op een manier die directe eiwit–eiwitinteractie impliceert. Bijvoorbeeld, bindt glucose-6-fosfaatdehydrogenase, die het tarief-beperkende enzym in de weg van het pentosefosfaat is, aan en wordt direct geremd door p53, resulterend in verminderde NADPH productie en bijgevolg verminderde vetzuursynthese (12)., De sterol regulatory element-binding proteins (SREBP) familie van transcriptiefactoren moduleren de expressie van genen betrokken bij cholesterol, vetzuur, triacylglycerol en fosfolipiden synthese (29-31). WT p53 onderdrukt de SREBP-functie (32), terwijl de mutantvormen van p53 direct aan SREBP binden en hun transcriptional functie verbeteren, leidend tot verhoogde SREBP-activiteit in menselijke tumors (33, 34). Bijgevolg is mutant p53 gecorreleerd met hogere expressie van sterol biosynthese genen in menselijke borsttumoren (34, 35)., Tot slot, AMP-geactiveerde eiwitkinase (AMPK) is een enzym dat onder lage nutriëntenniveaus of energiestress wordt geactiveerd en gekend is om vetzuursynthese te remmen door met acetyl-CoA-carboxylase en SREBP-1 (36, 37) in wisselwerking te staan. Zhou en collega ‘ s toonden aan dat mutant p53 bij voorkeur bindt aan en AMPK remt, wat leidt tot verhoogde vetzuursynthese. Dientengevolge, leiden de mutant p53 proteã nen tot verhoogde AMPK het signaleren, bijdragend tot invasieve celgroei van tumorcellen (33). Een minder onderzocht gebied is de rol van p53 in lipidevervoer., Er is aangetoond dat p53 transcriptioneel apolipoproteïne B (apoB) en apoB editing enzyme complex 1 reguleert, wat wijst op de rol van p53 in het reguleren van atherogene lipoproteïnen (38). De microarray analyse van menselijke lever-afgeleide cellen identificeerde phospholipid overdrachtproteã ne, ATP bindende cassette A12, en carboxylesterlipase als drie p53 doelgenen die allen een rol in lipidetransport spelen (39, 40)., Over het algemeen, hoewel het duidelijk is dat p53 een belangrijke rol speelt in het bemiddelen van lipidensynthese en metabolisme, de bijdrage van deze weg, en deze p53 doelgenen, aan tumorafschaffing door p53 moet nog worden bepaald (figuur 1).
Ferroptosis is een nieuwe Celdoodweg gedreven door lipideperoxidatie
in 2012 ontdekten Dixon en collega ‘ s een nieuwe vorm van gereguleerde celdood genaamd ferroptosis. Ferroptosis is een ijzerafhankelijke, caspase-onafhankelijke vorm van celdood als gevolg van de accumulatie van geoxideerde lipiden (4, 41)., Dit proces wordt gedreven door de inactivering van glutathionperoxidase 4 (GPX4), een enzym dat verantwoordelijk is voor het omzetten van dodelijke lipidehydroperoxiden in niet-toxische lipidenalcoholen, waarvoor glutathion nodig is om te kunnen functioneren (41). Men gelooft dat de peroxidatie van meervoudig onverzadigde vetzuren (PUFAs) de drijvende impuls voor celdood door ferroptosis is. PUFA ‘ s bevatten bis-allylprotonen die gemakkelijk kunnen worden geabstraheerd en radicalen produceren die reageren met zuurstof, waardoor meer radicalen ontstaan en een kettingreactie ontstaat van reactieve zuurstofsoorten met lipiden (42)., Het exacte mechanisme van celdood door ferroptosis blijft onbekend, maar één hypothese is dat de lipideschade tot de vernietiging van het plasmamembraan leidt (43). Er is gespeculeerd dat ferroptosis een mechanisme van tumorafschaffing zou kunnen zijn die door cellen te elimineren die voedingsstof beroofd zijn of aan een milieustress of besmetting zijn blootgesteld.,
farmacologische regulatie van Ferroptosis
Ferroptosis kan worden geïnduceerd met behulp van remmers van systeem xc− zoals erastine, of analogen zoals glutamaat en sorafenib, die de invoer van cystine remmen, resulterend in depletie van glutathion en daaropvolgende inactivatie van GPX4. Als alternatief kan ferroptosis worden veroorzaakt door (1S, 3R) – RSL3 (hierna aangeduid als RSL3), die direct bindt aan en remt GPX4 (4, 5, 42). Buthion sulfoximine, FIN56, FINO2, CCl4, en cisplatine zijn andere agenten die zijn aangetoond om ferroptosis in cellen te veroorzaken., De dood door ferroptosis kan worden voorkomen door lipideperoxidatie te onderdrukken, die kan worden bereikt door lipofiele antioxidanten te gebruiken, zoals ferrostatin-1, liproxstatin-1, of vitamine E. Ijzerchelatoren zoals deferoxamine of cicloprox zijn een ander hulpmiddel dat wordt gebruikt om ferroptosis te onderdrukken door de niveaus van ijzer te verminderen. Het uitputten van PUFAs of het toevoegen van enkelvoudig onverzadigde vetzuren aan de media van de celkweek kan cellen van ferroptosis ook redden (42, 44).,
Ferroptosis is betrokken bij p53-gemedieerde Tumoronderdrukking
In 2012 ontwikkelden Gu en collega ‘ s een muismodel waarin drie normaal geacetyleerde lysineresiduen in het DNA-bindingsdomein van p53 werden gemuteerd tot arginine en daarom niet geacetyleerd konden worden; deze muis wordt de 3kr-muis genoemd. In het bijzonder, kunnen de cellen van de 3kr muis p53-afhankelijke apoptosis, de arrestatie van de celcyclus, of senescentie ondergaan, en inderdaad slaagt de 3kr-mutant van p53 er niet in om de meerderheid van p53-doelgenen te transactiveren., Interessant is dat dit muismodel niet spontaan kanker ontwikkelt, wat impliceert dat p53 tumorontwikkeling onafhankelijk van senescentie of apoptose kan onderdrukken (45). Deze groep vond dat de mutant 3kr proteã ne de capaciteit behoudt om ferroptosis te ondergaan en cystinemetabolisme te regelen door de uitdrukking van cystine importeur SLC7A11 te regelen; dit stelde voor dat ferroptosis één weg zou kunnen zijn die aan p53-bemiddelde tumorafschaffing ten grondslag ligt., Wanneer wild type en 3KR MEFs werden behandeld met de ferroptosis inductor Erastin, werd bijna 50% celdood waargenomen terwijl p53 nul MEFs 20% celdood vertoonde; dit wijst erop dat p53 cellen sensibiliseert voor ferroptosis, en ook dat andere belangrijke regelgevers ook een rol spelen in ferroptosis (5). Later, identificeerden Gu en collega ‘ s een extra acetylation plaats bij lysine 98 van p53, en zij produceerden een muismodel waarin alle vier acetylation plaatsen in arginine (4KR) werden veranderd., Interessant, was de 4kr-mutant niet in staat om genen betrokken bij ferroptosis zoals SLC7A11 te regelen, en in tegenstelling tot de 3kr-mutant was niet in staat om tumorontwikkeling te onderdrukken (46). Hoewel momenteel correlative, impliceren deze gegevens de rol van p53 in ferroptosis in zijn capaciteit om tumorontwikkeling te onderdrukken.
in niet-getransformeerde cellen reguleert p53 positief Ferroptosis
naast SLC7A11 zijn verschillende andere directe p53-doelgenen ontdekt die een rol spelen bij ferroptosis. Deze omvatten GLS2, PTGS2, en SAT1., Studies van twee afzonderlijke groepen ondersteunen de rol van GLS2 in ferroptosis, waarvan bekend is dat het glutathion verlaagt en cellulaire Ros-niveaus verhoogt. Jiang en collega ‘ s gebruikten ferroptoseremmers gecombineerd met glutaminolyse-remmers om Erastine-geïnduceerde ferroptosis te remmen, waardoor werd aangetoond dat ferroptosis glutaminolyse en GLS2 vereist (47). Murphy en collega ‘ s toonden aan dat een polymorfe variant van p53 groeistilstand en senescentie in zowel menselijke als muriene cellen kon veroorzaken, maar er niet in slaagde om SLC7A11 te onderdrukken of gls2 te transactiveren., Deze variant werd duidelijk verminderd bij het veroorzaken van ferroptosis en het onderdrukken van tumorontwikkeling, waarbij opnieuw de rol van p53 in ferroptosis-gemedieerde tumorafschaffing impliceerde (48). Een ander p53-doelgen met een rol in ferroptosis is PTGS2, een gen dat het enzym cyclooxygenase-2 codeert. Stockwell en collega ‘ s toonden eerst aan dat de inductie van ferroptosis gebruikend Erastin en RSL3 tot de upregulation van PTGS2 (41) leidde. Met name werd PTGS2 niet upregulated door ferroptosis-inductoren in p53-nulcellen, die suggereren dat deze verordening p53 afhankelijk is (5)., Momenteel wordt de upregulatie van PTGS2 veel gebruikt als een ferroptosis marker (5, 41).
een recente studie van de Gu-groep toonde aan dat het p53-doelgen SAT1 ferroptosis reguleert (49). De auteurs identificeerden SAT1 als een direct doel van p53 en toonden aan dat het tot zwijgen brengen van SAT1 celdood verminderde die door reactieve zuurstofspecies in cellen met WT p53 wordt veroorzaakt, maar geen effect in p53-nulcellen had. Mechanistisch toonde deze groep aan dat SAT1 het niveau en de activiteit van arachidonaat 15-lipoxygenase verhoogt, een ijzerbindend enzym dat PUFA ‘ s oxideert en de peroxidatie van lipiden verhoogt., Met name toonde deze studie aan dat noch p53 noch SAT1 alleen voldoende lijken te zijn om ferroptosis te veroorzaken. In plaats daarvan, zijn de gecombineerde gegevens meer consistent met de premisse dat p53, door het regelen van genen die tot ferroptosis bijdragen, de gevoeligheid van cellen aan deze weg regelt, eerder dan direct ferroptosis veroorzaakt. Of p53 andere genen die betrokken zijn bij ferroptosis reguleert, moet nog worden bepaald (figuur 2).
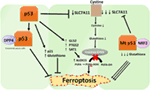
Figuur 2. De verschillende rollen van p53 in ferroptosis., De remming van glutathionperoxidase 4 (GPX4), het belangrijkste enzym dat de omzetting van meervoudig onverzadigde vetzuren (PUFA ‘ s) katalyseert die peroxiden in alcoholen bevatten, is de belangrijkste drijvende kracht achter ferroptosis. Afhankelijk van de context, kan p53 ferroptosis (zoals in colorectal kankercellen) onderdrukken of ferroptosis bevorderen. Mutant p53 sensibiliseert cellen voor ferroptosis zelfs meer dan wild-type p53.,
In sommige cellen reguleert p53 Ferroptosis
een recent door Tarangelo en collega ‘ s gepubliceerde studie toont aan dat p53 ferroptosis in kankercellen negatief reguleert (50). Deze groep vond dat het voorbehandelen van cellen met Nutlin-3, een samenstelling die p53 stabiliseert het begin van ferroptosis in verscheidene celtypes vertraagt. Het vertraagde begin van ferroptosis werd gevonden om van CDKN1A (coderend p21), een kritisch p53 transcriptional doel af te hangen., Het mechanisme waardoor P21 ferroptosis vertraagt moet nog worden opgehelderd, maar men gelooft dat het behoud van intracellular glutathion een bijdragende factor voor verminderde ferroptosisgevoeligheid kan zijn. De auteurs concluderen dat de p53-P21 as kankercellen in staat stelt om te overleven onder omstandigheden van metabole stress, zoals cystine deprivatie, door het onderdrukken van het begin van ferroptosis (50). Een recente studie toonde aan dat p53 ferroptosis in colorectale kankercellen remt door aan het enzym dipeptidyl-peptidase-4 (DPP4) te binden, die een modulator van ferroptosis en lipidemetabolisme is., Mechanistisch, toonde deze studie aan dat p53 ferroptosis tegenwerkt door dpp4 in een nucleaire enzymatische inactieve pool te isoleren. Bij afwezigheid van p53, is DPP4 vrij om met een complex met NOX1 in wisselwerking te staan en te vormen; dit leidt tot verhoogde lipideperoxidatie en ferroptosis. De remming van DPP4 onderdrukt ferroptosis beduidend, terwijl de overexpressie van dpp4 de gevoeligheid van Erastin, in het bijzonder in p53-uitgeputte cellen teweegbrengt (51). De bidirectionele controle van ferroptosis door p53 door transcriptie-afhankelijke en transcriptie-onafhankelijke mechanismen kan context of cel-type afhankelijk zijn (figuur 2).,
het P47s-polymorfisme van TP53 beïnvloedt Ferroptosis en Tumorsuppressie
naast missense-mutaties zijn er verschillende functioneel significante single-nucleotide polymorfismen (SNP ‘ s) in het TP53-gen en andere eiwitten waarvan bekend is dat ze deze route reguleren (zoals MDM2 en MDM4). De pro47ser variant (hierna S47) is de tweede meest voorkomende SNP gevonden in de p53 codering Regio (na Pro72Arg) die de aminozuurvolgorde van het eiwit verandert., Om de impact van deze variant op de p53-functie en het risico op kanker beter te verduidelijken, genereerde de Murphy-groep een gehumaniseerd p53-knock-in-muismodel, waarin exons 4-9 van muriene p53 werden vervangen door menselijke p53-exons die ofwel het wildtype of de S47-variant (52-55) bevatten. De meerderheid van de S47-muizen ontwikkelde spontaan tumoren van verschillende histologische typen, met name leverkanker, tussen 12 en 18 maanden oud, in tegenstelling tot WT p53-muizen (48)., In muis embryonale fibroblasten en menselijke lymfoblastoïde cellijnen, toonde de variant S47 verminderde geprogrammeerde celdood in reactie op cisplatine en andere genotoxische spanningen. Mechanistisch is de S47-variant defect voor de transactivatie van genen die betrokken zijn bij het metabolisme, zoals Gls2 (glutaminase 2) en Sco2 (48). Consistent met de rol van Gls2 in ferroptosis, vond deze groep dat S47 cellen duidelijk resistent waren tegen de ferroptosis-inducerende agenten Erastin en RSL3 (47, 48). Dit defect kan bijdragen aan de tumor-gevoelig fenotype waargenomen in S47 muizen.,
Mutant p53 sensibiliseert tumorcellen voor Ferroptosis
Wild-type p53 reguleert negatief de expressie van de cystine-importeur SLC7A11, die de gevoeligheid voor ferroptosis remt (5). Hoewel deze verordening in normale cellen voorkomt, in tumorcellen, lijken andere bemiddelaars van SLC7A11 in de verordening van dit gen te overheersen. Bijvoorbeeld, kan de hoofdantioxidant transcriptiefactor NRF2 de uitdrukking van SLC7A11 op het transcriptional niveau ook regelen, en NRF2 is betrokken als zeer belangrijke speler in het beschermen van kankercellen tegen ferroptosis., Bijvoorbeeld, verhoogt de remming van NRF2 in hepatocellular kankercellen de anti-kankeractiviteit van Erastin en Sorafenib in vivo (56). De mutantvormen van p53 kunnen NRF2-functie door directe interactie remmen, en één groep vond dat de tumors met mutant p53 zeer lage niveaus van SLC7A11 bevatten, en zo verhoogde gevoeligheid voor ferroptosis tonen. Met name, leidde de overexpressie van SLC7A11 in mutant p53 modellen tot drugresistentie, die suggereren dat niveaus van slc7a11 uitdrukking moeten worden overwogen wanneer het richten van mutant p53 gedreven kanker met ferroptosis-veroorzakende samenstellingen (57)., Ter ondersteuning van deze premisse, recent werk in colorectal (CRC) kanker, waar de verandering of de schrapping van p53 een frequente gebeurtenis is, toonde aan dat menselijke CRC cellijnen die mutant p53 herbergen veel gevoeliger waren voor Erastin-gemedieerde celdood in vergelijking met CRC-cellen met WT p53. Om deze bevindingen te valideren, toonden zij aan dat klop in van een p53 hotspotmutatie in zowel hct116 als SW48 cellen gevoeligheid voor Erastin herstelde (51). Deze gegevens benadrukken een nieuw mechanisme waardoor kanker gedreven door mutant p53 kan worden benut gebruikend gerichte therapie.,
conclusie
de rol van p53 in het metabolisme is vrij duidelijk en mogelijk zelfs intuïtief duidelijk: WT p53 beperkt het glucosemetabolisme en de lipidensynthese, terwijl mutant p53 het tegenovergestelde lijkt te doen. De bijdrage van zijn metabolische rol aan tumorafschaffing door p53, en aan de capaciteit van mutant p53 om tumorprogressie te drijven, moet ondubbelzinnig worden bewezen. De rol van p53 in de verordening van ferroptosis, en de bijdrage van deze functie, aan tumorafschaffing is nog minder duidelijk., Terwijl de dwingende gegevens van muismodellen het uitgangspunt steunen dat p53 de gevoeligheid van cellen aan ferroptosis regelt, kan dit tot de capaciteit van basaal p53 worden beperkt om spontane tumorontwikkeling te onderdrukken, en in oncogene-benadrukte muismodellen, is het duidelijk dat senescentie en apoptosis de overheersende rol spelen. Evenzo, kan p53 ferroptosisgevoeligheid op een celtype-specifieke manier regelen. Meer studies in dierlijke modellen, met aandacht voor ferroptosis in verschillende weefsels, moeten worden gedaan om de rol van p53 in ferroptosis en ferroptosis in tumorafschaffing vollediger te begrijpen., Bovendien, moet een duidelijker idee van wat p53-doelgenen een rol in gevoeligheid voor ferroptosis spelen worden bereikt. De oplossing van deze vragen zou voor broodnodige nieuwe wegen moeten voorzien om tumors met mutant p53 te bestrijden.
Auteursbijdragen
KG, SB, TB, AB-K, C-PK en MM schreven elk één tot twee alinea ‘ s van dit artikel. KG en SB deden het cijfer. KG en MM schetste het hoofdstuk.,
belangenconflict verklaring
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
de recensent OAF en handling Editor verklaarde hun gedeelde affiliatie.
Dankbetuigingen
het in deze publicatie gerapporteerde onderzoek werd ondersteund door de National Institutes of Health onder de Prijsnummers CA102184 (MM), CA201430 (MM), TL1TR002344 (C-PK) en T32 CA009171 (TB)., De inhoud valt uitsluitend onder de verantwoordelijkheid van de auteurs en vertegenwoordigt niet noodzakelijk de officiële standpunten van de Nationale Instituten voor gezondheid.
3. Humpton TJ, Vousden KH. Regulatie van cellulair metabolisme en hypoxie door p53. Cold Spring Harb Perspect Med (2016) 6(7):211-30. doi: 10.1101 / cshperspect.a026146
CrossRef Full Text / Google Scholar
10. Zhang C, Liu J, Wu R, Liang Y, Lin M, Liu J, et al., Tumorontstoringsapparaat p53 reguleert negatief glycolyse die door hypoxie door zijn doelrrad wordt bevorderd. Oncotdoel (2014) 5(14):5535-46. doi: 10.18632 / oncotdoel.2137
PubMed Abstract | CrossRef Full Text/Google Scholar
17. Lee M, Yoon JH. Metabolisch samenspel tussen glycolyse en mitochondriale oxidatie: het omgekeerde Warburg-effect en de therapeutische implicatie ervan. Wereld J Biol Chem (2015) 6(3):148-61. doi: 10.4331 / wjbc.v6.i3.,148
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dumont P, Leu JI, Della Pietra AC III, George DL, Murphy M. The codon 72 polymorphic variants of p53 have markedly different apoptotic potential. Nat Genet (2003) 33(3):357–65. doi:10.1038/ng1093
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Kung CP, Khaku S, Jennis M, Zhou Y, Murphy ME., Identification of TRIML2, a novel p53 target, that enhances p53 SUMOylation and regulates the transactivation of proapoptotic genes. Mol Cancer Res (2015) 13(2):250–62. doi:10.1158/1541-7786.MCR-14-0385
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Bitti ML, Saccucci P, Capasso F, Piccinini S, Angelini F, Rapini N, et al. Genotypes of p53 codon 72 correlate with age at onset of type 1 diabetes in a sex-specific manner. J Pediatr Endocrinol Metab (2011) 24(7–8):437–9. doi:10.1515/jpem.,2011.058
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Kung CP, Liu Q, Murphy ME. The codon 72 polymorphism of p53 influences cell fate following nutrient deprivation. Cancer Biol Ther (2017) 18(7):484–91. doi:10.1080/15384047.2017.1323595
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sanchez-Macedo N, Feng J, Faubert B, Chang N, Elia A, Rushing EJ, et al., Uitputting van het nieuwe p53-doelgen carnitine palmitoyltransferase 1C vertraagt tumorgroei in het Neurofibromatose type I tumormodel. Celdood Verschilt (2013) 20(4):659-68. doi: 10.1038 / cdd.2012.168
PubMed Abstract | CrossRef Full Text/Google Scholar
30. Ettinger SL, Sobel R, Whitmore TG, Akbari M, Bradley DR, Gleave ME, et al. Dysregulation van de element-bindende proteã nen van de sterolrespons en stroomafwaartse effectoren in prostate kanker tijdens progressie aan androgen onafhankelijkheid., Cancer Res (2004) 64(6):2212–21. doi:10.1158/0008-5472.CAN-2148-2
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Clendening JW, Pandyra A, Boutros PC, El Ghamrasni S, Khosravi F, Trentin GA, et al. Dysregulation of the mevalonate pathway promotes transformation. Proc Natl Acad Sci U S A (2010) 107(34):15051–6. doi:10.1073/pnas.,0910258107
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Yang WS, Kim KJ, Gaschler MM, Patel M, Shchepinov MS, Stockwell BR. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis. Proc Natl Acad Sci U S A (2016) 113(34):E4966–75. doi:10.1073/pnas.1603244113
PubMed Abstract | CrossRef Full Text | Google Scholar
54., Luo JL, Yang Q, Tong WM, Hergenhahn M, Wang ZQ, Hollstein M. Knock-in muizen met een chimeric human/murine p53 gen ontwikkelen normaal en tonen wild-type p53 reacties op DNA schadelijke agenten: een nieuwe biomedische onderzoeksinstrument. Oncogeen (2001) 20(3):320-8. doi: 10.1038 / sj.onc.1204080
PubMed Abstract | CrossRef Full Text/Google Scholar
57. Liu DS, Duong CP, Haupt S, Montgomery KG, House CM, Azar WJ, et al. Het remmen van het systeem XC- / glutathion as richt selectief kanker met Mutant-p53 accumulatie., Nat Commun (2017) 8:14844. doi:10.1038/ncomms14844
PubMed Abstract | CrossRef Full Text | Google Scholar















