17.3: wskaźniki kwasowo-zasadowe
cele uczenia się
- wyjaśnij funkcje i zmiany kolorów wskaźników kwasowo-zasadowych
- Pokaż, jak wybrać odpowiedni wskaźnik do eksperymentu miareczkowania
- Określ stałe dysocjacji kwasowej Ka lub Kai wskaźników.
niektóre substancje organiczne zmieniają kolor w rozcieńczonym roztworze, gdy stężenie jonów hydroniowych osiągnie określoną wartość., Na przykład fenoloftaleina jest bezbarwną substancją w dowolnym roztworze wodnym o stężeniu jonów hydroniowych większym niż 5,0 × 10-9 m (pH < 8,3). W bardziej podstawowych roztworach, gdzie stężenie jonów hydroniowych jest mniejsze niż 5,0 × 10-9 m (pH > 8,3), jest czerwony lub różowy. Substancje takie jak fenoloftaleina, które można wykorzystać do określenia pH roztworu, nazywane są wskaźnikami kwasowo-zasadowymi. Wskaźniki kwasowo-zasadowe to albo słabe kwasy organiczne, albo słabe zasady organiczne.,
równowaga w roztworze wskaźnika kwasowo-zasadowego pomarańczy metylowej, słabego kwasu, może być reprezentowana przez równanie, w którym używamy Hin jako prostej reprezentacji złożonej cząsteczki pomarańczy metylowej:
\
\}{}}=4.0×10^{-4}\]
anion metylu pomarańczowy, W -, jest żółty, a postać niejonowana, HIn, jest czerwona. Gdy dodamy kwas do roztworu pomarańczy metylowej, zwiększone stężenie jonów hydroniowych przesuwa równowagę w kierunku niezjonizowanej formy czerwonej, zgodnie z zasadą Le Chateliera. Jeśli dodamy bazę, przesuniemy równowagę w kierunku żółtej formy., Zachowanie to jest całkowicie analogiczne do działania buforów.
kolor wskaźnika jest widocznym wynikiem stosunku stężeń dwóch gatunków In− i HIn. Jeśli większość wskaźnika (zazwyczaj około 60-90% lub więcej) jest obecna jako In−, wtedy widzimy Kolor in-jonu, który byłby żółty dla metylo-pomarańczowy. Jeśli większość jest obecna jako Hin, wtedy widzimy kolor cząsteczki HIn: czerwony dla pomarańczy metylowej., Dla pomarańczy metylowej możemy przestawić równanie dla Ka i zapisać:
\}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}\]
\}{\mathit{K}_a}\]
\} {\mathit {K} _a}\right)=log\left (\dfrac {} {}\right)}\]
\)-Log (\mathit {k} _a)=-log\left (\dfrac {} {}\right)}\]
\} {}\right)}
\} {}\right)\: or\: pH=P\mathit {k} _a+log\left (\dfrac {} {}\right)}\]
ostatnia formuła jest taka sama jak równanie hasselbalcha, które można wykorzystać do opisu równowagi wskaźników.,
Gdy ma taką samą wartość liczbową jak Ka, stosunek do jest równy 1, co oznacza, że 50% wskaźnika występuje w postaci czerwonej (HIn), a 50% w postaci żółtej jonowej( In -−, a roztwór wygląda na pomarańczowy. Gdy stężenie jonów hydroniowych wzrośnie do 8 × 10-4 M (pH 3,1), roztwór zmieni kolor na czerwony. Nie widać zmiany barwy w przypadku dalszego wzrostu stężenia jonów hydroniowych(spadku pH). Przy stężeniu jonów hydroniowych 4 × 10-5 M (pH 4.,4), większość wskaźnika jest w żółtej postaci jonowej ,a dalszy spadek stężenia jonów hydroniowych (wzrost pH) nie powoduje widocznej zmiany koloru. Zakres pH między 3,1 (czerwony) i 4,4 (żółty) jest przedziałem zmiany koloru metylu pomarańczowego; wyraźna zmiana koloru zachodzi między tymi wartościami pH.
wiele różnych substancji może być używanych jako wskaźniki, w zależności od konkretnej reakcji, która ma być monitorowana., Na przykład sok z czerwonej kapusty zawiera mieszaninę barwnych substancji, które zmieniają kolor z głębokiej czerwieni przy niskim pH na Jasnoniebieski przy średnim pH na żółty przy wysokim pH (rysunek \(\PageIndex{1}\)). We wszystkich przypadkach jednak dobry wskaźnik musi mieć następujące właściwości:
- zmiana koloru musi być łatwo wykryta.
- zmiana koloru musi być szybka.
- cząsteczka wskaźnikowa nie może reagować z miareczkowaną substancją.
- aby zminimalizować błędy, wskaźnik powinien mieć pKin, który mieści się w jednej jednostce pH oczekiwanego pH w punkcie równoważności miareczkowania.,

sok z czerwonej kapusty zawiera mieszaninę substancji, których kolor zależy od pH. każda probówka zawiera roztwór soku z czerwonej kapusty w wodzie, ale pH roztworów waha się od pH = 2,0 (daleko w lewo) do pH = 11,0 (daleko w prawo). Przy pH = 7,0 roztwór jest niebieski.,
opracowano syntetyczne wskaźniki, które spełniają te kryteria i obejmują praktycznie cały zakres pH. Rysunek \(\PageIndex{2}\) pokazuje przybliżony zakres pH, w którym niektóre popularne wskaźniki zmieniają kolor i ich zmianę koloru. Ponadto niektóre wskaźniki (takie jak błękit tymolowy) to kwasy poliprotowe lub zasady, które zmieniają kolor dwukrotnie przy szeroko rozdzielonych wartościach pH.
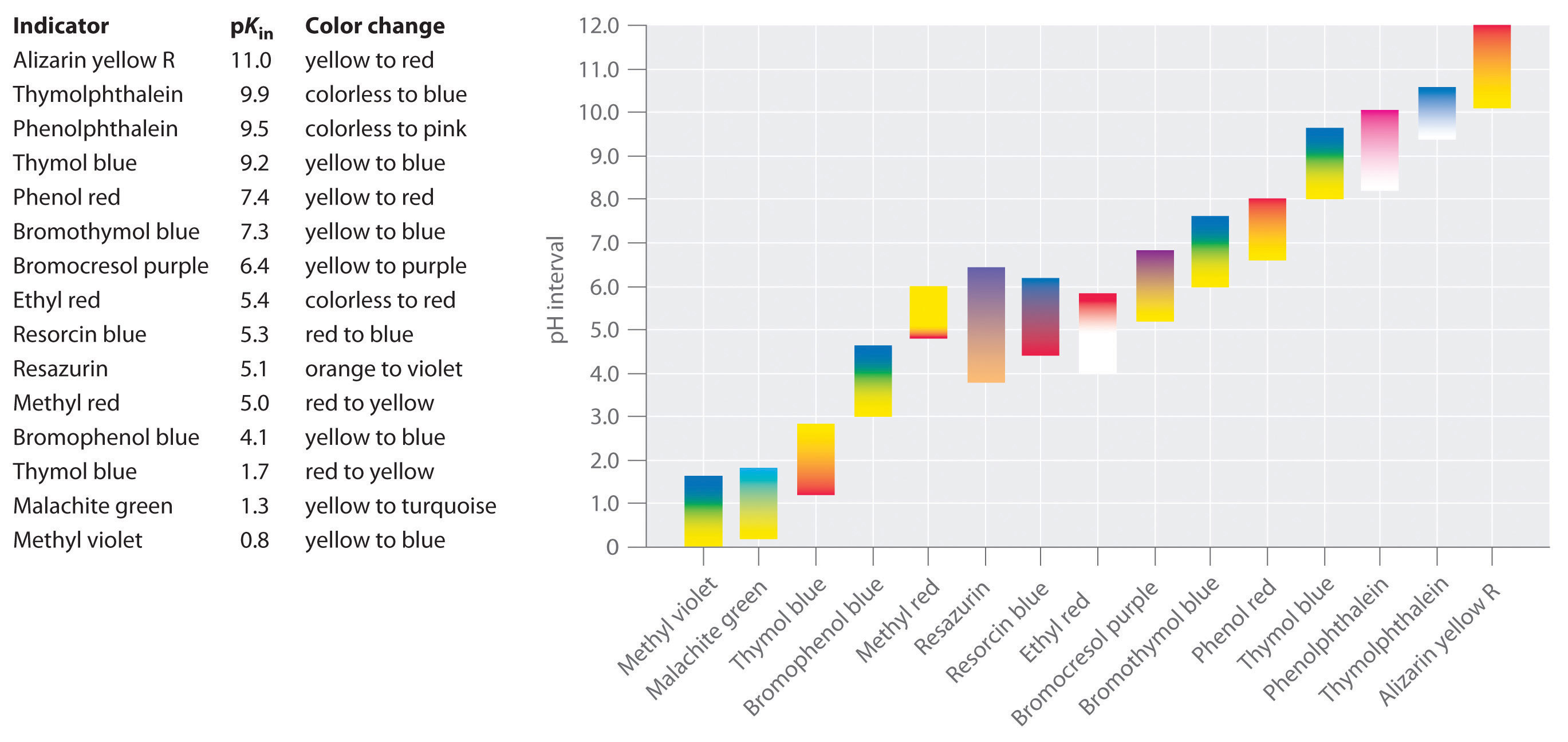
ważne jest, aby mieć świadomość, że wskaźnik nie zmienia nagle koloru przy określonej wartości pH; zamiast tego faktycznie ulega miareczkowaniu pH, podobnie jak każdy inny kwas lub zasada. Gdy stężenie Hin maleje, a stężenie In-wzrasta, kolor roztworu powoli zmienia się z charakterystycznego koloru HIn na kolor In -− Jak zobaczymy w Sekcji 16, / stosunek zmienia się od 0.,1 przy pH jedna jednostka poniżej pKin do 10 przy pH jedna jednostka powyżej pKin. Tak więc większość wskaźników zmienia kolor w zakresie pH około dwóch jednostek pH.
stwierdziliśmy, że dobry wskaźnik powinien mieć wartość pKin zbliżoną do oczekiwanego pH w punkcie równoważności. W przypadku silnego miareczkowania zasadowego, wybór wskaźnika nie jest szczególnie krytyczny ze względu na bardzo dużą zmianę pH, która zachodzi wokół punktu równoważności., Natomiast użycie niewłaściwego wskaźnika do miareczkowania słabego kwasu lub słabej zasady może spowodować stosunkowo duże błędy, jak pokazano na rysunku \(\PageIndex{3}\). Rysunek ten pokazuje wykresy pH w stosunku do objętości Zasady dodanej do miareczkowania 50,0 mL 0,100 M roztworu mocnego kwasu (HCl) i słabego kwasu (kwasu octowego) z 0,100 m \(NaOH\). Zakresy pH, w których dwa wspólne wskaźniki (czerwień metylowa, \(pK_{in} = 5.0\) i fenoloftaleina, \(pK_{in} = 9.5\)) zmieniają kolor są również pokazane., Poziome paski wskazują zakresy pH, w których oba wskaźniki zmieniają kolor, krzyżują się z krzywą miareczkowania HCl, gdzie jest prawie pionowa. Dlatego oba wskaźniki zmieniają kolor, gdy zasadniczo dodano tę samą objętość \(NaOH\) (około 50 mL), co odpowiada punktowi równoważności. Natomiast miareczkowanie kwasu octowego daje bardzo różne wyniki w zależności od tego, czy jako wskaźnik stosuje się czerwień metylową czy fenoloftaleinę., Chociaż zakres pH, w którym fenoloftaleina zmienia kolor, jest nieco większy niż pH w punkcie równoważności silnego miareczkowania kwasu, błąd będzie znikomy ze względu na nachylenie tej części krzywej miareczkowania. Podobnie jak w przypadku miareczkowania HCl, wskaźnik fenoloftaleiny zmieni kolor na różowy po dodaniu około 50 mL \(NaOH\) do roztworu kwasu octowego. Natomiast czerwień metylowa zaczyna zmieniać się z Czerwonej na żółtą wokół pH 5, które znajduje się w pobliżu punktu środkowego miareczkowania kwasu octowego, a nie punktu równoważności., Dodanie tylko około 25-30 mL \(NaOH\) spowoduje zatem zmianę koloru wskaźnika Czerwieni metylowej, co spowoduje ogromny błąd.
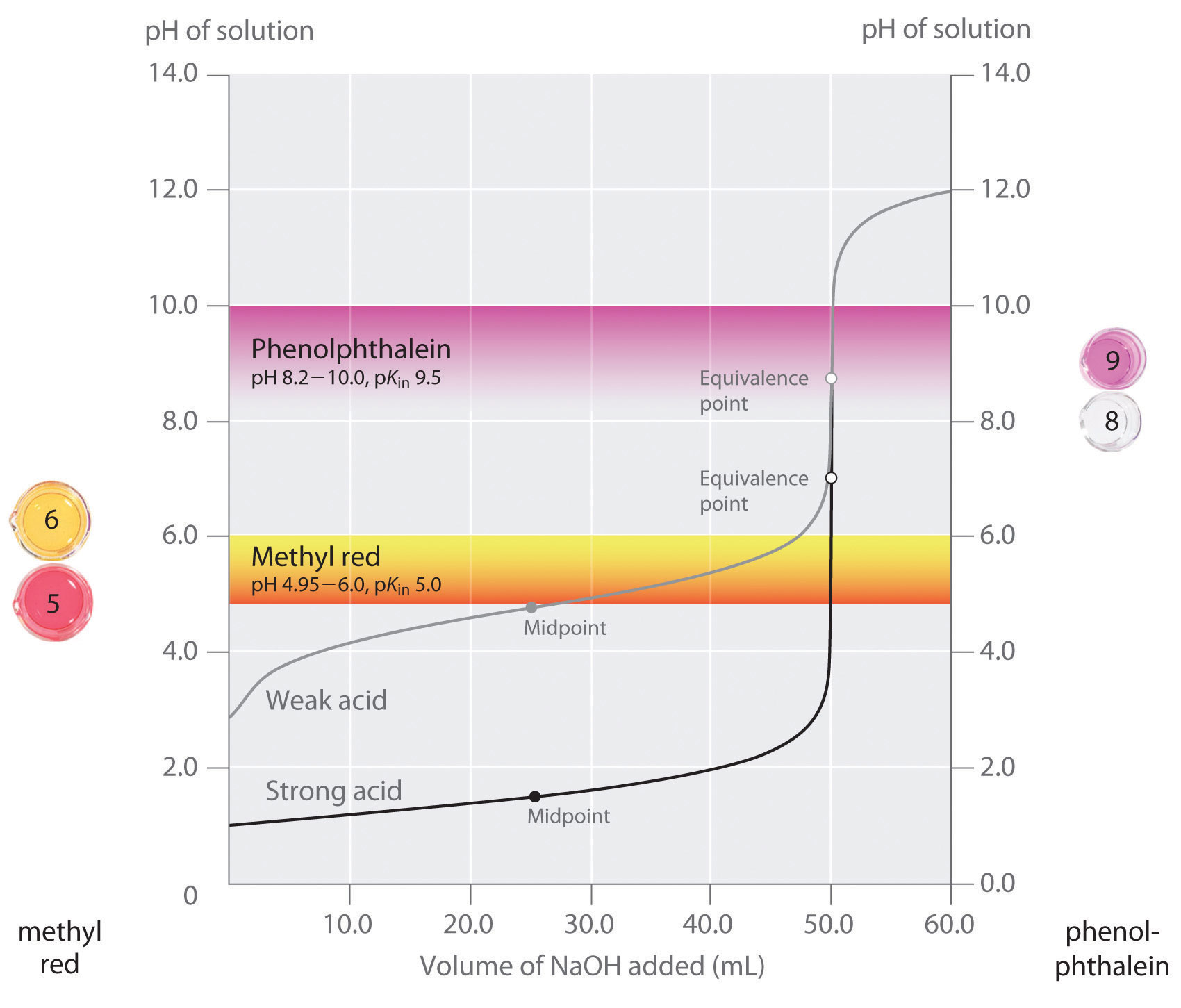
wykres pokazuje wyniki uzyskane za pomocą dwóch wskaźników (czerwień metylowa i czerwień metylowa). fenoloftaleina) do miareczkowania 0,100 m roztworów mocnego kwasu (HCl) i słabego kwasu (kwas octowy) z 0,100 m \(NaOH\)., Ze względu na stromość krzywej miareczkowania silnego kwasu wokół punktu równoważności, każdy wskaźnik szybko zmieni kolor w punkcie równoważności miareczkowania silnego kwasu. Natomiast pKin dla czerwieni metylowej (5.0) jest bardzo zbliżony do pKa kwasu octowego (4.76); punkt środkowy zmiany koloru dla czerwieni metylowej występuje w pobliżu punktu środkowego miareczkowania, a nie w punkcie równoważności.
ogólnie rzecz biorąc, dla miareczkowania silnych kwasów z silnymi zasadami (i vice versa), wystarczy każdy wskaźnik z pK pomiędzy około 4,0 A 10,0., Jednak w celu miareczkowania słabego kwasu pH w punkcie równoważności jest większe niż 7,0, dlatego należy zastosować wskaźnik, taki jak fenoloftaleina lub błękit tymolowy, z pKin > 7,0. I odwrotnie, dla miareczkowania słabej zasady, gdzie pH w punkcie równoważności jest mniejsze niż 7,0, należy zastosować wskaźnik, taki jak czerwień metylowa lub błękit bromokrezolowy, z pKin < 7,0.
przykład \(\PageIndex{1}\)
w miareczkowaniu słabego kwasu z mocną zasadą, który wskaźnik byłby najlepszym wyborem?,
- Methyl Orange
- Bromokrezol Green
- Phenolphtalein
roztwór
prawidłową odpowiedzią jest C. W miareczkowaniu słabego kwasu z mocną zasadą koniugowana zasada słabego kwasu sprawi, że pH w punkcie równoważności będzie większe niż 7. Dlatego chcesz, aby wskaźnik zmienił się w tym zakresie pH. Zarówno pomarańczowy metylowy, jak i zielony bromokrezol zmieniają kolor w kwaśnym zakresie pH, podczas gdy fenoloftaleina zmienia zasadowe pH.,
istnienie wielu różnych wskaźników o różnych kolorach i wartościach pKin zapewnia również wygodny sposób oszacowania pH roztworu bez użycia drogiego elektronicznego miernika pH i delikatnej elektrody pH. Papierowe lub plastikowe paski impregnowane kombinacjami wskaźników są używane jako „papier pH”, który pozwala oszacować pH roztworu przez zwykłe zanurzenie w nim kawałka papieru pH i porównanie uzyskanego koloru ze standardami wydrukowanymi na pojemniku(rysunek \(\PageIndex{4}\)).,
podsumowanie
wskaźniki kwasowo–zasadowe to związki, które zmieniają kolor przy określonym pH., Są to zazwyczaj słabe kwasy lub zasady, których zmiany barwy odpowiadają deprotonacji lub protonacji samego wskaźnika.
współautorzy i atrybuty
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) i Richard Langley (Stephen F. Austin State University). Zawartość podręczników wyprodukowanych przez OpenStax College jest licencjonowana na licencji Creative Commons Attribution License 4.0 license. Pobierz za darmo na http://cnx.org/contents/85abf193-2bd…[email protected]).
- {szablon.,Contriboundless ()}}















