Frontiers in Plant Science (Polski)
wprowadzenie
prawidłowy postęp dojrzewania owoców jest niezbędny do osiągnięcia zarówno optymalnej jakości owoców, jak i długiego okresu przydatności do spożycia, ważnych cech, które determinują rynki cenowe i zyski końcowe. Jednak dojrzewanie jest złożonym procesem, w którym bierze udział wiele czynników, w tym kontrola hormonalna, która reguluje zmiany biochemiczne i fizjologiczne, które dają ostateczne właściwości organoleptyczne i odżywcze owoców., Tradycyjnie mięsiste owoce klasyfikowane są w zależności od procesu dojrzewania na owoce klimakteryjne i nie klimakteryjne. Owoce klimatyczne, takie jak pomidory lub banany, wymagają wzrostu tempa oddychania i produkcji etylenu, aby uwolnić proces dojrzewania w reakcji autokatalitycznej (Barry and Giovannoni, 2007; Liu et al., 2015)., Antagonistycznie, nie klimakteryjne owoce, takie jak owoce cytrusowe lub winogrona, nie wykazują pęknięcia ani w etylenu, ani w oddychaniu przed początkiem dojrzewania, a w tych owocach dojrzewanie jest głównie kontrolowane przez stopniowe gromadzenie się kwasu abscysynowego fitohormonu (Aba; Rodrigo et al., 2006; Castellarin et al., 2011). Niemniej jednak nowe badania wzmacniają pogląd, że proces dojrzewania jest nie tylko regulowany przez produkcję jednego fitohormonu, ale raczej wydaje się być wynikiem kontrolowanej równowagi hormonalnej (Symons et al., 2012; Teribia et al., 2016; Li i in., 2019).,
auksyny, kwas salicylowy (SA) i melatonina są fitohormonami biorącymi udział w sygnalizacji i regulacji wielu kluczowych procesów w roślinach. Auksyny zostały szeroko opisane jako regulatory wzrostu i rozwoju z wieloma funkcjami w roślinach (patrz Taylor-Teeples et al., 2016); SA wyzwala odpowiedź obronną przed biotroficznymi i hemi-biotroficznymi patogenami (Loake and Grant, 2007), a także odgrywa ważną rolę w stresie abiotycznym (Dong et al., 2014; Wani i in., 2017), flowering and cell cycle control (Carswell et al., 1989; Eberhard et al.,, 1989, odpowiednio); a melatonina nie tylko stwierdzono, że ma funkcje podobne do auksyny (Chen et al., 2009; Zuo i in., 2014; Wen et al., 2016), ale zasugerowano również, aby działać jako potencjalny przeciwutleniacz w niektórych roślinach (Arnao and Hernández-Ruiz, 2015) i regulator odpowiedzi roślin na patogeny (Chen et al., 2018). Co ciekawe, te trzy hormony mają wspólnego prekursora-chorismate -, w związku z czym zachodzi między nimi krzyżowa rozmowa metaboliczna, a wiele genów musi być precyzyjnie regulowanych, aby odwrócić metabolizm chorismate w kierunku tych związków., W ciągu ostatnich kilku lat, kilka recenzji dotyczyły biosyntezy i roli auksyny (Paul et al.,2012), SA (Asghari and Aghdam, 2010) i melatonina (Feng et al., 2014; Arnao i Hernández-Ruiz, 2018) w owocach. Jednak ich biosynteza i funkcje zostały w większości opisane osobno. Omówimy wspólne i zróżnicowane aspekty biosyntezy, metabolizmu i funkcji auksyny, SA i melatoniny we wzroście i dojrzewaniu owoców klimakteryjnych i nie klimakteryjnych., Nacisk zostanie położony na kluczowe punkty przemiany materii w ich biosyntezie od chorismate, rolę regulacyjną podczas dojrzewania owoców klimakteryjnych i nie klimakteryjnych oraz ich rolę w modulacji biosyntezy związków bioaktywnych, która w dużej mierze determinuje jakość owoców.
fitohormony pochodzące od Chorismate
Chorismate jest końcowym produktem szlaku shikimate i odgrywa kluczową rolę w biosyntezie fitohormonów (ryc. 1)., Chorismate powoduje powstawanie aminokwasów aromatycznych, w tym tryptofanu, i poprzez kilka reakcji, w tym przemianę tryptofanu do kwasu indol-3-pirogronowego przez aminotransferazę tryptofanową (TA); może generować kwas auksyny indol-3-octowy (IAA). TA została zaproponowana jako uniwersalny kluczowy enzym do biosyntezy IAA nie tylko w organach wegetatywnych (Enríquez-Valencia et al., 2018), ale także w rozwoju narządów rozrodczych (Reyes-Olalde et al., 2017), w tym wzrost i dojrzewanie owoców (Estrada-Johnson et al., 2017)., Natomiast, gdy aktywowana jest syntaza izochorymatu (ICS), chorismate może zostać przekształcony w izochorymat, a ten ostatni może zostać przekształcony w SA. Pomimo faktu, że droga ta została po raz pierwszy zidentyfikowana w bakteriach, jest również obecnie dobrze ugruntowana w roślinach (Wildermuth et al., 2001; Uppalapati et al., 2007; Catinot et al., 2008;, 2008; Abreu i Munné-Bosch, 2009). W końcu tryptofan może przekształcić się w tryptaminę przez enzym dekarboksylazę tryptofanu (TDC)., Chociaż jest to kolejna z wielu dróg biosyntezy IAA (tryptamina zamienia się w indolo-3-acetaldehyd, a później w IAA), TDC zaproponowano również jako pierwszy enzym ograniczający szybkość w szlaku melatoniny (Kang et al., 2007). TDC został po raz pierwszy zidentyfikowany w rodzinie Apocynaceae (De Luca et al., 1989), które zostaną później opisane w wielu systemach roślinnych (Byeon et al., 2012, 2014; Zhao et al., 2013; Wei et al., 2018)., Po dekarboksylacji tryptamina jest przekształcana w serotoninę przez tryptaminę-5-hydroksylazę, a następnie serotonina przekształca się w N-acetylo-serotoninę, aby ostatecznie uzyskać melatoninę w cytozolu (ryc. 1).
Rysunek 1. Biosynteza kwasu indolo-3-octowego( IAA), kwasu salicylowego (SA) i melatoniny (Mel) z chorismate. Wszystkie trzy związki mają wspólny końcowy prekursor (chorismate, kwadratowy w kolorze pomarańczowym) ze szlaku shikimate., Główne punkty dywersji są oznaczone czerwonymi strzałkami, a odpowiednie enzymy są numerowane w kolejności dywersji zejścia z shikimate. Pogrubione przerywane strzałki wskazują więcej niż jeden krok między związkami. Cienkie przerywane strzałki wskazują ścieżki, które nadal nie są dobrze zdefiniowane.
enzymy prowadzące do syntezy hormonów szlaku chorismate zostały niedawno zidentyfikowane w mięsistych owocach (ryc. 1). ICS, których ekspresja okazała się kluczowa dla tolerancji stresu biotycznego (Garcion et al.,, 2008; Zeng i On, 2010), został zidentyfikowany w pomidorach i jabłkach. Zhu i in. (2016) odnotowano nadekspresję ICS1 (syntazy izochorismate 1) w warunkach chłodniczych w pomidorach, podczas gdy Zhang et al. (2017) odkrył aktywację czynnika transkrypcyjnego zaangażowanego w związany z patogenem szlak sygnałowy SA indukujący ekspresję ICS w jabłkach. Zwiększoną aktywność TDC odnotowano w niedojrzałych owocach pieprzu po zakażeniu przez patogeny – poprzez zwiększoną ekspresję TDC1 i TDC2 (Park et al., 2013) – oraz na etapie wzrostu owoców morwy (Wang et al., 2016)., Wreszcie, TA została zidentyfikowana w winorośli, zarówno w pre – i véraison (Böttcher et al., 2013; Gouthu i Deluc, odpowiednio, 2015), a także podczas dojrzewania truskawek (Estrada-Johnson et al., 2017). Warto jednak zauważyć, że geny i enzymy opisane w owocach klimakterycznych (tj. ICS) nie zostały zidentyfikowane w owocach nie klimakterycznych (TDC i TA) i vice versa; dlatego konieczne są dalsze badania, aby wypełnić te luki wiedzy i lepiej zrozumieć, w jaki sposób te punkty dywersyfikacji są wspólnie regulowane podczas dojrzewania owoców.,
rola fitohormonów pochodzenia Chorismate w owocach klimakterycznych i nie klimakterycznych
rozwikłanie mechanizmów rozwoju owoców jest jednym z głównych wyzwań w ostatnich badaniach agronomii pod względem ich ekonomicznych implikacji. W tym kontekście wskazano fitohormony jako odpowiedzialne czynniki dojrzewania owoców, szczególnie etylen i ABA odpowiednio w owocach klimakteryjnych i nie klimakteryjnych. Jednak, że te fitohormony mogą samodzielnie regulować rozwój owoców, wkrótce okazało się zbyt proste., Po szeroko zakrojonych badaniach i udoskonaleniu chemii analitycznej i technik molekularnych potwierdzono kilka innych hormonów jako potencjalnych regulatorów rozwoju i dojrzewania owoców, w tym fitohormony pochodzące z chorismate.
auksyny krzyżują się z innymi hormonami podczas ustawiania, wzrostu i dojrzewania owoców
auksyny to grupa hormonów roślinnych, które odgrywają zasadniczą rolę w rozwoju owoców, wywierając zarówno własny wpływ, jak i modulując ekspresję innych fitohormonów., Endogenna zawartość IAA jest szczególnie wysoka w zestawie owoców i podczas początkowych stadiów rozwojowych wzrostu, po których ilości IAA mają tendencję do zmniejszania się przed początkiem dojrzewania, zarówno w klimakterycznym (Zaharah et al., 2012) i owoce nie klimakteryjne (Symons et al., 2012; Teribia et al., 2016), z widocznymi wyjątkami, takimi jak brzoskwinie (Tatsuki et al., 2013) oraz niektóre odmiany śliw (El-Sharkawy et al., 2014; rys. 2A). Wykazano, że IAA bierze udział w inicjacji zestawu owoców w połączeniu z giberelinami (Mezzetti et al., 2004; Serrani et al., 2010; Bermejo et al., 2018; Hu i in.,, 2018). Zaburzenie biosyntezy lub sygnalizacji IAA zazwyczaj prowadzi do partenokarpii owoców, chociaż może również prowadzić do nieprawidłowego dojrzewania niektórych owoców (Wang et al., 2005; Liu J. et al., 2018; Reig et al., 2018). Wysoka zawartość IAA w początkowych fazach rozwoju owoców sprzyja wzrostowi owoców ze względu na udział auksyny w podziale komórek w połączeniu z cytokininami oraz w kontroli ekspansji komórek w połączeniu z giberelinami (Liao et al., 2018)., W tym okresie hormonalne przesłuchy między auksynami i giberelinami dodatkowo umożliwiają normalne kształtowanie owoców w precyzyjnie dostrojonej regulacji za pośrednictwem czynników odpowiedzi Auksynowej(ARFs; Liao et al., 2018; Liu S. et al., 2018).
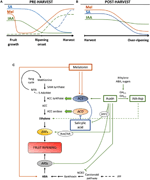
Rysunek 2. Rola IAA, SA i Mel w rozwoju owoców klimakteryjnych i nie klimakteryjnych. Model podsumowujący interakcje IAA, SA i Mel podczas dojrzewania owoców klimakteryjnych i nie klimakteryjnych podczas (a) przed i (B) po zbiorach., Przerywane linie wskazują alternatywną dynamikę zawartości fitohormonów w niektórych owocach (patrz tekst do dyskusji). C) przegląd interakcji IAA, SA i Mel z biosyntezą etylenu i kwasu abscysynowego (ABA) w owocach klimakteryjnych i nie klimakteryjnych. Auksyna jest pozytywnym regulatorem biosyntezy etylenu poprzez aktywację genów syntazy ACC (ACS) i indukowanie ekspresji czynników reagujących na etylen (ERFs). Auksyna hamuje również produkcję ABA przez represję 9-cis-epoksykarotenoidową dioksygenazę (NCED) i hamowanie genów stresowych reagujących na aba (ARS) przez białko ARF2., Endogenna zawartość IAA może być zmniejszona przez białka GH3, których synteza jest promowana przez etylen, ABA i cukry. Linia nieciągła wskazuje możliwą rolę IAA przez IAA-Asp jako czynnika dojrzewania wzmacniającego etylen w niektórych owocach. Melatonina zwiększa produkcję ABA i etylenu, chociaż ACS może być hamowany w zależności od zawartości melatoniny. SA działa jako inhibitor etylenu tłumiącego oksydazę ACC (Aco) genów, chociaż może promować ekspresję ACS., MTA, 50-metylotioadenozyna; s-AdoMet, S-adenozylo-metionina; syntaza SAM, syntaza S-adenozylo-metionina; ACC, kwas 1-aminocyklopropano-1-karboksylowy; IPP, difosforan izopentenylu.
zmniejszenie zawartości endogennego IAA odnotowano przed rozpoczęciem dojrzewania w kilku owocach. Redukcje te były związane z koniugacją IAA z kwasem asparaginowym (IAA-Asp) przez syntetazy IAA-amido, GH3-1 i GH3-2 (ryc. 2C)., Rzeczywiście, GH3 – 1 i GH3-2 wykazały wyższą ekspresję podczas wczesnego rozwoju owoców, a zwłaszcza podczas inicjacji dojrzewania zarówno w owocach klimatycznych, takich jak pomidory (Sravankumar et al., 2018) i jabłka (Onik et al., 2018), a także w owocach nieklimakteryjnych, takich jak jagody winogron (Böttcher et al., 2010, 2011) i maliny (Bernales et al., 2019)., Co ciekawe, jagody winogron wykazały zwiększoną ekspresję GH3-1 po zastosowaniu ABA i etefonu, co może wyjaśniać udział etylenu w kontroli zawartości IAA po rozpoczęciu dojrzewania, nawet w owocach nie klimakteryjnych (Böttcher et al., 2010). W rzeczywistości kilka badań podkreśla ścisłą interakcję między auksyny i etylenu w dojrzewaniu owoców, z wzajemnym wpływem między nimi (Tadiello et al., 2016a; Busatto et al., 2017)., W przypadku owoców klimakterycznych zwiększona zawartość IAA jest konieczna do aktywacji ekspresji genów syntazy ACC (ACS), kodujących syntazę ACC, co z kolei doprowadzi do produkcji etylenu wywołującej proces dojrzewania (rysunek 2C; Tatsuki et al., 2013). Owoce jak pomidory (Li et al., 2016) lub banany (Choudhury et al.,, 2008), które zwykle doświadczają zmniejszonej zawartości IAA przed początkiem dojrzewania, wykazują opóźnienie dojrzewania, gdy IAA lub analogi są egzogennie stosowane, podczas gdy owoce takie jak brzoskwinie, których zawartość IAA wzrasta stopniowo, aż do pełnego dojrzenia, wykazują przyspieszone dojrzewanie, gdy stosowane są auksyny (Tadiello et al., 2016b). Dlatego też ścisła, złożona i zróżnicowana Regulacja oddziaływań auksyny i etylenu musi istnieć w różnych owocach podczas dojrzewania przedharwestu., Ponadto zawartość IAA zmniejsza się przed początkiem dojrzewania w niektórych owocach nieeklimakteryjnych, aby odeprzeć dioksygenazę 9-cis-epoksykarotenoidową (NCED) i rozpocząć syntezę ABA (rysunek 2C; Jia et al., 2016). Co ciekawe, proces ten jest również pośredniczony przez koniugację IAA poprzez zwiększoną aktywność GH3-1 (Böttcher et al., 2010). Niemniej jednak, Estrada-Johnson et al. (2017) wykazał, że chociaż zawartość IAA zmniejsza się podczas dojrzewania truskawek, ekspresja rodzin genów FaAux/IAA I FaARF jest indukowana w czerwonych pojemnikach, co sugeruje udział sygnalizacji auksyny w w pełni dojrzewających owocach.,
po zbiorze zawartość auksyny zwykle pozostaje niezmienna lub ma tendencję do zmniejszania się z powodu procesów oksydacyjnych, które mogą prowadzić do niewielkiego, ale postępującego zmniejszenia zawartości endogennej IAA (ryc. 2b). Zabiegi auksyny po zbiorach opóźniają dojrzewanie niektórych owoców (Chen et al., 2016; Moro et al., 2017) i zwiększyć zawartość niektórych kwasów organicznych, utrzymując kwasowość owoców (Li et al., 2017), co sugeruje, że auksyna odgrywa również znaczącą rolę w kontroli dojrzewania owoców podczas zbiorów.,
wiele ról kwasu salicylowego podczas rozwoju i dojrzewania owoców
kwas salicylowy jest innym fitohormonem pochodzącym z chorismate, który był głównie związany z jego działaniem ochronnym pod wpływem stresu biotycznego w celu kontrolowania strat przed najazdem i po zbiorach pochodzących z infekcji owoców patogenu (Babalar et al., 2007; Cao i in., 2013). Ogólnie rzecz biorąc, zawartość endogenna wolnych SA jest wyższa na początku rozwoju owoców, a następnie stopniowo zmniejsza się (Oikawa et al., 2015). Lu i in. (2015) odnotowano wtórny wzrost SA podczas drugiej fazy wzrostu owoców brzoskwini., Egzogenne zastosowanie SA w bananach opóźniło proces dojrzewania, zmniejszając wybuch oddechowy i stosunek miąższu do skórki, a także zmniejszając aktywność enzymów związanych z degradacją ściany komórkowej i układem przeciwutleniającym (Srivastava i Dvivedi, 2000). Ponadto leczenie drzew czereśni z kwasem salicylowym i acetylosalicylowym (Asa) zwiększyło wagę, jędrność i kolor wiśni na etapie komercyjnym (Giménez et al., 2014). Egzogenne zastosowanie SA lub salicylanu metylu (Mesa) podczas po zbiorach, opóźnione dojrzewanie w owocach takich jak kiwi (Zhang et al.,, 2003), oraz czereśnie (Valero et al., 2011). Ponadto zabiegi z salicylowym lub ASA łagodzą uraz chłodzenia granatów (Sayyari et al., 2011), pomidory (Aghdam et al., 2014) oraz awokado (Glowacz i in., 2017). SA również oddziałuje z etylenem poprzez hamowanie ekspresji oksydazy ACC (Aco) (Shi and Zhang, 2012). Co zaskakujące, zwiększona zawartość ekspresji ACS w gruszkach występuje również po zastosowaniu SA w sposób regulowany dawką (Shi et al., 2013; Shi and Zhang, 2014). Dlatego regulacja produkcji etylenu zależna od SA jest precyzyjnie regulowana (rys. 2C).,
Melatonina: wschodzący Regulator kontroli rozwoju owoców
Melatonina jest również hormonem roślinnym ze szlaku pochodnego chorismate, który zyskał wiele uwagi w ostatnich latach (Hernández-Ruiz et al., 2005; Arnao and Hernández-Ruiz, 2018; Sharif et al., 2018). Ostatnio Melatonina została wskazana jako ważny czynnik dla zestawu owoców, w podobny sposób do efektów IAA (rysunek 2A; Liu S. et al., 2018). Poza tym zaobserwowano dobową produkcję tego fitohormonu (Kolář et al., 1997)., Podczas dojrzewania na drzewie winogrona potraktowane melatoniną wykazywały wyższą synchroniczność i zwiększoną wagę, gdy w pełni dojrzeją (Meng et al., 2015). Co więcej, inne ostatnie badanie przeprowadzone przez Xu et al. (2018) opisał, że melatonina może promować dojrzewanie jagód winogronowych poprzez interakcję z ABA i etylenem, a także nadtlenkiem wodoru. Wykazano, że melatonina nadaje tolerancję chłodzenia podczas przechowywania owoców w chłodni, co wydaje się być głównie związane z jego działaniem przeciwutleniającym (Cao et al., 2018; Aghdam et al., 2019)., Podczas po zbiorach pomidory wykazały zwiększoną emisję etylenu po zastosowaniu melatoniny przy 50 µM (Sun et al., 2015), w przeciwieństwie do gruszek, gdzie egzogenne zastosowanie melatoniny w 100 µM hamowało produkcję etylenu (Zhai et al., 2018), lub owoców bananów, gdzie melatonina w 50-200 µM hamowała ekspresję ACS i ACO (rysunek 2C; Hu et al., 2017). Chociaż różne efekty stosowania melatoniny mogą być związane z efektem dawkowania, potrzebne są dalsze badania, aby lepiej zrozumieć rolę melatoniny w kontroli rozwoju owoców.,
wykazano, że podczas rozwoju i dojrzewania owoców występuje krzyżowanie fitohormonów pochodzenia chorismate w kontrolowaniu rozwoju owoców
hormonalne przesłuchy między fitohormonami pochodzenia chorismate. Breitel et al. (2016) stwierdzono, że auksyny mogą wchodzić w interakcje z SA poprzez ARF2 (rysunek 2C) i że nadmierna ekspresja ARF2 w pomidorach spowodowała niższą zawartość SA i znaczne opóźnienie dojrzewania., Wskazuje to, że auksyny mogą ograniczać produkcję SA podczas rozwoju owoców, co może wyjaśniać kompromis między wzrostem owoców (za pośrednictwem auksyny) a aktywacją biotycznych mechanizmów obronnych (za pośrednictwem SA). Co więcej, egzogenne zastosowanie SA na owocach papai spowodowało zmianę ekspresji kilku genów IAA, niektóre z nich są regulowane w dół, podczas gdy inne regulowane w górę (Liu et al., 2017)., W tym przypadku wyniki nie były jednoznaczne z tym, co naprawdę występuje endogennie w domniemanej rozmowie krzyżowej między auksyną i SA podczas dojrzewania owoców i wymagane są dalsze badania w tym i innych owocach klimakteryjnych. W każdym razie oczywiste jest, że IAA I SA są ze sobą ściśle powiązane, nie tylko metabolicznie, ale także funkcjonalnie. Wreszcie, kilka badań donosiło o wpływie melatoniny na biosyntezę IAA I SA i/lub sygnalizację (recenzowane w Arnao i Hernández-Ruiz, 2018), chociaż według naszej wiedzy, żadne z tych badań nie zostało przeprowadzone ani w klimakteryjnych, ani nie klimakteryjnych owocach.,
Modulacja biosyntezy związków bioaktywnych przez fitohormony pochodne Chorismate
związki bioaktywne (w tym związki fenolowe, izoprenoidy i witaminy przeciwutleniające) były szeroko badane nie tylko jako odpowiedzialne za specyficzne właściwości organoleptyczne żywności, ale także za ich działanie ochronne w komórkach ludzkich przed procesami oksydacyjnymi w rozwoju chorób neurodegeneracyjnych i sercowo-naczyniowych oraz niektórych rodzajów raka (Liu et al., 1999; Mueller i in., 2010; Sturgeon and Ronnenberg, 2010; Björkman et al., 2011)., Związki fenolowe znacząco przyczyniają się do nadania określonych smaków, takich jak garbniki-odpowiedzialne za gorycz lub cierpkość smaku niektórych owoców, oraz kolory, takie jak pigmenty antocyjanowe-odpowiedzialne za czerwone, niebieskie i fioletowe kolory owoców (Croteau et al., 2000). Znaczenie związków fenolowych dla spożycia przez ludzi jest związane z działaniem ochronnym przed procesami oksydacyjnymi w odniesieniu do zdrowia układu sercowo-naczyniowego i ośrodkowego układu nerwowego ,a także zmniejszonym ryzykiem zachorowania na nowotwory przewodu pokarmowego (Björkman et al., 2011)., Karotenoidy, tetraterpeny należące do izoprenoidów, odgrywają rolę w ochronie przed procesami fotooksydacyjnymi i jako pigmenty organiczne; są odpowiedzialne za Pomarańczowo-żółty kolor owoców (Tapiero et al., 2004). Uważa się, że karotenoidy dietetyczne zapewniają korzyści zdrowotne w zmniejszaniu ryzyka chorób oczu i niektórych rodzajów nowotworów ze względu na ich rolę jako przeciwutleniaczy (Johnson, 2002). Witaminy C i E, w tym kwas askorbinowy i tokoferole, odpowiednio, są niezbędnymi czynnikami jakości odżywczej w owocach o wielu aktywnościach biologicznych u ludzi (Miret and Müller, 2017)., Biorąc pod uwagę istotną rolę wszystkich tych związków bioaktywnych jako związków promujących zdrowie w owocach, modulacja ich akumulacji ma ogromne znaczenie zarówno w owocach klimakteryjnych, jak i nie klimakteryjnych (Vasconsuelo i Boland, 2007). Większość tych związków bioaktywnych gromadzi się na wysokim poziomie podczas dojrzewania owoców, gdy mniej smaczne zielone owoce zamieniają się w bogate w składniki odżywcze, kolorowe i smaczne owoce (Daood et al., 1996; Ranalli et al., 1998; Dumas i in., 2003; Singh et al., 2011)., Jednak po rozpoczęciu dojrzewania nie można zatrzymać i ogólnie prowadzi do nadmiernego dojrzewania, które negatywnie wpływa na jakość owoców (Kumar et al., 2014). Dlatego minimalizacja psucia się owoców po zbiorze przy jednoczesnym uzyskaniu wysokiej zawartości związków bioaktywnych pozostaje jednym z największych wyzwań do rozwiązania.
Auksyna została zidentyfikowana jako ważny regulator biosyntezy karotenoidów podczas dojrzewania klimatycznych owoców pomidora. Dojrzewanie w pomidorach wiąże się z degradacją chlorofilu i przesunięciem ksantofilów do karotenów (β-karoten i likopen) (Fraser et al., 1994)., Wydaje się, że IAA opóźnia dojrzewanie pomidorów poprzez tłumienie etylenu i kilku wcześniejszych transkryptów karotenoidowych, w tym Psy, Ziso, Pds, Critiso, a także Chlaz 1-3, A z drugiej strony, promowanie gromadzenia transkryptów β-Lyc1 i Crtr-β1, co powoduje wyższą zawartość ksantofilów i chlorofilu a (Su et al., 2015). Ponadto w niektórych Nie klimakteryjnych owocach, takich jak jagody wiśni i winogron, auksyna również wydaje się modulować biosyntezę antocyjanów, a tym samym kontrolować procesy dojrzewania owoców. Teribia et al., (2016) odnotowano ujemną korelację między zawartością IAA i antocyjanów, wskazując, że akumulacja antocyjanów rozpoczyna się, gdy zawartość IAA spada. Ponadto zastosowanie syntetycznego związku auksyn-podobnego do kwasu benzotiazolo-2-oksyoctowego (BTOA) opóźniło regulację w górę genów, które promują enzymy biosyntezy antocyjanów, takie jak syntaza chalkonowa i UDP-glukoza:flawonoidowa 3-o-glukozylotransferaza w jagodach winogron (Davies et al., 1997).,
przed i po zbiorach zabiegi z salicylanami, w tym SA i jego pochodnymi ASA i MeSA, donoszono o regulowaniu akumulacji związków bioaktywnych, co prowadzi do poprawy aktywności przeciwutleniającej zarówno w owocach klimakteryjnych, jak i nie klimakteryjnych. Wiadomo, że kilka owoców, takich jak śliwki, wiśnie i morele, ma krótki okres życia z szybkim pogorszeniem jakości po zbiorach. Dlatego nieustannie poszukuje się zabiegów poprawiających i utrzymujących jakość owoców, a zwłaszcza zawartości związków bioaktywnych o korzystnym wpływie na zdrowie., Obróbka śliwek za pomocą SA, ASA i MeSA spowodowała znaczne zwiększenie zawartości kwasu askorbinowego, antocyjanów i związków fenolowych zarówno podczas zbioru, jak i po przedłużonym przechowywaniu w chłodni (40 dni w temperaturze 4°C; Martínez-Esplá et al., 2017). Podobne wyniki można zaobserwować w przypadku leczenia preharvest z SA, ASA i MeSA w czereśni (Giménez et al., 2014, 2015, 2017). Ponadto obróbka po zbiorze SA, ASA lub Mesa utrzymywała całkowitą zawartość fenoli, a także zawartość antocyjanów podczas przechowywania w chłodni w granacie (Sayyari et al., 2011), czereśnia (Valero et al.,, 2011), cornelian cherry (Dokhanieh et al., 2013), oraz morela (Wang et al., 2015). Wyniki te sugerują, że salicylany mogą brać udział w aktywacji liazy amoniakalnej fenyloalaniny, która jest głównym enzymem biorącym udział w szlaku biosyntetycznym związków fenolowych (Martínez-Esplá et al., 2017).
Ostatnio wykazano, że melatonina reguluje dojrzewanie owoców i moduluje związki bioaktywne. Zabiegi po zbiorach z melatoniną w owocach brzoskwini zwiększyły tolerancję chłodzenia poprzez aktywację systemów antyoksydacyjnych., Uraz chłodniczy występuje u owoców brzoskwini podczas przechowywania w niskiej temperaturze (od 2 do 7,6°C), charakteryzujących się brązowieniem miąższu, nieprawidłowym dojrzewaniem i większą wrażliwością na rozkład (Lurie and Crisosto, 2005). Cao i in. (2018) poinformował, że brzoskwinie leczone melatoniną wykazywały większą obfitość transkrypcji genów biosyntezy kwasu askorbinowego PpGME, PpGPP i PpGLDH w siódmym i PpGMPH w 21 i 28 dniu przechowywania w porównaniu do kontroli, co skutkowało zwiększoną zawartością kwasu askorbinowego., Ponadto Melatonina wywołała wzrost aktywności G6PDH, SKDH i PAL, które są niezbędnymi enzymami do biosyntezy związków fenolowych. Autorzy sugerują, że leczenie melatoniną chroni owoce brzoskwini w pewnym stopniu przed chłodnym urazem, szczególnie aktywując biosyntezę związków fenolowych (Gao et al., 2018). Dodatkowo, analiza różnicowa proteomiki wolna od etykiet ujawniła wpływ melatoniny na promowanie dojrzewania owoców i akumulacji antocyjanów po zbiorach w owocach pomidora (Sun et al., 2016)., Autorzy donosili, że egzogenna Melatonina zwiększała aktywność ośmiu enzymów związanych ze szlakiem antocyjaninowym, w tym między innymi flawonol-3-hydroksylazy, flawonon 3-beta-hydroksylazy, syntazy antocyjanidyn/dioksygenazy leucoantocyjanidyn i antocyjanidyn 3-o-glukozylotransferazy. Ponadto po zbiorze leczenie melatoniną zwiększyło całkowite fenole i antocyjany w owocach truskawek (Aghdam and Fard, 2016) oraz opóźniło utratę całkowitych fenoli, flawonoidów i antocyjanów w owocach liczi (Zhang et al., 2018)., Zabiegi z melatoniną zwiększyły zawartość fenoli, antocyjanów i flawonoidów w jagodach winogron (Xu et al., 2017). Dodatkowo Melatonina donoszono, że zwiększa akumulację likopenu i produkcję etylenu w pomidorach, co sugeruje, że melatonina może zwiększać zawartość likopenu poprzez wpływanie na biosyntezę etylenu i sygnalizację (Sun et al., 2015)., Udział etylenu w indukowanej melatoniną regulacji związków bioaktywnych zaobserwowano również w jagodach winogron, gdzie obróbka z podwójnym blokiem etylenu wykazała zmniejszony wpływ melatoniny na zawartość polifenoli (Xu et al., 2017).
wnioski
stwierdza się, że fitohormony pochodzące z chorismatu, w tym auksyna, SA i melatonina, nie tylko mają wspólny prekursor, ale odgrywają istotną rolę w regulacji wzrostu i dojrzewania owoców., Metaboliczna i funkcjonalna rozmowa krzyżowa między nimi a innymi fitohormonami występuje w sposób przestrzenno-ustrojowy, aby precyzyjnie regulować rozwój owoców klimakteryjnych i nie klimakteryjnych. Różnice w dynamice w owocach klimakteryjnych i nie klimakteryjnych dowodzą, że reakcja hormonów pochodnych chorismate nie jest uniwersalna, ale raczej silnie specyficzna gatunkowo. Ponadto fitohormony pochodzące z chorismatu modulują gromadzenie się związków bioaktywnych, wpływając w ten sposób na jakość owoców., Dalsze badania są jednak potrzebne, aby lepiej zrozumieć, w jaki sposób (i) inne hormony, takie jak etylen i ABA, modulują swoją biosyntezę badając kluczowe punkty dywersji metabolicznej, (ii) wchodzą w interakcje na poziomie funkcjonalnym i molekularnym, oraz (iii) wspólnie modulują biosyntezę związków bioaktywnych i w konsekwencji wpływają nie tylko na wzrost i dojrzewanie owoców, ale także na jakość owoców klimakteryjnych i nie klimakteryjnych.
wkład autora
SM-B wymyślił i zaprojektował Recenzję z pomocą MP-L. MP-L, PM, MM i SM-B napisali rękopis., MP-L przygotowało figury przy pomocy PM. Wszyscy autorzy przyczynili się do dyskusji nad pomysłami, poprawili i zatwierdzili końcowy rękopis.
finansowanie
praca ta została sfinansowana przez ICREA Academia award przyznaną SM-B przez rząd kataloński.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone w przypadku braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
, Preferencje substratu acylowego syntetazy IAA-amido uwzględniają zmiany w dojrzewaniu jagód winogron (Vitis vinifera L.) spowodowane przez różne związki auksyny, wskazujące na znaczenie koniugacji auksyny w rozwoju roślin. J. Exp. Bot. 62, 4267–4280. doi: 10.1093 / jxb / err134
PubMed Abstract | CrossRef Full Text | Google Scholar
Glowacz, M., Bill, M., Tinyane, P. P., and Sivakumar, D. (2017)., Utrzymanie najwyższej jakości przechowywanych na zimno awokado „Hass” poprzez zmianę zawartości i składu kwasów tłuszczowych z wykorzystaniem naturalnych lotnych związków-jasmonianu metylu i salicylanu metylu. J. Sci. Jedzenie. Agric. 97, 5186–5193. podoba mi się! do obserwowanych nr: 710028400
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, W., and He, S. Y. (2010). Znacząca rola receptora flagellinowego FLAGELLIN-SENSING2 w mediacji odpowiedzi stomatologicznej na Pseudomonas syringae pv tomato DC3000 u Arabidopsis. Physiol Roślin. 153, 1188–1198. podoba mi się! do obserwowanych nr: 101104,157016
PubMed Abstract | CrossRef Full Text | Google Scholar















