17.3: Syre-Base Indikatorer
læringsmål
- Forklare, funktion og farve ændringer i syre-base-indikatorer
- Demonstrere, hvordan at vælge den rigtige indikator for en titrering eksperiment
- Bestemme sure dissociation konstanter Ka eller Kai af indikatorer.
visse organiske stoffer ændrer farve i fortyndet opløsning, når hydroniumionkoncentrationen når en bestemt værdi., For eksempel, phenolphthalein er en farveløs substans i enhver vandig opløsning med et hydronium ion-koncentration større end 5,0 × 10-9 M (pH < 8.3). I mere grundlæggende løsninger, hvor hydronium ion koncentration er mindre end 5,0 × 10-9 M (pH > 8.3), det er rød eller pink. Stoffer som phenolphthalein, som kan bruges til at bestemme pH i en opløsning, kaldes syre-base indikatorer. Syre – base indikatorer er enten svage organiske syrer eller svage organiske baser.,
ligevægt i en opløsning af syre-base-indikator methyl orange, en svag syre, kan være repræsenteret ved en ligning, som vi bruger HIn som en simpel repræsentation af de komplekse methyl orange molekyle:
\
\}{}}=4.0×10^{-4}\]
anion af methyl orange, I, gul, og nonionized form, HIn, er rød. Når vi tilsætter syre til en opløsning af methylorange, skifter den forøgede hydroniumionkoncentration ligevægten mod den ikke-ioniserede røde form i overensstemmelse med Le Chateliers princip. Hvis vi tilføjer base, skifter vi ligevægten mod den gule form., Denne adfærd er fuldstændig analog med virkningen af buffere.
en indikators farve er det synlige resultat af forholdet mellem koncentrationerne af de to arter i− og HIn. 60-90% eller mere) er til stede som i−, så ser vi farven på in− ion, som ville være gul for methylorange. Hvis de fleste er til stede som HIn, så ser vi farven på hin-molekylet: rødt for methylorange., For methyl orange, vi kan flytte rundt på ligningen for Ka og skriv:
\}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}\]
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\eller\:pH=p\mathit{K}_a+log\left(\dfrac{}{}\right)}\]
Den sidste formel er den samme, som den Henderson-Hasselbalch-ligningen, som kan bruges til at beskrive den ligevægt af indikatorer.,
Hvornår har den samme numeriske værdi som Ka, er forholdet mellem to lig med 1, hvilket betyder, at 50% af indikatoren er til stede i den røde form (HIn) og 50% er i den gule ioniske form (In−), og opløsningen vises orange i farve. Når hydroniumionkoncentrationen stiger til 8 10 10-4 M (en pH på 3,1), bliver opløsningen rød. Ingen farveændring er synlig for yderligere stigning i hydroniumionkoncentrationen (fald i pH). Ved en hydroniumionkoncentration på 4 10 10-5 M (en pH på 4.,4), er det meste af indikatoren i den gule ionform, og et yderligere fald i hydroniumionkoncentrationen (stigning i pH) frembringer ikke en synlig farveændring. PH-området mellem 3,1 (rød) og 4,4 (gul) er farveændringsintervallet for methylorange; den udtalte farveændring finder sted mellem disse pH-værdier.
mange forskellige stoffer kan bruges som indikatorer, afhængigt af den særlige reaktion, der skal overvåges., For eksempel, rød kål juice indeholder en blanding af farvede stoffer, der skifter fra dyb rød ved lav pH til lyseblå på de mellemliggende pH til gul ved høj pH (Figur \(\PageIndex{1}\)). I alle tilfælde skal en god indikator dog have følgende egenskaber:
- farveændringen skal let registreres.
- farveændringen skal være hurtig.
- indikatormolekylet må ikke reagere med det stof, der titreres.
- for at minimere fejl skal indikatoren have en pKin, der ligger inden for en pH-enhed af den forventede pH ved ækvivalenspunktet for titreringen.,

Rød kål juice indeholder en blanding af stoffer, hvis farve afhænger af pH. Hver test-tube indeholder en opløsning af røde kål saft i vandet, men pH-værdien af de løsninger, der varierer fra pH = 2.0 (yderst til venstre) til pH = 11.0 (længst til højre). Ved pH = 7,0 er opløsningen blå.,der er udviklet syntetiske indikatorer, der opfylder disse kriterier og dækker stort set hele pH-området. Figur \(\Pageinde. {2}\) viser det omtrentlige pH-interval, over hvilket nogle almindelige indikatorer ændrer farve og deres farveændring. Derudover er nogle indikatorer (såsom thymolblå) polyprotiske syrer eller baser, der ændrer farve to gange ved vidt adskilte pH-værdier.
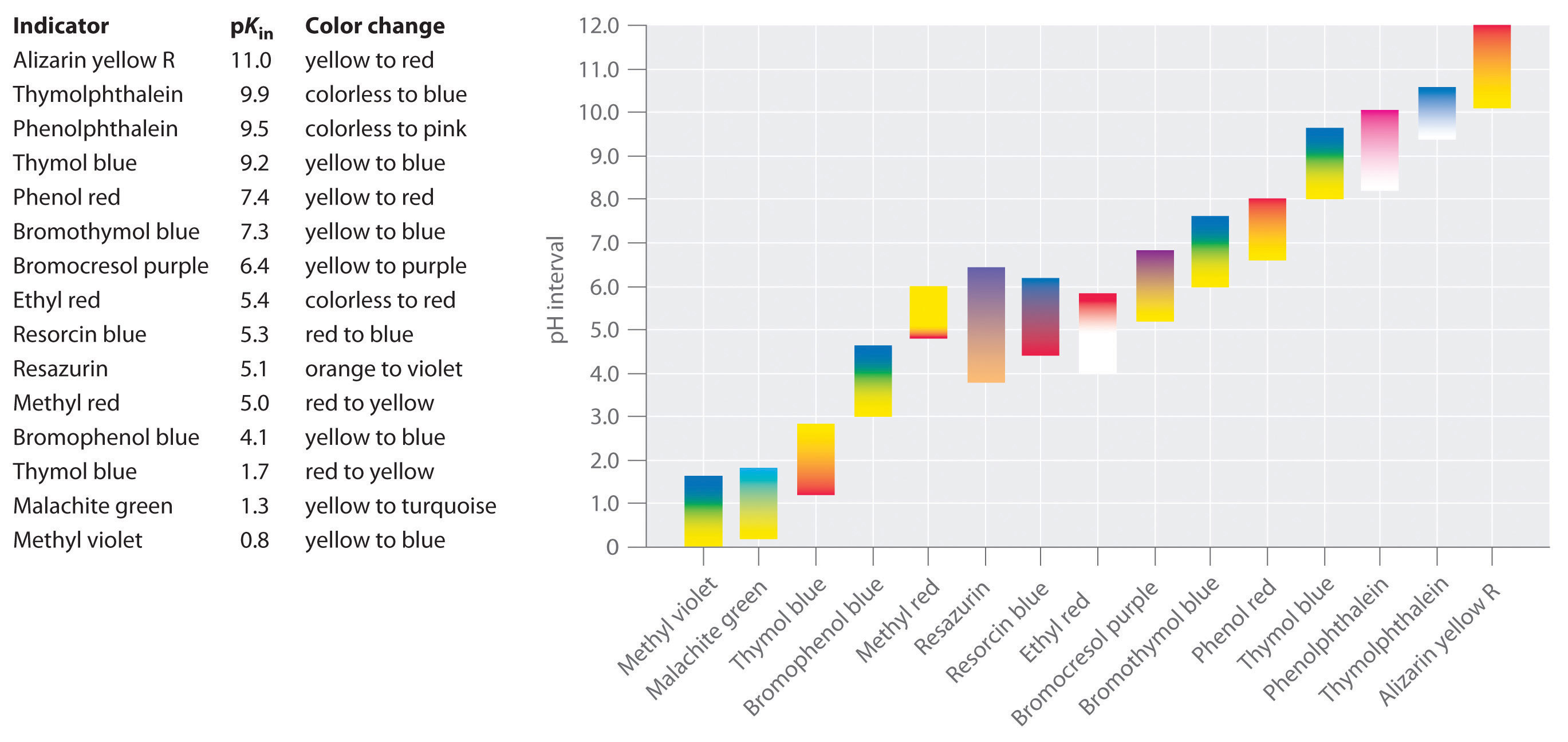
Det er vigtigt at være opmærksom på, at en indikator ikke skifter farve brat ved en bestemt pH-værdi; i stedet, det rent faktisk undergår en pH-titrering ligesom enhver anden syre eller base. Når koncentrationen af HIn falder og koncentrationen af In-stiger, ændres opløsningens farve langsomt fra den karakteristiske farve af HIn til den for in -. Som vi vil se i Afsnit 16, ændres forholdet / forholdet fra 0.,1 ved en pH en enhed under pkin til 10 ved en pH en enhed over pkin. Således ændrer de fleste indikatorer farve over et pH-område på ca.to pH-enheder.
Vi har udtalt, at en god indikator skal have en pkin-værdi, der ligger tæt på den forventede pH ved ækvivalenspunktet. For en stærk syrestærk basetitrering er valget af indikatoren ikke særlig kritisk på grund af den meget store ændring i pH, der forekommer omkring ækvivalenspunktet., I modsætning hertil kan brug af den forkerte indikator til titrering af en svag syre eller en svag base resultere i relativt store fejl, som illustreret i figur \(\Pageinde. {3}\). Denne figur viser plots af pH versus mængden af base tilføjet til titrering af 50.0 mL af en 0.100 M opløsning af en stærk syre (HCl) og en svag syre (eddikesyre) med 0.100 M \(NaOH\). PH-intervallerne over hvilke to almindelige indikatorer(methylrød, \(pk_{in} = 5.0\) og phenolphthalein, \(pK_{in} = 9.5\)) skifter farve vises også., De vandrette bjælker angiver de pH-intervaller, over hvilke begge indikatorer skifter farve krydser HCl-titreringskurven, hvor den er næsten lodret. Derfor ændrer begge indikatorer farve, når stort set det samme volumen \(NaOH\) er tilføjet (cirka 50 mL), hvilket svarer til ækvivalenspunktet. I modsætning hertil vil titrering af eddikesyre give meget forskellige resultater afhængigt af om methylrød eller phenolphthalein anvendes som indikator., Selvom pH-området, over hvilket phenolphthalein ændrer farve, er lidt større end pH-værdien ved ækvivalenspunktet for den stærke syretitrering, vil fejlen være ubetydelig på grund af hældningen af denne del af titreringskurven. Ligesom med HCl-titreringen bliver phenolphthalein-indikatoren lyserød, når der er tilsat cirka 50 mL \(NaOH\) til eddikesyreopløsningen. I modsætning hertil begynder methylrød at skifte fra rød til gul omkring pH 5, som er nær midtpunktet af eddikesyretitreringen, ikke ækvivalenspunktet., 25-30 mL \(NaOH\) vil derfor medføre, at den methylrøde indikator ændrer farve, hvilket resulterer i en enorm fejl.
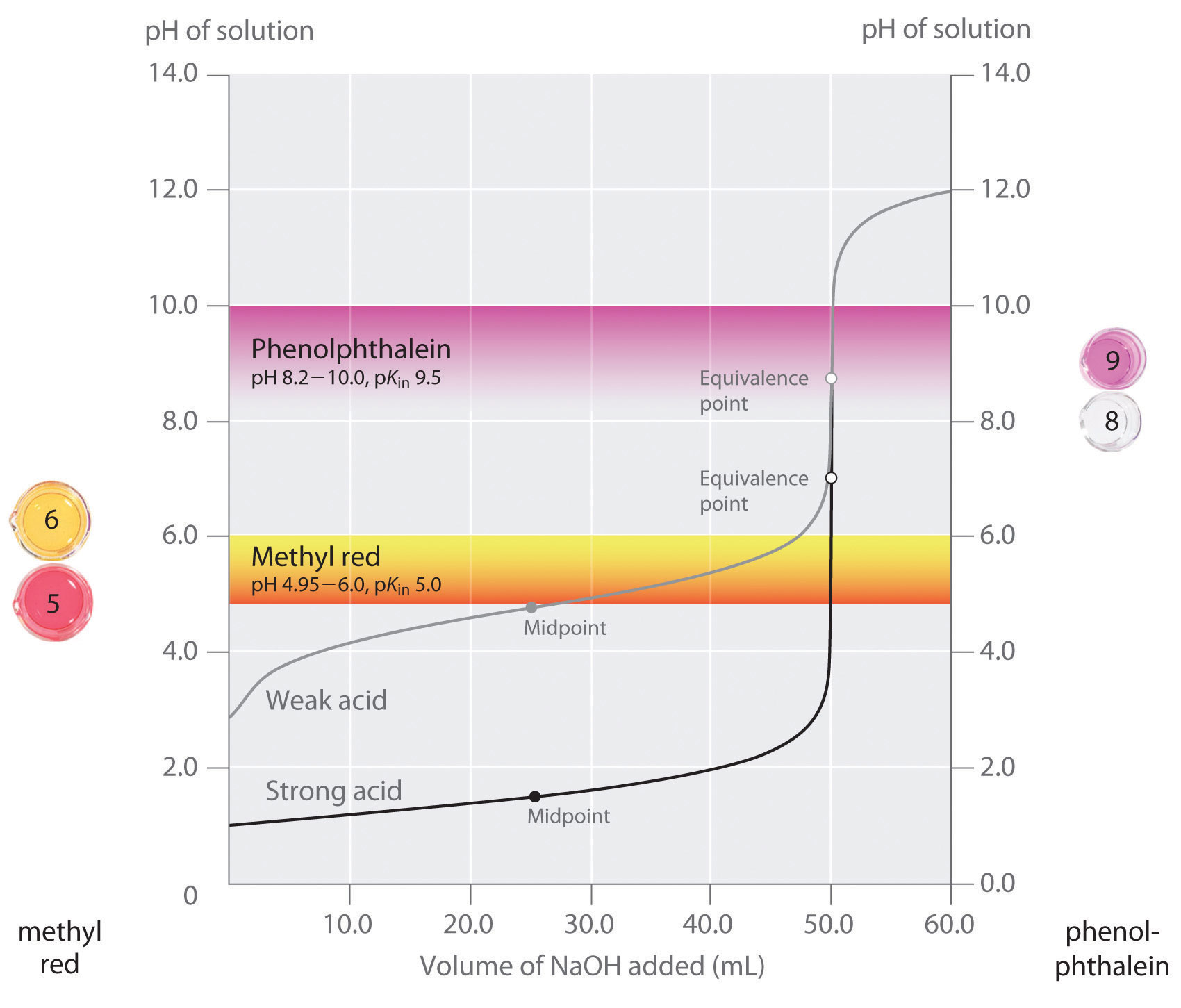
grafen viser de resultater, der er opnået ved hjælp af to indikatorer (methyl rød og phenolphtalein) for titrering af 0.100 M løsninger af en stærk syre (HCl) og en svag syre (eddikesyre) med 0.100 M \(NaOH\)., På grund af stejlheden af titreringskurven for en stærk syre omkring ækvivalenspunktet, vil begge indikatorer hurtigt ændre farve ved ækvivalenspunktet for titrering af den stærke syre. I modsætning hertil er pKin for methylrød (5.0) meget tæt på PKA af eddikesyre (4.76); midtpunktet for farveændringen for methylrød forekommer nær titreringens midtpunkt snarere end ved ækvivalenspunktet.
generelt, for titreringer af stærke syrer med stærke baser (og omvendt), vil enhver indikator med en pK mellem omkring 4.0 og 10.0 gøre., Til titrering af en svag syre, men pH-værdien på ækvivalens punkt er større end 7.0, så en indikator, såsom phenolphtalein eller thymol blå, med pKin > 7.0, skal anvendes. Omvendt, for titrering af en svag base, hvor pH-værdien på ækvivalens punkt er mindre end 7.0, en indikator som methyl rød eller bromocresol blå, med pKin < 7.0, skal anvendes.
eksempel \(\Pageinde? {1}\)
i titrering af en svag syre med en stærk base, hvilken indikator ville være det bedste valg?,
- Methyl Orange
- bromcresolgrønt
- Phenolphtalein
Løsningen
Den korrekte svar er C. I titrering af en svag syre med en stærk base, den konjugerede base af den svage syre vil gøre pH på ækvivalens punkt større end 7. Derfor ønsker du, at en indikator skal ændre sig i det pH-interval. Både methylorange og bromocresolgrøn ændrer farve i et surt pH-område, mens phenolphtalein ændrer sig i en basisk pH.,
eksistensen af mange forskellige indikatorer med forskellige farver og pKin værdier giver også en bekvem måde at estimere pH-værdien af en løsning uden brug af et dyrt elektronisk pH-meter og en skrøbelig pH-elektrode. Papir eller plastic-strips, der er imprægneret med kombinationer af indikatorer anvendt som “pH-papir”, som giver dig mulighed for at vurdere pH i en opløsning ved simpelthen at dyppe et stykke pH-papir ind i det og sammenligne den resulterende farve med de standarder, der er trykt på beholderen (Figur \(\PageIndex{4}\)).,
Oversigt
Syre–base indikatorer er forbindelser, der skifter farve ved en bestemt pH., De er typisk svage syrer eller baser, hvis farveændringer svarer til deprotonation eller protonation af selve indikatoren.
Bidragydere og Kategorier
-
Paul Blomster (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) og Richard Langley (Stephen F. Austin State University) med bidragende forfattere. Lærebog indhold produceret af opensta.College er licenseret under en Creative Commons Attribution License 4.0 licens. Do .nload gratis på http://cnx.org/contents/85abf193-2bd…[email protected]).
- {skabelon.,Contriboundless ()}}















