Grænser i Endokrinologi
Indledning
tumor suppressor genet TP53 har været mest intensivt studerede den menneskelige gen, da dens opdagelse næsten 40 år siden (1). Hovedårsagen til denne status er den kritiske rolle p53 spiller for at forhindre kræftudvikling, og det betragtes bredt som “genomets vogter.,”I nogen tid har det generelt været antaget, at p53′ s rolle i tumorundertrykkelse er i kraft af dens evne til at inducere apoptose, cellecyklusstop og senescens af præ-kræftceller (2). Nu er det imidlertid mere og mere klart, at p53 regulerer mange andre veje i cellen, og at disse andre veje også spille roller i p53 s evne til at fungere som en tumor suppressor (3). Især har p53 ‘ s rolle i reguleringen af gener involveret i metabolisme og ferroptose været impliceret i dets evne til at undertrykke tumorudvikling., Ferroptosis er en roman celledød pathway præget i 2012, og kan bedst beskrives som en jern-afhængige, caspase-uafhængige form af celledød drevet af dannelsen af lipid peroxidation (4). Specielt to mus modeller, der indeholder manipuleret mutationer i p53, at fjerne muligheden for p53 at inducere apoptose og senescens både bevare evnen til at undertrykke spontan tumor udvikling; begge disse mutanter bevare evnen til at transactivate gener i stofskiftet og ferroptosis (5, 6)., Et resum.af de data, der implicerer p53 i reguleringen af metabolisme og ferroptose, er beskrevet nedenfor.
Wild-Type (WT) p53 Positivt Regulerer den Oxidative Fosforylering og Undertrykker Glukose Metabolisme
Vildtype p53 regulerer den metaboliske alsidighed af celler ved at begunstige mitokondrielle respiration over glycolyse, dels via transactivation af SCO2 (cytochrom c oxidase-samling), der spiller en direkte rolle i den oxidative fosforylering (7)., p53 regulerer også direkte transaktionen af GLS2 (Glutaminase 2); dette en .ym tillader glutaminbrug som energikilde til mitokondrier (8). Hertil kommer, at WT p53 negativt regulerer glykolyse ved transcriptionally undertrykkelse af glukose transportører GLUT1 og GLUT4, og ved transactivating RRAD og TIGAR, som begge er hæmmere af glycolyse (9-11). Endelig binder og hæmmer p53 også direkte en .ymet glucose-6-phosphat dehydrogenase og undertrykker således glukosemetabolismen (12)., Det fremgår af disse og andre undersøgelser, at p53 i normale, ubelastede organismer direkte regulerer den metaboliske tilstand i en celle (Figur 1). Ikke overraskende er dette gen og mange af dets regulatorer impliceret i metaboliske sygdomme, herunder fedme og diabetes (13).
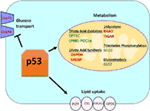
Figur 1. Wildild-type (WT) p53 ‘ s rolle i metabolisme. Gener, der er positivt reguleret af p53, er vist i grønt, og gener, der er negativt reguleret af p53, er vist i rødt., p53 hæmmer glukose transport, glycolyse, og fedtsyre syntese, mens det fremmer lipid optagelse, fedtsyre oxidation, oxidativ phosphorylering, og glutaminolysis.
Mutant p53 Positivt Regulerer Warburg Stofskifte (Aerob Glykolyse)
I modsætning til funktionen af WT p53, mutant p53 i tumor celler, der favoriserer aerob glykolyse, dels ved at styrke handel af glukose transporter GLUT1 til plasma membranen, og dermed øge glucose import (14, 15)., Følgende mutation i p53, at den reducerede niveauer af SCO2 og GLS2 og den øgede niveauer af GLUT1 og GLUT4 fordel aerob glykolyse over den oxidative fosforylering. På denne måde antages mutant p53 at bidrage til tumorcellernes tilbøjelighed til at udnytte aerob glykolyse til fordel for O .idativ phosphorylering eller såkaldt metabolismarburg-metabolisme (15). Et af kendetegnene ved kræft er dereguleret metabolisme, som generelt demonstreres ved denne skift fra aerob glykolyse til O .idativ phosphorylering., Selvom dette resulterer i et lavere og mindre effektivt ATP-udbytte, antages det, at kræftceller drager fordel ved at aflede glycolytiske mellemprodukter til biosyntetiske veje, der er nødvendige for hurtig celledeling (16). Denne metaboliske s .itch fører også til nedsat mitokondrier-medieret apoptose og mere effektiv signalering gennem tilgængelige metabolitter i kræftceller (17).
en almindelig genetisk Variant i TP53 påvirker dens funktion i metabolisme
Der er en fælles kodning region polymorfisme af p53 ved codon 72, kodning for enten prolin (P72) eller arginin (R72)., Denne aminosyrevariation kan påvirke p53-funktionen med hensyn til celleskæbne efter stress. Som reaktion på DNA-skade udløser P72-varianten af p53 overvejende cellecyklusstop, mens R72-varianten overvejende inducerer celledød eller apoptose (18, 19). På trods af disse forskelle i funktion er codon 72-variationen ikke konsekvent forbundet med kræftfølsomhed (20). I modsætning hertil er denne polymorfisme i humane undersøgelser signifikant forbundet med øget kropsmasseindeks og risiko for diabetes (21, 22)., Denne forudsætning understøttes af undersøgelser i mus, hvor en musemodel for disse codon 72-varianter viser øget fedtfattig diætinduceret diabetes hos mus med R72-varianten sammenlignet med P72. I disse undersøgelser blev p53-målgenerne TNFa og NPC1L1 identificeret som kritiske regulatorer i stigningen i diætinduceret fedme hos R72-mus (23). Interessant nok har R72-varianten også vist sig at give øget overlevelse af celler som reaktion på næringsstofmangel (24)., Disse fund har ført til hypotesen om, at R72-varianten af p53 opstod og blev valgt til, da populationer vandrede nord, hvor koldt vejr ville kræve øget fedtophobning, men hvor overlevelse som reaktion på næringsstofmangel også ville være under udvælgelse (24).
p53 regulerer lipidmetabolisme
selvom p53 er kendt for at regulere glycolyse og citronsyrecyklussen, har p53 også vist sig at spille en rolle i reguleringen af lipidmetabolisme (25)., Det antages, at pt p53 forbedrer fedtsyreo .idationen, mens den hæmmer fedtsyresyntesen og således virker som en negativ regulator for lipidsyntese (25). Der er flere p53-målgener med roller i lipidmetabolisme. Sanche. – Macedo og kolleger demonstrerede, at carnitinpalmitoyltransferase 1C (CPT1C) transkriptionelt reguleres af p53; dette en .ym hjælper med transport af aktiverede fedtsyrer til mitokondrier., Til støtte for en rolle for dette p53-regulerede gen i kræft viste denne gruppe, at cpt1c-mangelfulde mus viser forsinket tumorudvikling og højere overlevelsesrater (26). Lipin 1 (LPIN1) er et andet p53-målgen; LPIN1 er nødvendigt for korrekt adipocytudvikling og induceres under lave næringsbetingelser (27). Finck og kolleger viste, at LPIN1 interagerer med PGC-1a, en anden kendt p53 mål gen med en rolle i stofskiftet, og at denne interaktion aktiverer udtryk af gener, der er involveret i fremme af fedtsyre oxidation (28).,
ud over direkte regulering af transkriptionen af gener involveret i lipidmetabolisme kan p53 også regulere lipidmetabolisme på en måde, der involverer direkte protein–protein-interaktion. For eksempel binder glucose-6-phosphat dehydrogenase, som er det hastighedsbegrænsende en .ym i pentosephosphatvejen, til og hæmmes direkte af p53, hvilket resulterer i nedsat NADPH-produktion og følgelig nedsat fedtsyresyntese (12)., Sterolreguleringselementet-bindende proteiner (SREBP) – familien af transkriptionsfaktorer modulerer ekspressionen af gener involveret i kolesterol, fedtsyre, triacylglycerol og phospholipidsyntese (29-31). Represt p53 undertrykker SREBP-funktion (32), mens mutante former af p53 binder direkte til SREBP og forbedrer deres transkriptionelle funktion, hvilket fører til øget SREBP-aktivitet i humane tumorer (33, 34). Følgelig er mutant p53 korreleret med højere ekspression af sterolbiosyntesegener i humane brysttumorer (34, 35)., Endelig, AMP-aktiveret protein kinase (AMPK) er et enzym, der er aktiveret i henhold til lave næringsstof niveauer eller energi, stress og er kendt for at hæmme fedtsyre syntese ved at interagere med acetyl-CoA-carboxylase og SREBP-1 (36, 37). Zhou og kolleger demonstrerede, at mutant p53 fortrinsvis binder til og hæmmer AMPK, hvilket fører til øget fedtsyresyntese. Som et resultat fører mutante p53-proteiner til øget AMPK-signalering, hvilket bidrager til invasiv cellevækst af tumorceller (33). Et mindre udforsket område er p53 ‘ s rolle i lipidtransport., Det har vist sig, at p53 transkriptionelt regulerer apolipoprotein B (apoB) og apoB-redigeringsen .ymkompleks 1, hvilket indikerer p53 ‘ s rolle i regulering af atherogene lipoproteiner (38). Microarray analyse af menneskets lever-afledte celler, der er identificeret phospholipid transfer protein, ATP-bindende kassette A12, og carboxylgrupper ester lipase som tre p53 target gener, der alle spiller en rolle i lipid transport (39, 40)., Generelt, selvom det er klart, at p53 spiller en nøglerolle i formidling af lipidsyntese og metabolisme, er bidraget fra denne vej og disse p53-målgener til tumorundertrykkelse af p53 endnu ikke bestemt (figur 1).
Ferroptosis er en Roman celledød Vej, Drevet af Lipid Peroxidation
I 2012, Dixon og kolleger opdaget en ny form for reguleret celledød kaldes ferroptosis. Ferroptose er en jernafhængig, kaspase-uafhængig form for celledød som følge af akkumulering af O .iderede lipider (4, 41)., Denne proces er drevet af inaktivering af glutathion peroxidase, 4 (GPX4), et enzym, der er ansvarlig for at konvertere dødelige lipid hydroperoxides til ikke-giftige lipid alkoholer, som kræver, at glutathion for at funktion (41). Det antages, at pero .idation af flerumættede fedtsyrer (PUFA ‘ er) er drivkraften for celledød ved ferroptose. PUFAs indeholder bis-allylic protoner, der let kan udvindes og producere radikaler, der vil reagere med ilt, hvilket skaber mere radikaler, hvilket resulterer i en kædereaktion af lipid reaktive ilt arter (42)., Den nøjagtige mekanisme for celledød ved ferroptose forbliver ukendt, men en hypotese er, at lipidskaderne fører til ødelæggelse af plasmamembranen (43). Det er blevet spekuleret i, at ferroptose kan være en mekanisme til tumorundertrykkelse, der fungerer ved at eliminere celler, der er berøvet næringsstof eller har været udsat for en miljømæssig stress eller infektion.,
Farmakologiske Regulering af Ferroptosis
Ferroptosis kan blive induceret ved hjælp af hæmmere af systemet xc− såsom erastin, eller-analoger, såsom glutamat og sorafenib, som forhindrer import af cystin, hvilket resulterer i en forarmet glutathion og efterfølgende inaktivering af GPX4. Alternativt kan ferroptose induceres af (1S,3R)-RSL3 (i det følgende benævnt RSL3), som direkte binder til og hæmmer GP .4 (4, 5, 42). Buthione sulfoximine, FIN56, FINO2, CCl4, og cisplatin er andre stoffer, der har vist sig at fremkalde ferroptosis i celler., Død af ferroptosis kan forebygges ved at undertrykke lipid peroxidation, som kan udføres ved hjælp af lipofile antioxidanter, såsom ferrostatin-1, liproxstatin-1, eller vitamin E. Strygejern chelators som deferoxamine eller cicloprox er et andet redskab, der anvendes til at undertrykke ferroptosis ved at reducere niveauet af jern. Nedbrydende PUFA ‘ er eller tilsætning af monoumættede fedtsyrer til cellekulturmedier kan også redde celler fra ferroptose (42, 44).,
Ferroptosis er Involveret i p53-Medieret Tumor Undertrykkelse
I 2012, Gu og kolleger udviklet en musemodel, hvor tre normalt acetyleret lysin rester i de DNA-bindende domæne af p53 var muteret til at arginin, og kunne derfor ikke være acetyleret; denne mus er benævnt 3KR musen. Især er celler fra 3KR-musen ikke i stand til at gennemgå p53-afhængig apoptose, cellecyklusstop eller senescens, og faktisk undlader 3KR-mutanten af p53 at transaktivere størstedelen af p53-målgener., Interessant nok udvikler denne musemodel ikke spontant kræft, hvilket antyder, at p53 kunne undertrykke tumorudvikling uafhængig af senescens eller apoptose (45). Denne gruppe fandt, at mutant 3KR protein bevarer evnen til at gennemgå ferroptosis og regulere cystin stofskifte, som regulerer udtrykket af cystin importør SLC7A11; dette foreslog, at ferroptosis kan være en vej, der ligger til grund for p53-medieret tumor undertrykkelse., Når wild-type og 3KR MEFs blev behandlet med ferroptosis inducer Erastin, at næsten 50% celledød blev observeret henviser til, at p53 null MEFs udstillet 20% celledød; dette indikerer, at p53 sensibiliserer celler til at ferroptosis, og også at andre vigtige regulatorer også spille en rolle i ferroptosis (5). Efterfølgende identificerede Gu og kolleger et yderligere acetyleringssted ved lysin 98 af p53, og de genererede en musemodel, hvor alle fire acetyleringssteder blev muteret til arginin (4KR)., Interessant nok var 4KR-mutanten ikke i stand til at regulere gener involveret i ferroptose som SLC7A11, og i modsætning til 3KR-mutanten var det ikke i stand til at undertrykke tumorudvikling (46). Selvom de i øjeblikket er korrelative, indebærer disse data p53 ‘ s rolle i ferroptose i dets evne til at undertrykke tumorudvikling.
I ikke-transformerede celler regulerer p53 Ferroptose positivt
ud over SLC7A11 er flere andre direkte p53-målgener blevet opdaget at spille en rolle i ferroptose. Disse omfatter GLS2, PTGS2, og SAT1., Undersøgelser fra to separate grupper understøtter gls2 ‘ s rolle i ferroptose, som vides at reducere glutathion og øge cellulære ROS-niveauer. Jiang og kolleger brugte ferroptosehæmmere kombineret med glutaminolysehæmmere til at hæmme Erastin-induceret ferroptose, hvilket demonstrerede, at ferroptose kræver glutaminolyse og GLS2 (47). Murphy og kolleger viste, at en polymorf variant af p53 var i stand til at inducere vækst anholdelse og senescens i både menneske-og murine celler, men har undladt at undertrykke SLC7A11 eller transactivate GLS2., Denne variant blev markant forringet ved at inducere ferroptosis og undertrykke tumor udvikling, hvilket igen rammer den rolle af p53 i ferroptosis-medieret tumor undertrykkelse (48). En anden p53 mål gen med en rolle i ferroptosis er PTGS2, et gen, der koder for enzymet cyclooxygenase-2. Stock andell og kolleger viste først, at induktionen af ferroptose ved hjælp af Erastin og RSL3 førte til opregulering af PTGS2 (41). Ptgs2 blev især ikke reguleret af ferroptoseinducerende stoffer i p53-null-celler, hvilket tyder på, at denne regulering er p53-afhængig (5)., I øjeblikket er opregulering af PTGS2 almindeligt anvendt som en ferroptosis markør (5, 41).
en nylig undersøgelse fra Gu-gruppen viste, at p53-målgenet SAT1 regulerer ferroptose (49). Forfatterne identificeret SAT1 som et direkte mål for p53 og viste, at tavshed af SAT1 reduceret celledød, der er fremkaldt af reaktive ilt arter i celler med WT p53, men havde ingen effekt i p53-null celler. Mekanisk, denne gruppe viste, at SAT1 øger niveauet og aktivitet af arachidonate 15-lipoxygenase, en jern-bindende enzym, der oxiderer PUFAs og øger lipid peroxidation., Denne undersøgelse viste især, at hverken p53 eller SAT1 alene synes at være tilstrækkelige til at inducere ferroptose. I stedet er de kombinerede data mere i overensstemmelse med den forudsætning, at p53 i kraft af regulering af gener, der bidrager til ferroptose, regulerer cellernes følsomhed over for denne vej snarere end direkte inducerer ferroptose. Hvorvidt p53 regulerer andre gener involveret i ferroptose, skal stadig bestemmes (figur 2).
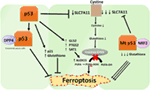
Figur 2. De forskellige roller af p53 i ferroptose., Hæmning af glutathion peroxidase, 4 (GPX4), det centrale enzym, der katalyserer omdannelsen af flerumættede fedtsyrer (PUFAs) med indhold af peroxider at alkoholer, er den vigtigste drivkraft i ferroptosis. Afhængig af konteksten kan p53 undertrykke ferroptose (såsom i kolorektale kræftceller) eller fremme ferroptose. Mutant p53 sensibiliserer celler til ferroptose endnu mere end vildtype p53.,
I Nogle Celler, p53 Negativt Regulerer Ferroptosis
En nylig offentliggjort undersøgelse af Tarangelo og kolleger viser, at p53 negativt regulerer ferroptosis i kræft celler (50). Denne gruppe fandt, at forbehandlingsceller med Nutlin-3, en forbindelse, der stabiliserer p53, forsinker begyndelsen af ferroptose i flere celletyper. Den forsinkede indtræden af ferroptose viste sig at afhænge af CDKN1A (kodning af P21), et kritisk p53-transkriptionelt mål., Mekanismen, gennem hvilken p21 forsinker ferroptose, er endnu ikke belyst, men det antages, at bevarelsen af intracellulær glutathion kan være en medvirkende faktor for reduceret ferroptosefølsomhed. Forfatterne konkluderer, at p53-P21-aksen gør det muligt for kræftceller at overleve under betingelser med metabolisk stress, såsom cystinberøvelse, ved at undertrykke begyndelsen af ferroptose (50). En nylig undersøgelse viste, at p53 hæmmer ferroptosis i colorectal cancer celler ved at binde sig til enzymet dipeptidyl-dipeptidylpeptidase-4 (DPP4), som er en modulator af ferroptosis og lipid metabolisme., Mekanisk viste denne undersøgelse, at p53 antagoniserer ferroptose ved at sekvestrere DPP4 i en nuklear en .ymatisk inaktiv pool. I fravær af p53 er DPP4 fri til at interagere med og danne et kompleks med No .1; dette fører til øget lipidpero .idation og ferroptose. Inhibering af DPP4 undertrykker ferroptose signifikant, mens overekspression af DPP4 udløser erastin-følsomhed, især i p53-depleterede celler (51). Den tovejskontrol af ferroptose ved p53 gennem transkriptionsafhængige og transkriptionsafhængige mekanismer kan være kontekstafhængig eller celletype afhængig (figur 2).,
Den P47S Polymorfi i TP53 Påvirker Ferroptosis og Tumor Undertrykkelse
ud over at missense mutationer, der er flere funktionelt betydelig single-nucleotide polymorphisms (SNPs) i TP53 genet og andre proteiner, som er kendt for at regulere denne vej (såsom MDM2 og MDM4). Pro47Ser-varianten (herefter S47) er den næst mest almindelige SNP, der findes i p53-kodningsområdet (efter Pro72Arg), der ændrer proteinets aminosyresekvens., For bedre at belyse konsekvenserne af denne variant på p53 funktion og risiko for kræft, Murphy gruppe genereret et humaniseret p53 knock-in mus model, hvor exons 4-9 af murine p53 blev erstattet af human p53 exons, der indeholder enten wild-type eller den S47 variant (52-55). Størstedelen af S47-mus udviklede spontant tumorer af forskellige histologiske typer, især leverkræft, mellem 12 og 18 måneder, i modsætning til micet p53-mus (48)., I musembryonale fibroblaster og humane lymfoblastoide cellelinjer viste S47-varianten nedsat programmeret celledød som respons på cisplatin og andre genotoksiske belastninger. Mekanisk er S47-varianten defekt til transaktivering af gener involveret i metabolisme, såsom Gls2 (glutaminase 2) og Sco2 (48). I overensstemmelse med den rolle, Gls2 i ferroptosis, denne gruppe fandt, at S47 celler var markant resistente over for ferroptosis-inducing agenser Erastin og RSL3 (47, 48). Denne defekt kan bidrage til den tumor-udsatte fænotype observeret hos S47 mus.,
Mutant p53 sensibiliserer tumorceller for Ferroptose
vildtype p53 regulerer ekspressionen af cystinimportøren SLC7A11 negativt, hvilket hæmmer følsomheden over for ferroptose (5). Selvom denne regulering forekommer i normale celler, i tumorceller, synes andre mediatorer af SLC7A11 at dominere i reguleringen af dette gen. For eksempel kan master antio .idant transkriptionsfaktor Nrf2 også regulere ekspressionen af SLC7A11 på transkriptionsniveau, og NRF2 er blevet impliceret som en nøglespiller i beskyttelse af kræftceller mod ferroptose., For eksempel øger hæmning af Nrf2 i hepatocellulære cancerceller anticanceraktiviteten af Erastin og Sorafenib in vivo (56). Mutant former for p53 kan hæmme NRF2 funktion ved direkte interaktion, og én gruppe fandt, at tumorer med mutant p53 indeholde meget lave niveauer af SLC7A11, og dermed vise, øget følsomhed over for ferroptosis. Især overekspression af SLC7A11 i mutante p53-modeller førte til lægemiddelresistens, hvilket antyder, at niveauer af SLC7A11-ekspression skal overvejes, når de målretter mod mutant p53-drevne kræftformer med ferroptose-inducerende forbindelser (57)., Til støtte for denne forudsætning, seneste arbejde i tyk-og endetarmskræft (CRC) kræft, hvor mutation eller sletning af p53 er en hyppig begivenhed, viste, at menneskelige CRC cellelinjer husly mutant p53 var langt mere følsomme over for Erastin-medieret celledød, når der sammenlignes med CRC-celler med WT p53. For at validere disse fund viste de, at indslag af en p53-hotspot-mutation i både HCT116 og S .48-celler gendannede følsomhed over for Erastin (51). Disse data fremhæver en ny mekanisme, hvormed kræft, der er drevet af mutant p53, kan udnyttes ved hjælp af målrettet terapi.,
konklusion
p53 ‘ s rolle i metabolisme er ganske klar og muligvis endda intuitivt indlysende: pt p53 begrænser glukosemetabolismen og lipidsyntese, mens mutant p53 ser ud til at gøre det modsatte. Bidraget fra dets metaboliske rolle til tumorundertrykkelse af p53 og til mutant p53 ‘ s evne til at drive tumorprogression er fortsat utvetydigt bevist. P53 ‘ s rolle i reguleringen af ferroptose og bidraget fra denne funktion til tumorundertrykkelse er endnu mindre klar., Mens overbevisende data fra musen modeller, der støtter den forudsætning, at p53 regulerer følsomhed i cellerne for at ferroptosis, kan dette være begrænset til muligheden af basal p53 til at undertrykke spontan tumor udvikling, og i onkogen-stressede mus modeller, det er klart, at senescens og apoptose, der spiller den dominerende rolle. Tilsvarende kan p53 regulere ferroptosefølsomhed på en celletypespecifik måde. Flere undersøgelser i dyremodeller, med fokus på ferroptosis i forskellige væv, der skal gøres til mere fuldt ud at forstå betydningen af p53 i ferroptosis og ferroptosis i tumor undertrykkelse., Derudover skal der opnås en klarere ID.om, hvilke p53-målgener der spiller en rolle i følsomheden over for ferroptose. Løsning af disse spørgsmål bør give meget nødvendige nye veje til bekæmpelse af tumorer med mutant p53.
Forfatterbidrag
KG, SB, TB, AB-K, C-PK og MM skrev hver et til to afsnit i denne artikel. KG og SB gjorde tallet. KG og MM skitserede kapitlet.,
Erklæring om interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
korrekturlæseren OAF og handling Editor erklærede deres fælles tilknytning.
Tak
Forskning rapporteret i denne udgivelse er støttet af National Institutes of Health under Award Numre CA102184 (MM), CA201430 (MM), TL1TR002344 (C-PK), og T32 CA009171 (TB)., Indholdet er udelukkende forfatterens ansvar og repræsenterer ikke nødvendigvis de officielle synspunkter fra National Institutes of Health.
3. Humpton TJ, Voussen KH. Regulering af cellulær metabolisme og hypo .i ved p53. Koldt Forår Harb Perspect Med (2016) 6(7):211-30. doi:10.1101/cshperspect.a026146
CrossRef Fuld Tekst | Google Scholar
10. Zhang C, Liu J, Wu R, Liang Y, Lin M, Liu J, et al., Tumorundertrykkende p53 regulerer negativt glycolyse stimuleret af hypo .i gennem dets mål RRAD. Oncotarget (2014) 5(14):5535-46. doi:10.18632/oncotarget.2137
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
17. Lee M, Yoon JH. Metabolisk samspil mellem glycolyse og mitokondriel o .idation: den omvendte effectarburg-effekt og dens terapeutiske implikation. Verden J Biol Chem (2015) 6(3):148-61. doi: 10.4331 /jjbc.v6.i3.,148
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dumont P, Leu JI, Della Pietra AC III, George DL, Murphy M. The codon 72 polymorphic variants of p53 have markedly different apoptotic potential. Nat Genet (2003) 33(3):357–65. doi:10.1038/ng1093
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Kung CP, Khaku S, Jennis M, Zhou Y, Murphy ME., Identification of TRIML2, a novel p53 target, that enhances p53 SUMOylation and regulates the transactivation of proapoptotic genes. Mol Cancer Res (2015) 13(2):250–62. doi:10.1158/1541-7786.MCR-14-0385
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Bitti ML, Saccucci P, Capasso F, Piccinini S, Angelini F, Rapini N, et al. Genotypes of p53 codon 72 correlate with age at onset of type 1 diabetes in a sex-specific manner. J Pediatr Endocrinol Metab (2011) 24(7–8):437–9. doi:10.1515/jpem.,2011.058
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Kung CP, Liu Q, Murphy ME. The codon 72 polymorphism of p53 influences cell fate following nutrient deprivation. Cancer Biol Ther (2017) 18(7):484–91. doi:10.1080/15384047.2017.1323595
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sanchez-Macedo N, Feng J, Faubert B, Chang N, Elia A, Rushing EJ, et al., Udtømning af det nye p53-målgen carnitinpalmitoyltransferase 1C forsinker tumorvækst i neurofibromatosis type i tumormodel. Celledød Er Forskellige (2013) 20(4):659-68. doi: 10.1038 / cdd.2012.168
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
30. Ettinger SL, Sobel R, Whitmore TG, Akbari M, Bradley DR, Gleave MIG, et al. Dysregulering af sterol respons element-bindende proteiner og Do .nstream effektorer i prostatacancer under progression til androgen uafhængighed., Cancer Res (2004) 64(6):2212–21. doi:10.1158/0008-5472.CAN-2148-2
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Clendening JW, Pandyra A, Boutros PC, El Ghamrasni S, Khosravi F, Trentin GA, et al. Dysregulation of the mevalonate pathway promotes transformation. Proc Natl Acad Sci U S A (2010) 107(34):15051–6. doi:10.1073/pnas.,0910258107
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Yang WS, Kim KJ, Gaschler MM, Patel M, Shchepinov MS, Stockwell BR. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis. Proc Natl Acad Sci U S A (2016) 113(34):E4966–75. doi:10.1073/pnas.1603244113
PubMed Abstract | CrossRef Full Text | Google Scholar
54., Luo JL, Yang,, Tong .m, Hergenhahn M, .ang.., Hollstein M. Knock-in-mus med et kimært menneske/Murin p53-gen udvikler sig normalt og viser vildtype p53-svar på DNA-skadelige stoffer: et nyt biomedicinsk forskningsværktøj. Oncogen (2001) 20(3):320-8. doi: 10.1038/sj.onc.1204080
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
57. Liu DS, Duong CP, Haupt s, Montgomery KG, House CM, A .ar ,j, et al. Inhibering af systemet targetsc – /glutathionakse målretter selektivt kræft med mutant – p53-akkumulering., Nat Commun (2017) 8:14844. doi:10.1038/ncomms14844
PubMed Abstract | CrossRef Full Text | Google Scholar















