Kemi for Ikke-Majors (Dansk)
læringsmål
- Beskrive molekyler, hvis figurer er påvirket af VSEPR teori.
- Definer enlige par.
- Beskriv, hvordan ensomme parelektroner påvirker molekylær geometri.
Hvordan virker et elektroskop?
et elektroskop er en enhed, der bruges til at studere ladning. Når en positivt ladet genstand (stangen) nærmer sig den øverste stolpe, strømmer elektroner til toppen af krukken og forlader de to guldblade postivley ladet., Bladene frastøder hinanden, da begge holder positive, ligesom afgifter. VSEPR-teorien siger, at elektronpar, også et sæt lignende ladninger, vil afvise hinanden, således at molekylets form justeres, så valenselektronparene forbliver så langt fra hinanden som muligt.

centralt Atom uden ensomme par
for let at forstå de mulige typer molekyler bruger vi et simpelt system til at identificere dele af ethvert molekyle.,
a = centralt atom i et molekyle
B = atomer, der omgiver det centrale atom
abonnementer efter B angiver antallet af B-atomer, der er bundet til det centrale A-atom. For eksempel er AB 4 et molekyle med et centralt atom omgivet af fire kovalent bundne atomer. Igen betyder det ikke noget, om disse obligationer er enkelt -, dobbelt-eller tredobbeltobligationer.
AB2: Berylliumhydrid (BeH2)
Berylliumhydrid består af et centralt berylliumatom med to enkeltbindinger til hydrogenatomer. Husk, at det overtræder octet-reglen.,
H-Be-h
i henhold til kravet om, at elektronpar maksimerer deres afstand fra hinanden, vil de to bindingspar i BeH 2-molekylerne arrangere sig på direkte modsatte sider af det centrale Be-atom. Den resulterende geometri er et lineært molekyle, vist i Figur 1 i en” kugle og pind ” – model.

Figur 1. Berylliumhydrid model.
bindingsvinklen fra H-Be-H er 180 because på grund af dens lineære geometri.,
Kuldio .id er et andet eksempel på et molekyle, der falder ind under ab 2-kategorien. Dens Le .is-struktur består af dobbeltbindinger mellem det centrale kulstof og O oxygenygenatomerne (se figur 2).

Figur 2. Kuldio .idbinding.
frastødning mellem de to grupper af fire elektroner (to par), er ikke anderledes end den frastødning af de to grupper af to elektroner (et par) i BeH 2 molekyle. Kuldio .id er også lineær (se figur 3).,

Figur 3. Kuldioxid.
AB3: bortrifluorid (BF3)
bortrifluorid består af et centralt boratom med tre enkeltbindinger til fluoratomer (se figur 4). Boratomet har også en ufuldstændig oktet.
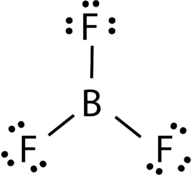
Figur 4. Bortrifluorid binding.
geometrien af BF 3-molekylet kaldes trigonal plan (se figur 5). Fluoratomerne er placeret ved hjørnerne af en ligesidet trekant., F-b-f-vinklen er 120 and, og alle fire atomer ligger i samme plan.

Figur 5. Bor trifluorid model.
AB4: methan (CH4)
methan er en organisk forbindelse, der er den primære komponent i naturgas. Dens struktur består af et centralt carbonatom med fire enkeltbindinger til hydrogenatomer (se figur 6). For at maksimere deres afstand fra hinanden ligger de fire grupper af bindingselektroner ikke i samme plan., I stedet ligger hvert af hydrogenatomerne i hjørnerne af en geometrisk form kaldet en tetrahedron. Carbonatomet er i centrum af tetrahedronen. Hvert ansigt af en tetrahedron er en ligesidet trekant.

Figur 6. Tetrahedral struktur af methan.
metanmolekylets molekylgeometri er tetrahedral (se figur 7). H-C-H-bindingsvinklerne er 109,5., hvilket er større end de 90 that, som de ville være, hvis molekylet var plan., Når man tegner en strukturformel for et molekyle, såsom methan, er det fordelagtigt at være i stand til at indikere den tredimensionelle karakter af dens form. Strukturformlen nedenfor kaldes en perspektivtegning. Den stiplede linjebinding skal visualiseres som tilbagegående ind på siden, mens den faste trekantbinding skal visualiseres som kommer ud af siden.

Figur 7. Metan perspektiv model.
hvordan kan alle disse tøj passe ind i et så lille rum?,
Når vi rejser, tager vi ofte meget flere ting, end vi har brug for. Forsøger at passe det hele i en kuffert kan være en reel udfordring. Vi er muligvis nødt til at pakke eller bare klemme det hele ind. Atomer skal ofte omarrangere, hvor elektronerne er for at skabe en mere stabil struktur.

centralt Atom med et eller flere ensomme par
molekylernes molekylære geometrier ændres, når det centrale atom har et eller flere ensomme par elektroner., Det samlede antal elektron par, både limning par og enlige par, fører til, hvad der kaldes elektron domæne geometri. Når et eller flere af bindingsparene af elektroner erstattes med et ensomt par, ændres molekylets molekylære geometri (faktiske form). I overensstemmelse med A-og B-symbolerne, der er etableret i det foregående afsnit, bruger vi E til at repræsentere et ensomt par på det centrale atom (a). Et abonnement vil blive brugt, når der er mere end et enkelt par. Enlige par på de omgivende atomer (B) påvirker ikke geometrien.,
AB3E: ammoniak, NH3
ammoniakmolekylet indeholder tre enkeltbindinger og et enkeltpar på det centrale nitrogenatom (se figur 8).

Figur 8. Enlige par elektroner i ammoniak.
domænegeometrien for et molekyle med fire elektronpar er tetrahedral, som det blev set med CH 4 . I ammoniakmolekylet er et af elektronpar et ensomt par snarere end et bindingspar. Den molekylære geometri af NH 3 kaldes trigonal pyramidal (se figur 9).,

Figur 9. Ammoniak molekyle.
Husk, at bindingsvinklen i det tetrahedrale CH 4-molekyle er 109, 5.. Igen komprimerer udskiftningen af et af de bundne elektronpar med et ensomt par vinklen lidt. H-N-H-vinklen er cirka 107..
AB2E2: vand, H2O
et vandmolekyle består af to bindingspar og to ensomme par (se figur 10).

Figur 10. Lone par elektroner på vand.,
hvad angår methan og ammoniak, er domænegeometrien for et molekyle med fire elektronpar tetrahedral. I vandmolekylet er to af elektronparrene ensomme par snarere end bindingspar. Vandmolekylets molekylære geometri er bøjet. H-O-H bindingsvinklen er 104,5°, hvilket er mindre end bindingsvinklen i NH3 (se figur 11).

Figur 11. Vandmolekyle.,
AB4E: Svovltetrafluorid, SF4
Le .is-strukturen for SF 4 indeholder fire enkeltbindinger og et ensomt par på svovlatomet (se figur 12).

Figur 12. Enlige par elektroner i SF4.
svovlatomet har fem elektrongrupper omkring det, hvilket svarer til den trigonale bipyramidale domænegeometri, som i PCl 5 (se figur 13). Husk, at den trigonale bipyramidale geometri har tre ækvatoriale atomer og to aksiale atomer fastgjort til det centrale atom., På grund af den større afstødning af et ensomt par er det et af de ækvatoriale atomer, der erstattes af et ensomt par. Molekylets geometri kaldes en forvrænget tetrahedron eller vippe.

Figur 13. Bold og stok model til SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- tilstedeværelsen af ensomme parelektroner påvirker molekylets tredimensionelle form.
Øv
Central-Atom med Ingen Enlige Par
Brug linket nedenfor til at besvare følgende spørgsmål:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Hvad er formen PF 5 ?
- hvilke C-H bod vinkler ville vi forudsige for metan, hvis molekylet var plant?
- hvilket molekyle har konfigurationen af en oktaeder?,
Central-Atom med En eller Flere Enlige Par
Brug linket nedenfor til at besvare følgende spørgsmål:
- Hvad er det generelle princip i forbindelse med molekyler, der indeholder mere end fire elektron-par?
- på billedet med fem elektronpar omkring det centrale atom, hvorfor foretrækkes arrangementet til højre?
- på billedet med seks elektronpar, hvorfor er konfigurationen med de ensomme par ved 180o til hinanden mere stabil?,
anmeldelse
centralt Atom uden ensomme par
- hvad er bindingsvinklerne i kuldio ?id?
- hvilket molekyle har bindingsvinkler på 109,5??
- hvad er geometrien af BF 3-molekylet?
centralt Atom med et eller flere ensomme par
- Hvorfor har vand en bøjet geometri?
- Hvorfor er ammoniak ikke et plant molekyle?
- hvordan ville vi skrive konfigurationen for tetraenontetrafluorid ved hjælp af ABE-systemet?















