Sådan Influenza (Influenza) Vacciner, der Er Lavet
- Æg-Baseret Influenza Vacciner
- Celle-Baseret Influenza Vacciner
- Rekombinant Influenza Vacciner
i Usa er der tre forskellige influenza-vaccine produktion teknologier, der er godkendt af den AMERIKANSKE Food and Drug Administration (FDA)eksterne ikon:
- æg-baseret vaccine mod influenza,
- celle-baseret vaccine mod influenza, og
- rekombinant vaccine mod influenza.,
alle kommercielt tilgængelige influen .avacciner i USA fremstilles af producenter i den private sektor. Forskellige producenter bruger forskellige produktionsteknologier, men alle influen .avacciner opfylder FDA ‘ s sikkerheds-og effektivitetskrav. Forskellige vacciner har forskellige indikationer. Se Influen Vaccinesavacciner-USA, 2019-2020 Influen .asæson for specifikke indikationer.
ægbaserede Influen .avacciner
den mest almindelige måde, hvorpå influen .avacciner fremstilles, er at bruge en ægbaseret fremstillingsproces
, der har været brugt i mere end 70 år., Ægbaseret vaccinefremstilling bruges til at fremstille både inaktiveret (dræbt) vaccine (normalt kaldet “influen .a skud”) og levende svækket (svækket) vaccine (normalt kaldet “næsespray influen .avaccine”).
ægget-baseret produktion proces, der begynder med CDC eller andet laboratorium, der er partner i WHO Global Influenza Surveillance og Svar Ordning, der giver private sektor producenter med kandidat-vaccine-virus (CVVs) dyrkes i æg per aktuelle FDA lovgivningsmæssige krav., Disse cvv ‘ er injiceres derefter i befrugtede hønseæg og inkuberes i flere dage for at give virusserne mulighed for at replikere. Væsken indeholdende virus høstes fra æggene. For inaktiverede influen .avacciner (dvs.influen .a skud) inaktiveres vaccinevirus derefter (dræbt), og virusantigenet renses. Fremstillingsprocessen fortsætter med kvalitetstest, påfyldning og distribution. For næsesprayinfluen .avaccinen (dvs.den levende svækkede influen .avaccine – LAIV) er de startende cvv ‘ er levende, men svækkede vira, der gennemgår en anden produktionsproces., FDA tester og godkender alle influen .avacciner inden frigivelse og forsendelse.
Der er flere forskellige producenter, der bruger denne produktionsteknologi til at fremstille influen .avacciner til brug i USA. Denne produktionsmetode kræver et stort antal kyllingæg for at producere vaccine og kan tage længere tid end andre produktionsmetoder.
cellebaserede Influen .avacciner
Der er også en cellebaseret produktionsproces for influen .avacciner, der blev godkendt af FDA i 2012. Indtil for nylig begyndte denne produktionsproces også med ægvoksede cvv ‘ er pr., Den 31. August 2016 udstedte FDA imidlertid en godkendelse af Se .irus, den eneste FDA-godkendte cellebaserede influen .avaccineproducent i USA, for at begynde at bruge celledyrkede cvv ‘ er. Cellebaseret fremstilling bruges til at fremstille inaktiverede influen .avacciner (f.eks.
processen med at skabe cellebaserede influen .avacciner involverer flere trin. Først bruger CDC eller en af dets laboratoriepartnere influen .avirus, der er dyrket i celler til at fremstille cvv ‘ er, som derefter leveres til en vaccineproducent., Derefter inokulerer vaccineproducenten cvv ‘erne i dyrkede pattedyrceller (i stedet for i æg) og giver cvv’ erne mulighed for at replikere (dvs.lave kopier) i et par dage. Derefter opsamles den virusholdige væske fra cellerne, og virusantigenet renses. Fremstillingsprocessen fortsætter med rensning og testning. Endelig tester og godkender FDA vaccinerne inden frigivelse og forsendelse.
cellebaseret influen .avaccineproduktion kræver ikke kyllingæg, fordi de vaccinevirus, der bruges til at fremstille vaccine, dyrkes i dyreceller., Cellebaseret teknologi har også potentialet for en hurtigere opstart af influen .avaccinfremstillingsprocessen.
mens vira, der blev brugt i tidligere sæsons cellebaserede vaccine, er blevet dyrket i celler, var nogle af de vira, der blev leveret til producenten, oprindeligt afledt i æg før sæsonen 2019-2020. I influen .asæsonen 2019-2020 er alle fire influen .avirus, der bruges i den cellebaserede vaccine, celleafledt, hvilket gør vaccinen ægfri.
For mere information, se CDC ‘ s cellebaserede Influen .avacciner weebside.,
Rekombinant Influenza Vacciner
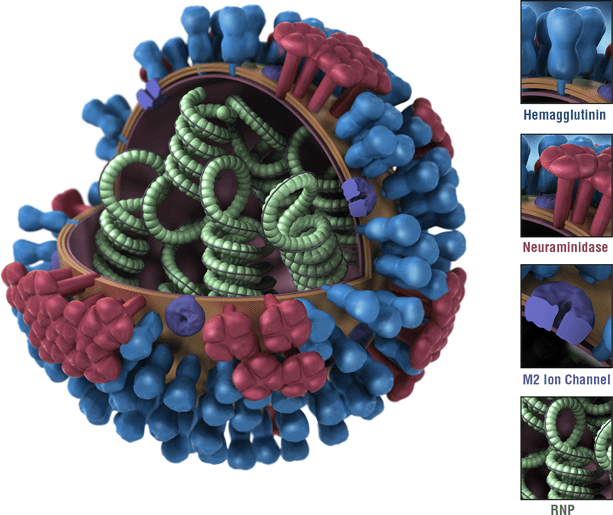
Dette er et billede af en influenza-virus. Virussens hæmagglutinin (HA) overfladeproteiner er afbildet i blåt. Har af en influen virusavirus er antigener. Antigener er træk ved influen .avirus, der genkendes af immunsystemet, og som udløser et beskyttende immunrespons. De fleste influen .avacciner er designet til at udløse et immunrespons mod HAs af cirkulerende influen .avacciner.,
Der er en tredje produktionsteknologi til influen .avacciner, der blev godkendt til brug på det amerikanske marked i 2013, og som involverer anvendelse af rekombinant teknologieksternt ikon. Rekombinante influen .avacciner kræver ikke at have en kandidatvaccine virus (CVV) prøve til at producere. I stedet skabes rekombinante vacciner syntetisk. For at fremstille en rekombinant vaccine får influen .aforskere først DNA, dvs.genetiske instruktioner, til fremstilling af et overfladeprotein kaldet hæmagglutinin (HA) fundet på influen .avirus., HA er et antigen, som er et træk ved en influen .avirus, der udløser det menneskelige immunsystem til at skabe antistoffer, der specifikt er målrettet mod virussen. Dette DNA til fremstilling af influen .avirus HA-antigen kombineres derefter med et baculovirus, en virus, der inficerer hvirvelløse dyr. Dette resulterer i en “rekombinant” virus. Baculovirus rolle er at hjælpe med at transportere DNA-instruktionerne til fremstilling af influen .avirus HA-antigen til en værtscelle. Når den rekombinante virus kommer ind i en food and Drug Administration (FDA) kvalificeret værtscellelinje, instruerer den cellerne til hurtigt at producere HA-antigenet., Dette antigen dyrkes i bulk, opsamles, renses og pakkes derefter som rekombinant influen .avaccine. Disse vacciner testes derefter kvalitet og styrke af FDA, inden FDA godkender frigivelse af vaccinepartierne til offentligheden.
denne produktionsmetode kræver ikke en ægvokset vaccinevirus og bruger slet ikke kyllingæg i produktionsprocessen. Mens der er andre vacciner på det amerikanske marked, der bruger lignende rekombinante fremstillingsprocesser, er der kun en influen .avaccine produceret ved hjælp af rekombinant teknologi, der er godkendt af FDA til brug i USA på dette tidspunkt., Denne produktionsproces er den hurtigste, fordi den ikke er begrænset af udvælgelsen af vaccinevirus, der er tilpasset til vækst i æg eller udvikling af cellebaserede vaccinevirus.
CDC og FDA overvåger sikkerheden for alle vacciner, der er licenseret i USA, herunder sæsonbestemte influen .avacciner. Mere information om sikkerheden af æg-baseret, celle-baseret og rekombinant influenza, herunder bivirkninger, kontraindikationer og forholdsregler, screening, og sikker vaccine administration er tilgængelige på Sæsonbestemt Influenza Vaccine Sikkerhed: En Oversigt for Klinikere.,
- udviklingen og Revolutionen af Influen .avaccinereksternt ikon på US Food and Drug administrations websiteebsted.
- Influen flua Vaccine Forskningeksternt ikon på National Institute of Allergy and Infectious Diseases Institute, NIH hjemmeside.
- fremskridt med Influen Vaccineavaccine















