Frontiers in Plant Science (Español)
Introducción
la correcta progresión de la maduración de la fruta es esencial para lograr tanto una óptima calidad de la fruta como una larga vida útil, rasgos importantes que determinan los mercados de precios y los beneficios finales. Sin embargo, la maduración es un proceso complejo en el que intervienen muchos factores, incluido el control hormonal, que regula los cambios bioquímicos y fisiológicos que confieren propiedades organolépticas y nutricionales finales a la fruta., Tradicionalmente, los frutos carnosos se han clasificado de acuerdo con su proceso de maduración en frutos climatéricos y no climatéricos. Las frutas climatéricas como los tomates o los plátanos requieren un aumento en la tasa de respiración y la producción de etileno para desencadenar el proceso de maduración en una respuesta autocatalítica (Barry y Giovannoni, 2007; Liu et al., 2015)., Antagónicamente, las frutas no climatéricas como los cítricos o las uvas no exhiben una explosión ni en el etileno ni en la respiración antes del inicio de la maduración, y en estas frutas, la maduración está controlada principalmente por la acumulación progresiva del ácido abscísico fitohormona (ABA; Rodrigo et al., 2006; Castellarin et al., 2011). Sin embargo, nuevos estudios están reforzando la idea de que el proceso de maduración no solo se rige por la producción de una fitohormona, sino que parece ser el resultado de un equilibrio hormonal controlado (Symons et al., 2012; Teribia et al., 2016; Li et al., 2019).,
las auxinas, el ácido salicílico (SA) y la melatonina son fitohormonas involucradas en la señalización y regulación de muchos procesos cruciales en las plantas. Las auxinas han sido ampliamente descritas como reguladores de crecimiento y desarrollo con múltiples funciones en las plantas(ver Taylor-Teeples et al., 2016); el SA desencadena la respuesta de defensa contra patógenos biotróficos y hemi-biotróficos (Loake y Grant, 2007), además de tener un papel importante bajo estrés abiótico (Dong et al., 2014; Wani et al., 2017), floración y control del ciclo celular (Carswell et al., 1989; Eberhard et al.,, 1989, respectivamente); y no solo se ha encontrado que la melatonina tiene funciones similares a las auxinas (Chen et al., 2009; Zuo et al., 2014; Wen et al., 2016), pero también se ha sugerido que actúa como un antioxidante potencial en algunas plantas (Arnao y Hernández-Ruiz, 2015) y un regulador de las respuestas de las plantas a los patógenos (Chen et al., 2018). Curiosamente, estas tres hormonas comparten un precursor común-el corismato -, por lo que se produce una conversación metabólica cruzada entre ellas, y una serie de genes deben regularse finamente para desviar el metabolismo del corismato hacia estos compuestos., Durante los últimos años, varias revisiones han abordado la biosíntesis y el papel de la auxina (Paul et al., 2012), SA (Asghari y Aghdam, 2010) y melatonina (Feng et al., 2014; Arnao y Hernández-Ruiz, 2018) en frutas. Sin embargo, su biosíntesis y funciones se han descrito en su mayoría por separado. Aquí, discutiremos los aspectos comunes y diferenciales de la biosíntesis, metabolismo y función de auxina, SA y melatonina en el crecimiento y maduración de frutos climatéricos y no climatéricos., Se hará hincapié en los puntos clave de la desviación metabólica en su biosíntesis del corismato, el papel regulador durante la maduración de frutos climatéricos y no climatéricos, y su papel en la modulación de la biosíntesis de compuestos bioactivos, que determina en gran medida la calidad de la fruta.
fitohormonas derivadas del Corismato
El Corismato es el producto final de la vía del shikimato y desempeña un papel clave en la biosíntesis de las fitohormonas (Figura 1)., El corismato da lugar a aminoácidos aromáticos, incluido el triptófano, y a través de varias reacciones, incluida la conversión del triptófano en ácido indol-3-pirúvico por la triptófano aminotransferasa (TA); puede generar la auxina indol-3-ácido acético (IAA). La TA ha sido propuesta como una enzima clave universal para la biosíntesis del AIA no solo en órganos vegetativos(Enríquez-Valencia et al., 2018) pero también en el desarrollo de los órganos reproductivos (Reyes-Olalde et al., 2017), incluyendo el crecimiento y maduración de la fruta (Estrada-Johnson et al., 2017)., Por el contrario, cuando se activa la isocorismato sintasa (ICS), el corismato se puede convertir en isocorismato y este último se puede transformar en SA. A pesar de que esta vía se identificó por primera vez en bacterias, actualmente también está bien establecida en plantas (Wildermuth et al., 2001; Uppalapati et al., 2007; Catinot et al., 2008; Garcion et al., 2008; Abreu y Munné-Bosch, 2009). Finalmente, el triptófano puede convertirse en triptamina por la enzima triptófano descarboxilasa (TDC)., Aunque esta es otra de las múltiples rutas de biosíntesis del AIA (la triptamina se convierte en indol-3-acetaldehído y más tarde en AIA), también se ha propuesto que la TDC sea la primera enzima limitadora de velocidad en la vía de la melatonina (Kang et al., 2007). La TDC fue identificada por primera vez en la familia Apocynaceae (De Luca et al., 1989) para ser descrito posteriormente en una serie de sistemas de plantas (Byeon et al., 2012, 2014; Zhao et al., 2013; Wei et al., 2018)., Después de la descarboxilación, la triptamina es convertida en serotonina por la triptamina-5-hidroxilasa, y luego la serotonina se transforma en N-acetil-serotonina para finalmente producir melatonina en el citosol (Figura 1).
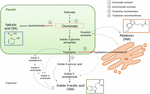
la Figura 1. Biosíntesis de ácido indol-3-acético (IAA), ácido salicílico (SA) y melatonina (Mel) a partir de corismato. Los tres compuestos comparten un precursor final común (corismato, cuadrado en naranja) de la vía del shikimato., Los principales puntos de desviación se indican con flechas rojas y las enzimas correspondientes se numeran en un orden de divergencia de descenso desde shikimate. Las flechas punteadas en negrita indican más de un paso entre los compuestos. Las flechas punteadas delgadas indican caminos que aún no están bien definidos.
recientemente se han identificado enzimas desviadoras clave que conducen a la síntesis de las hormonas de la vía del corismato en frutos carnosos (Figura 1). CI, cuya expresión ha demostrado ser crucial para la tolerancia al estrés biótico (Garcion et al.,, 2008; Zeng Y He, 2010), ha sido identificado en tomates y manzanas. Zhu et al. (2016) reportaron la sobreexpresión de ICS1 (isocorismato sintasa 1) en condiciones de almacenamiento en frío en tomate, mientras que Zhang et al. (2017) encontraron la activación de un factor de transcripción involucrado en la vía de señalización de SA relacionada con patógenos que induce la expresión de CI en manzanas. Se ha informado que se produce una mayor actividad de TDC en la fruta de la pimienta inmadura tras la infección por patógenos, a través del aumento de la expresión de TDC1 y TDC2 (Park et al., 2013) – y en la etapa de crecimiento en fruta de morera (Wang et al., 2016)., Finalmente, se ha identificado TA en vid, tanto en pre-y véraison (Böttcher et al., 2013; Gouthu y Deluc, 2015, respectivamente) así como durante la maduración de la fresa (Estrada-Johnson et al., 2017). Cabe señalar, sin embargo, que los genes y enzimas descritos en frutas climatéricas (es decir, ICS) no se han identificado en frutas no climatéricas (es decir, TDC y TA) y viceversa; por lo tanto, es imperativo realizar más estudios para llenar estas lagunas de conocimiento y comprender mejor cómo estos puntos de desviación se regulan conjuntamente durante la maduración de la fruta.,
El papel de las fitohormonas derivadas del Corismato en las frutas climatéricas y no climatéricas
desentrañar los mecanismos del desarrollo de la fruta ha sido uno de los principales desafíos en la investigación Agronómica reciente por sus implicaciones económicas. En este contexto, las fitohormonas se han señalado como impulsores responsables de la maduración de la fruta, especialmente el etileno y el ABA en frutas climatéricas y no climatéricas, respectivamente. Sin embargo, que estas fitohormonas pudieran regular el desarrollo de la fruta por sí solas pronto se demostró que era demasiado simple., Después de una extensa investigación y con la mejora en la química analítica y las técnicas moleculares, varias otras hormonas se han confirmado como reguladores potenciales del desarrollo y la maduración de la fruta, incluidas las fitohormonas derivadas del corismato.
auxinas dialogan con otras hormonas durante el cuajado, crecimiento y maduración de la fruta
las auxinas son un grupo de hormonas vegetales que desempeñan un papel esencial en el desarrollo de la fruta, ejerciendo su propia influencia y modulando la expresión de otras fitohormonas., Los contenidos endógenos de AIA son particularmente altos en el cuajado y durante las etapas iniciales de desarrollo del crecimiento, después de lo cual las cantidades de AIA tienden a disminuir antes del inicio de la maduración, tanto en climaterio (Zaharah et al., 2012) y frutas no climatéricas (Symons et al., 2012; Teribia et al., 2016), con algunas excepciones aparentemente, como los melocotones (Tatsuki et al., 2013) y algunas variedades de ciruela (el-Sharkawy et al., 2014; gráfico 2A). Se ha demostrado que el AIA está involucrado en la iniciación del cuajado de frutas en combinación con giberelinas (Mezzetti et al., 2004; Serrani et al., 2010; Bermejo et al., 2018; Hu et al.,, 2018). El deterioro de la biosíntesis o señalización del AIA generalmente conduce a la partenocarpia de la fruta, aunque también puede resultar en una maduración anormal en algunas frutas (Wang et al., 2005; Liu J. et al., 2018; Reig et al., 2018). Los altos contenidos de AIA en las etapas iniciales del desarrollo del fruto promueven el crecimiento del fruto debido a la implicación de auxinas en la división celular en combinación con citoquininas y en el control de la expansión celular en combinación con giberelinas (Liao et al., 2018)., Durante este período, La interferencia hormonal entre auxinas y giberelinas, además, permite la conformación normal de la fruta en una regulación afinada mediada por factores de Respuesta de auxinas (ARFs; Liao et al., 2018; Liu S. et al., 2018).
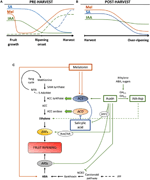
la Figura 2. Papel de IAA, SA y Mel durante el desarrollo de frutos climatéricos y no climatéricos. Modelo que resume las interacciones de IAA, SA y Mel durante la maduración de frutos climatéricos y no climatéricos durante (a) pre – y (B) post-cosecha., Las líneas discontinuas indican la dinámica alternativa del contenido de fitohormona en algunas frutas (ver texto para discusión). C) panorama general de la interacción del AIA, el SA y el Mel con la biosíntesis de etileno y ácido abscísico (ABA) en frutas climatéricas y no climatéricas. La auxina es un regulador positivo de la biosíntesis de etileno por la activación de los genes de la sintasa ACC (ACS) e induce la expresión de los factores de Respuesta de etileno (ERFs). La auxina también reprime la producción de ABA mediante la represión de la dioxigenasa 9-cis-epoxicarotenoide (NCED) e inhibe los genes de estrés que responden a ABA (ARS) Por la proteína ARF2., Los contenidos endógenos de IAA pueden ser reducidos por proteínas GH3, cuya síntesis es promovida por etileno, ABA y azúcares. La línea discontinua indica el posible papel de IAA por IAA-Asp como un factor de maduración que mejora el etileno en algunas frutas. La melatonina mejora la producción de ABA y etileno, aunque el ACS puede inhibirse dependiendo del contenido de melatonina. La SA actúa como un inhibidor de los genes de la ACC oxidasa (ACO) que reprimen el etileno, aunque puede promover la expresión de la ACS., MTA, 50-metiltioadenosina; s-AdoMet, S-adenosil-metionina; SAM sintasa, S-adenosil-metionina sintasa; ACC, ácido 1-aminociclopropano-1-carboxílico; IPP, difosfato de isopentenilo.
se ha informado que las reducciones del contenido endógeno de AIA ocurren antes del inicio de la maduración en varios frutos. Estas reducciones se han relacionado con la conjugación de IAA con ácido aspártico (IAA-Asp) por IAA-amido sintetasas, GH3-1 y GH3-2 (Figura 2C)., De hecho, GH3-1 y GH3-2 mostraron una mayor expresión durante el desarrollo temprano de la fruta y más particularmente durante el inicio de la maduración, tanto en frutas climatéricas, como los tomates (Sravankumar et al., 2018) y manzanas (Onik et al., 2018), así como en frutas no climatéricas, como bayas de uva (Böttcher et al., 2010, 2011) y frambuesas (Bernales et al., 2019)., Curiosamente, las bayas de uva mostraron una mayor expresión de GH3-1 después de la aplicación de ABA y etefón, lo que podría explicar la participación del etileno en el control del contenido de AIA después del inicio de la maduración, incluso en frutas no climatéricas (Böttcher et al., 2010). De hecho, varios estudios destacan la estrecha interacción entre auxinas y etileno en la maduración del fruto, con una influencia recíproca entre ellas (Tadiello et al., 2016a; Busatto et al., 2017)., Para los frutos climatéricos, el aumento del contenido de AIA es necesario para activar la expresión de los genes de la ACC sintasa (ACS), que codifican la ACC sintasa, lo que, a su vez, conducirá a la producción de etileno desencadenando el proceso de maduración (figura 2C; Tatsuki et al., 2013). Frutas como los tomates (Li et al., 2016) o bananas (Choudhury et al.,, 2008), que por lo general experimentan una reducción del contenido de AIA antes del inicio de la maduración, muestran un retraso de maduración cuando AIA o análogos se aplican exógenamente, mientras que frutas como los melocotones, cuyo contenido de AIA aumenta progresivamente hasta madurar completamente, muestran una maduración acelerada cuando se aplican auxinas (Tadiello et al., 2016b). Por lo tanto, debe existir una regulación estricta, compleja y diferencial de las interacciones auxina-etileno en varios frutos durante la maduración previa a la cosecha., Además, el contenido de AIA disminuye antes del inicio de la maduración en algunos frutos no climatéricos para des-reprimir la 9-cis-epoxicarotenoide dioxigenasa (NCED) e iniciar la síntesis de ABA (figura 2C; Jia et al., 2016). Curiosamente, este proceso también está mediado por la conjugación de IAA a través de una mayor actividad GH3-1 (Böttcher et al., 2010). Sin embargo, Estrada-Johnson et al. (2017) mostraron que, aunque el contenido de IAA disminuye durante la maduración de la fresa, la expresión de las familias de genes FaAux/IAA y FaARF se induce en los receptáculos rojos, lo que sugiere la participación de la señalización auxina en frutos completamente maduros.,
durante la postcosecha, el contenido de auxinas generalmente permanece invariante o tiende a disminuir debido a procesos oxidativos que pueden dar lugar a pequeñas, pero progresivas reducciones en el contenido endógeno de AIA (figura 2b). Los tratamientos con auxinas después de la cosecha retrasan la sobre-maduración en algunas frutas (Chen et al., 2016; Moro et al., 2017) y aumentar el contenido de algunos ácidos orgánicos, manteniendo la acidez de la fruta (Li et al., 2017), lo que sugiere que la auxina también juega un papel importante en el control de la maduración de la fruta durante la postcosecha.,
múltiples funciones del ácido salicílico durante el desarrollo y maduración de la fruta
El ácido salicílico es otra fitohormona derivada del corismato que se ha relacionado principalmente con su efecto protector bajo estrés biótico para controlar las pérdidas antes de la cosecha y después de la cosecha derivadas de la infección por patógenos de la fruta (Babalar et al., 2007; Cao et al., 2013). En general, el contenido endógeno de SA libre es mayor al comienzo del desarrollo del fruto y luego disminuye progresivamente (Oikawa et al., 2015). Lu et al. (2015) reportaron un aumento secundario en la SA durante la segunda fase de crecimiento de frutas de melocotón., La aplicación exógena de SA en plátanos retrasó el proceso de maduración reduciendo la ráfaga respiratoria y la relación pulpa / cáscara, así como la disminución de la actividad de enzimas relacionadas con la degradación de la pared celular y el sistema antioxidante (Srivastava y Dwivedi, 2000). Además, el tratamiento de cerezos dulces con ácido salicílico y acetilsalicílico (AAS) mejoró el peso, la firmeza y el color de las cerezas en la etapa comercial (Giménez et al., 2014). La aplicación exógena de SA o salicilato de metilo (MeSA) durante la post-cosecha, retrasó la sobre-maduración en frutas como kiwis (Zhang et al.,, 2003), y cerezas dulces (Valero et al., 2011). Además, los tratamientos con salicílico o AAS aliviaron la lesión escalofriante de las granadas (Sayyari et al., 2011), tomates (Aghdam et al., 2014), y aguacates (Glowacz et al., 2017). SA también interactúa con etileno a través de la inhibición de la expresión de ACC oxidasa (ACO) (Shi y Zhang, 2012). Sorprendentemente, el aumento del contenido de expresión de SCA en las peras también se encuentra después de la aplicación de SA de una manera regulada por dosis (Shi et al., 2013; Shi y Zhang, 2014). Por lo tanto, la regulación de la producción de etileno dependiente de SA está finamente regulada (figura 2C).,
melatonina: un regulador emergente para el Control del desarrollo del fruto
La melatonina es también una hormona vegetal de la vía derivada del corismato que ha ganado mucha atención en los últimos años (Hernández-Ruiz et al., 2005; Arnao y Hernández-Ruiz, 2018; Sharif et al., 2018). Recientemente, la melatonina se ha señalado como un factor importante para el cuajado de la fruta, de manera similar a los efectos del AIA (figura 2a; Liu S. et al., 2018). Además, se ha observado la producción circadiana de esta fitohormona (Kolář et al., 1997)., Durante la maduración en el árbol, las uvas tratadas con melatonina mostraron una mayor sincronicidad y un mayor peso cuando maduran completamente (Meng et al., 2015). Además, otro estudio reciente de Xu et al. (2018) describieron que la melatonina podría promover la maduración de la baya de la uva a través de su interacción con ABA y etileno, así como el peróxido de hidrógeno. Se ha demostrado que la melatonina confiere tolerancia al enfriamiento durante el almacenamiento en frío de la fruta, lo que parece estar principalmente relacionado con su actividad antioxidante (Cao et al., 2018; Aghdam et al., 2019)., Durante la poscosecha, los tomates mostraron un aumento de la emisión de etileno después de la aplicación de melatonina a 50 µM (Sun et al., 2015), a diferencia de las peras, donde la aplicación exógena de melatonina a 100 µM inhibió la producción de etileno (Zhai et al., 2018), o frutas de plátano, donde la melatonina a 50-200 µM inhibió la expresión de ACS y ACO (figura 2C; Hu et al., 2017). Aunque los diferentes efectos de la aplicación de melatonina pueden estar relacionados con un efecto de dosificación, se necesita más investigación para comprender mejor el papel de la melatonina en el control del desarrollo de la fruta.,
conversación cruzada de fitohormonas derivadas de Corismato en el Control del desarrollo de la fruta
se ha demostrado que la interferencia Hormonal entre las fitohormonas derivadas de corismato ocurre durante el desarrollo y la maduración de la fruta. Breitel et al. (2016) encontraron que las auxinas pueden interactuar con SA a través de ARF2 (figura 2c) y que la sobreexpresión de ARF2 en el tomate resultó en un menor contenido de SA y un retraso significativo de maduración., Esto indica que las auxinas podrían estar limitando la producción de SA durante el desarrollo del fruto, lo que podría explicar una compensación entre el crecimiento del fruto (mediado por auxina) y la activación de las defensas bióticas (mediada por SA). Además, la aplicación exógena de SA en frutas de papaya resultó en una expresión alterada de varios genes IAA, algunos de ellos siendo regulados hacia abajo mientras que otros regulados hacia arriba (Liu et al., 2017)., En este caso, los resultados no fueron concluyentes de lo que realmente ocurre endógenamente en la supuesta conversación cruzada entre auxina y SA durante la maduración de la fruta y se requiere más investigación en esta y otras frutas climatéricas. En cualquier caso, está claro que el AIA y el SA están estrechamente relacionados, no solo metabólicamente sino también funcionalmente. Finalmente, varios estudios han reportado la influencia de la melatonina en la biosíntesis y/o señalización de AIA y SA (revisados en Arnao y Hernández-Ruiz, 2018), aunque hasta donde sabemos, ninguno de estos estudios se realizó ni en frutos climatéricos ni en frutos no climatéricos.,
modulación de compuestos bioactivos biosíntesis por fitohormonas derivadas de Corismato
los compuestos bioactivos (incluyendo compuestos fenólicos, isoprenoides y vitaminas antioxidantes) no solo han sido ampliamente investigados como responsables de propiedades organolépticas específicas de los alimentos, sino también por sus efectos protectores en las células humanas contra los procesos oxidativos en el desarrollo de enfermedades neurodegenerativas y cardiovasculares y cierto tipo de cáncer (Liu et al., 1999; Mueller et al., 2010; Sturgeon y Ronnenberg, 2010; Björkman et al., 2011)., Los compuestos fenólicos contribuyen significativamente a impartir sabores específicos, como los taninos, responsables del sabor amargo o astringente de ciertas frutas, y los colores, como los pigmentos de antocianina, responsables de los colores rojos, azules y púrpuras de las frutas (Croteau et al., 2000). La relevancia de los compuestos fenólicos para el consumo humano se ha asociado con un efecto protector contra los procesos oxidativos en relación con la salud cardiovascular y del sistema nervioso central, así como con un menor riesgo de cánceres del tracto gastrointestinal (Björkman et al., 2011)., Los carotenoides, tetraterpenos pertenecientes a los isoprenoides, juegan un papel en la protección contra los procesos foto-oxidativos y como pigmentos orgánicos; son responsables del color amarillo anaranjado de los frutos (Tapiero et al., 2004). Se cree que los carotenoides dietéticos proporcionan beneficios para la salud al disminuir el riesgo de enfermedades oculares y ciertos tipos de cáncer debido a su papel como antioxidantes (Johnson, 2002). Las vitaminas C y E, incluyendo el ácido ascórbico y los tocoferoles, respectivamente, son factores de calidad nutricional esenciales en frutas con muchas actividades biológicas en humanos (Miret y Müller, 2017)., Teniendo en cuenta el papel relevante de todos estos compuestos bioactivos como compuestos promotores de la salud en los frutos, la modulación de su acumulación es de suma importancia tanto en frutos climatéricos como no climatéricos (Vasconsuelo y Boland, 2007). La mayoría de estos compuestos bioactivos se acumulan en altos niveles durante la maduración de la fruta, cuando las frutas verdes menos sabrosas convergen en una fruta nutricionalmente rica, coloreada y sabrosa (Daood et al., 1996; Ranalli et al., 1998; Dumas et al., 2003; Singh et al., 2011)., Sin embargo, una vez iniciada, la maduración no puede detenerse y generalmente conduce a una maduración excesiva que afecta negativamente la calidad de la fruta (Kumar et al., 2014). Por lo tanto, minimizar el deterioro de la fruta después de la cosecha mientras se obtiene un alto contenido de compuestos bioactivos sigue siendo uno de los mayores desafíos a resolver.
la auxina ha sido identificada como un importante regulador de la biosíntesis de carotenoides durante la maduración de frutos de tomate climatéricos. La maduración en el tomate está asociada con la degradación de la clorofila y el cambio de xantofilas a carotenos (β-caroteno y licopeno) (Fraser et al., 1994)., IAA parece retrasar la maduración del tomate al reprimir el etileno y varias transcripciones de carotenoides aguas arriba, incluyendo Psy, Ziso, Pds, Critiso, así como las Clasas 1-3 y, por otro lado, promover la acumulación de transcripciones β-Lyc1 y Crtr-β1, lo que resulta en un mayor contenido de xantofilas y clorofila a (Su et al., 2015). Además, en algunas frutas no climatéricas como la cereza y las bayas de uva, la auxina también parece modular la biosíntesis de antocianinas y, por lo tanto, controlar los procesos de maduración de la fruta. Teribia et al., (2016) reportaron una correlación negativa entre el AIA y el contenido de antocianina, lo que indica que la acumulación de antocianina comienza cuando el contenido de AIA disminuye. Además, la aplicación del compuesto sintético Tipo auxina benzotiazol-2-ácido oxiacético (BTOA) retrasó la regulación ascendente de genes que promueven enzimas de la biosíntesis de antocianinas como la chalcona sintasa y la UDP-glucosa:flavonoide 3-o-glucosiltransferasa en bayas de uva (Davies et al., 1997).,
Los tratamientos Pre y postcosecha con salicilatos, incluyendo SA y sus derivados ASA y MeSA, han sido reportados para regular la acumulación de compuestos bioactivos que conducen a una mejor actividad antioxidante en frutos climatéricos y no climatéricos. Se sabe que varias frutas como la ciruela, la cereza y los albaricoques tienen una vida corta con un rápido deterioro de la calidad después de la cosecha. Por lo tanto, hay una búsqueda constante de tratamientos que mejoren y mantengan la calidad de la fruta, y especialmente el contenido de compuestos bioactivos con efectos beneficiosos para la salud., Los tratamientos de ciruelas con SA, AAS y MeSA dieron como resultado un contenido significativamente mayor de ácido ascórbico, antocianinas y compuestos fenólicos tanto en la cosecha como después del almacenamiento en frío prolongado (40 días a 4°c; Martínez-Esplá et al., 2017). Se observaron resultados similares para los tratamientos previos a la cosecha con SA, ASA y MeSA en cerezas dulces (Giménez et al., 2014, 2015, 2017). Además, el tratamiento postcosecha con SA, AAS o MeSA mantuvo el contenido fenólico total así como el contenido de antocianinas durante el almacenamiento en frío en Granada (Sayyari et al., 2011), cereza dulce (Valero et al.,, 2011), cornelian cherry (Dokhanieh et al., 2013), y albaricoque (Wang et al., 2015). Estos resultados sugieren que los salicilatos pueden estar involucrados en la activación de la fenilalanina amoníaco liasa, que es la principal enzima involucrada en la vía biosintética de los compuestos fenólicos (Martínez-Esplá et al., 2017).
recientemente, se ha demostrado que la melatonina regula la maduración de la fruta y modula los compuestos bioactivos. Los tratamientos Post-cosecha con melatonina en frutas de melocotón aumentaron la tolerancia al enfriamiento al activar sistemas antioxidantes., La lesión por enfriamiento ocurre en frutas de melocotón durante el almacenamiento a baja temperatura (entre 2 y 7.6°C) caracterizada por el pardeamiento de la carne, la maduración anormal y una mayor sensibilidad a la caries (Lurie y Crisosto, 2005). Cao et al. (2018) informaron que los melocotones tratados con melatonina mostraron una mayor abundancia de transcripción de los genes de biosíntesis de ácido ascórbico PpGME, PpGPP y PpGLDH en el séptimo y PpGMPH en los días 21 y 28 de almacenamiento en comparación con el control, lo que resultó en un aumento del contenido de ácido ascórbico., Además, la melatonina indujo aumentos en las actividades de G6PDH, SKDH y PAL, que son las enzimas esenciales para la biosíntesis de compuestos fenólicos. Los autores sugieren que el tratamiento con melatonina protege a la fruta del melocotón hasta cierto punto de las lesiones por enfriamiento al activar específicamente la biosíntesis de los compuestos fenólicos (Gao et al., 2018). Además, un análisis proteómico diferencial sin etiqueta reveló el efecto de la melatonina en la promoción de la maduración de la fruta y la acumulación de antocianinas después de la cosecha en frutos de tomate (Sun et al., 2016)., Los autores informaron que la melatonina exógena aumentó ocho enzimas relacionadas con la vía de la antocianina, incluyendo, entre otras cosas, flavonol-3-hidroxilasa, flavanona 3 beta-hidroxilasa, antocianidina sintasa/leucoantocianidina dioxigenasa y antocianidina 3-o-glucosiltransferasa. Además, el tratamiento postcosecha con melatonina aumentó los fenoles totales y antocianinas en frutas de fresa (Aghdam y Fard, 2016), y retrasó la pérdida de fenoles totales, flavonoides y antocianinas en frutas litchi (Zhang et al., 2018)., Los tratamientos con melatonina aumentaron el contenido de fenoles, antocianinas y flavonoides en las bayas de uva (Xu et al., 2017). Además, se ha informado que la melatonina mejora la acumulación de licopeno y la producción de etileno en los tomates, lo que sugiere que la melatonina puede aumentar el contenido de licopeno al afectar la biosíntesis y la señalización de etileno (Sun et al., 2015)., La participación del etileno en la regulación inducida por melatonina de compuestos bioactivos también se ha observado en bayas de uva, donde el tratamiento de doble bloque del etileno mostró efectos reducidos de la melatonina sobre el contenido de polifenoles (Xu et al., 2017).
conclusión
se concluye que las fitohormonas derivadas del corismato, incluidas la auxina, la SA y la melatonina, no solo comparten un precursor común, sino que desempeñan un papel esencial en la regulación del crecimiento y la maduración de la fruta., Un cruce metabólico y funcional entre ellos y con otras fitohormonas ocurre de manera espaciotemporal para regular finamente el desarrollo de frutos climatéricos y no climatéricos. Las diferencias en la dinámica dentro de las frutas climatéricas y no climatéricas evidencian que la respuesta de las hormonas derivadas del corismato no es universal, sino fuertemente específica de la especie. Además, las fitohormonas derivadas del corismato también modulan la acumulación de compuestos bioactivos, lo que influye en la calidad de la fruta., Sin embargo, se necesitan más investigaciones para comprender mejor cómo (I) otras hormonas, como el etileno y el ABA, modulan su biosíntesis estudiando los puntos clave de desviación metabólica, (ii) interactúan a nivel funcional y molecular, y (iii) modulan conjuntamente la biosíntesis de compuestos bioactivos y, en consecuencia, influyen no solo en el crecimiento y la maduración de los frutos, sino también en la calidad de los frutos climatéricos y no climatéricos.
contribuciones del autor
SM-B concibió y diseñó la revisión con la ayuda de MP-L. MP-L, PM, MM y SM-B escribieron el manuscrito., MP-l preparó figuras con la ayuda de PM. Todos los autores contribuyeron a la discusión de ideas, revisaron y aprobaron el manuscrito final.
financiación
Este trabajo ha sido financiado por un premio ICREA Academia otorgado a SM-B por la Generalitat de Catalunya.
Declaración de conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.
Böttcher, C., Boss, P. K., and Davies, C. (2011)., Las preferencias del sustrato acil de una IAA-amido sintetasa explican las variaciones en la maduración de la baya de la uva (Vitis vinifera L.) causadas por diferentes compuestos auxínicos, lo que indica la importancia de la conjugación de auxinas en el desarrollo de la planta. J. Exp. Robot. 62, 4267–4280. doi: 10.1093 / jxb / err134
PubMed Abstract / CrossRef Full Text / Google Scholar
Glowacz, M., Bill, M., Tinyane, P. P., and Sivakumar, D. (2017)., Mantener la calidad postcosecha de los aguacates «Hass» almacenados en frío alterando el contenido y la composición de ácidos grasos con el uso de compuestos volátiles naturales: jasmonato de metilo y salicilato de metilo. J. Sci. Alimento. Agric. 97, 5186–5193. doi: 10.1002 / jsfa.8400
PubMed Abstract / CrossRef Full Text / Google Scholar
Zeng, W., and He, S. Y. (2010). A prominent role of the flagellin receptor FLAGELLIN-SENSING2 in mediating stomatal response to Pseudomonas syringae pv tomato DC3000 in Arabidopsis. Fisiol Vegetal. 153, 1188–1198. doi: 10.1104 / PP. 110.,157016
PubMed Abstract | CrossRef Full Text | Google Scholar















