química para no mayores (Español)
objetivos de aprendizaje
- describir moléculas cuyas formas están influenciadas por la teoría VSEPR.
- Definir par solitario.
- describir cómo los electrones de par solitario influyen en la geometría molecular.
¿cómo funciona un electroscopio?
un electroscopio es un dispositivo utilizado para estudiar la carga. Cuando un objeto cargado positivamente (la varilla) se acerca al poste superior, los electrones fluyen hacia la parte superior del frasco dejando las dos hojas de oro cargadas postivley., Las hojas se repelen unas a otras ya que ambas sostienen posiciones, como cargas. La teoría de VSEPR dice que los pares de electrones, también un conjunto de cargas similares, se repelerán entre sí de tal manera que la forma de la molécula se ajustará de modo que los pares de electrones de Valencia permanezcan lo más separados entre sí como sea posible.

átomo Central sin pares solitarios
para comprender fácilmente los tipos de moléculas posibles, utilizaremos un sistema simple para identificar las partes de cualquier molécula.,
a = átomo central en una molécula
b = átomos que rodean el átomo central
los subíndices después del B denotarán el número de átomos B que están unidos al átomo a central. Por ejemplo, AB 4 es una molécula con un átomo central rodeado por cuatro átomos unidos covalentemente. De nuevo, no importa si esos enlaces son simples, dobles o triples.
AB2: hidruro de berilio (BeH2)
el hidruro de berilio consiste en un átomo central de berilio con dos enlaces simples a átomos de hidrógeno. Recuerde que viola la regla del octeto.,
H-Be-h
de acuerdo con el requisito de que los pares de electrones maximicen su distancia entre sí, los dos pares de enlace en las moléculas BeH 2 se organizarán en lados directamente opuestos del átomo Be central. La geometría resultante es una molécula lineal, mostrada en la Figura 1 en un modelo de «bola y palo».

la Figura 1. Modelo de hidruro de berilio.
el ángulo de enlace de H-Be-H es de 180° debido a su geometría lineal.,
El dióxido de carbono es otro ejemplo de una molécula que cae dentro de la categoría AB 2. Su estructura de Lewis consiste en dobles enlaces entre el carbono central y los átomos de oxígeno (ver Figura 2).

la Figura 2. Enlace de dióxido de carbono.
la repulsión entre los dos grupos de cuatro electrones (dos pares) no es diferente de la repulsión de los dos grupos de dos electrones (un par) en la molécula BeH 2. El dióxido de carbono también es lineal (Véase la Figura 3).,

la Figura 3. Dióxido.
AB3: trifluoruro de boro (BF3)
El trifluoruro de boro consiste en un átomo central de boro con tres enlaces simples a átomos de flúor (véase la Figura 4). El átomo de boro también tiene un octeto incompleto.
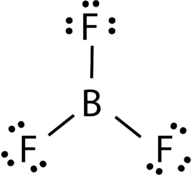
la Figura 4. Unión de trifluoruro de boro.
la geometría de la molécula BF 3 se llama trigonal planar (ver Figura 5). Los átomos de flúor se colocan en los vértices de un triángulo equilátero., El ángulo F-B-F es de 120° y los cuatro átomos se encuentran en el mismo plano.

la Figura 5. Modelo de trifluoruro de boro.
AB4: metano (CH4)
El metano es un compuesto orgánico que es el componente primario del gas natural. Su estructura consiste en un átomo de carbono central con cuatro enlaces simples a átomos de hidrógeno (ver Figura 6). Con el fin de maximizar su distancia entre sí, los cuatro grupos de electrones de enlace no se encuentran en el mismo plano., En cambio, cada uno de los átomos de hidrógeno se encuentra en las esquinas de una forma geométrica llamada tetraedro. El átomo de carbono está en el centro del tetraedro. Cada cara de un tetraedro es un triángulo equilátero.

la Figura 6. Estructura tetraédrica del metano.
la geometría molecular de la molécula de metano es tetraédrica (ver Figura 7). Los ángulos de enlace H-C-H son de 109,5°, que es mayor que los 90° que serían si la molécula fuera plana., Al dibujar una fórmula estructural para una molécula como el metano, es ventajoso poder indicar el carácter tridimensional de su forma. La fórmula estructural a continuación se llama un dibujo de perspectiva. El enlace de línea punteada debe visualizarse como retrocediendo en la página, mientras que el enlace de triángulo sólido debe visualizarse como saliendo de la página.

la Figura 7. Modelo de perspectiva de metano.
¿cómo puede encajar toda esta ropa en un espacio tan pequeño?,
Cuando viajamos, a menudo tomamos muchas más cosas de las que necesitamos. Tratar de meterlo todo en una maleta puede ser un verdadero desafío. Puede que tengamos que volver a empacar o simplemente meterlo todo. Los átomos a menudo tienen que reorganizarse donde están los electrones para crear una estructura más estable.

Átomo Central con Uno o Más Pares libres
Las geometrías moleculares de las moléculas de cambio cuando el átomo central tiene uno o más pares libres de electrones., El número total de pares de electrones, ambos pares de enlace y pares solitarios, conduce a lo que se llama la geometría del dominio de electrones. Cuando uno o más de los pares de electrones de enlace se sustituye por un par solitario, la geometría molecular (forma real) de la molécula se altera. De acuerdo con los símbolos A y B establecidos en la sección anterior, usaremos E para representar un par solitario en el átomo central (A). Se utilizará un subíndice cuando haya más de un par solitario. Los pares solitarios en los átomos circundantes (B) no afectan la geometría.,
AB3E: amoníaco, NH3
la molécula de amoníaco contiene tres enlaces simples y un par solitario en el átomo de nitrógeno central (ver Figura 8).

la Figura 8. Electrones de par solitario en amoníaco.
la geometría de dominio para una molécula con cuatro pares de electrones es tetraédrica, como se vio con CH 4 . En la molécula de amoníaco, uno de los pares de electrones es un par solitario en lugar de un par de enlace. La geometría molecular del NH 3 se denomina piramidal trigonal (ver Figura 9).,

la Figura 9. Molécula de amoníaco.
recuerde que el ángulo de enlace en la molécula tetraédrica CH 4 es de 109,5°. Una vez más, el reemplazo de uno de los pares de electrones Unidos por un par solitario comprime ligeramente el ángulo. El ángulo H – N-H es de aproximadamente 107°.
AB2E2: agua, H2O
una molécula de agua consiste en dos pares de unión y dos pares solitarios (ver Figura 10).

la Figura 10. Electrones de par solitario en el agua.,
en cuanto al metano y el amoníaco, la geometría de dominio para una molécula con cuatro pares de electrones es tetraédrica. En la molécula de agua, dos de los pares de electrones son pares solitarios en lugar de pares de unión. La geometría molecular de la molécula de agua está doblada. El ángulo de enlace H-O-H es de 104,5°, que es más pequeño que el ángulo de enlace en NH3 (véase la Figura 11).

la Figura 11. Molécula de agua.,
AB4E: tetrafluoruro de azufre, SF4
La estructura de Lewis Para SF 4 contiene cuatro enlaces simples y un par solitario en el átomo de azufre (ver Figura 12).

la Figura 12. Electrones de par solitario en SF4.
el átomo de azufre tiene cinco grupos de electrones a su alrededor, lo que corresponde a la geometría del dominio bipiramidal trigonal, como en PCl 5 (ver Figura 13). Recordemos que la geometría bipiramidal trigonal tiene tres átomos ecuatoriales y dos átomos axiales Unidos al átomo central., Debido a la mayor repulsión de un par solitario, es uno de los átomos ecuatoriales que son reemplazados por un par solitario. La geometría de la molécula se llama tetraedro distorsionado o balancín.

la Figura 13. Modelo de bola y Palo para SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- La presencia de electrones de par solitario influye en la forma tridimensional de la molécula.
practica
átomo Central sin pares solitarios
usa el siguiente enlace para responder las siguientes preguntas:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- ¿Cuál es la forma de PF 5 ?
- ¿Qué ángulos C-H del dbo predeciríamos para el metano si la molécula fuera plana?
- ¿Qué molécula tiene la configuración de un octaedro?,
átomo Central con uno o más pares solitarios
utilice el siguiente enlace para responder a las siguientes preguntas:
- ¿Cuál es el principio general al tratar con moléculas que contienen más de cuatro pares de electrones?
- en la imagen con cinco pares de electrones alrededor del átomo central, ¿por qué se prefiere la disposición de la derecha?
- en la imagen con seis pares de electrones, ¿por qué la configuración con los pares solitarios a 180o entre sí es más estable?,
Revisión
Átomo Central con No Pares libres
- ¿cuáles son los ángulos de enlace en el dióxido de carbono?
- ¿Qué molécula tiene ángulos de enlace de 109.5 ° ?
- ¿Cuál es la geometría de la molécula BF 3?
Átomo Central con Uno o Más Pares libres
- ¿por Qué el agua tiene una inclinación de la geometría?
- ¿Por qué el amoníaco no es una molécula plana?
- ¿Cómo escribiríamos la configuración para el tetrafluoruro de xenón usando el sistema ABE?















