17.3: Happo-Emäs Indikaattorit
Oppimisen Tavoitteet
- Selittää toiminto ja väri muuttuu happo-emäs indikaattorit
- Osoittaa, miten valita oikea ilmaisin titraus kokeilu
- Määrittää hapan dissosiaatiovakiot Ka tai Kai indikaattoreita.
Tietyt orgaanisia aineita, muuttaa väriä laimentaa ratkaisu, kun hydronium-ioni pitoisuus saavuttaa tietyn arvon., Esimerkiksi, fenoliftaleiini on väritön aine tahansa vesiliuos, jossa hydronium-ioni pitoisuus on suurempi kuin 5.0 × 10-9 M (pH < 8.3). In enemmän perus ratkaisuja, joissa hydronium-ioni pitoisuus on alle 5.0 × 10-9 M (pH > 8.3), se on punainen tai vaaleanpunainen. Aineita, kuten fenoliftaleiinia, jota voidaan käyttää liuoksen pH: n määrittämiseen, kutsutaan happo-emäsindikaattoreiksi. Happo – emäsindikaattorit ovat joko heikkoja orgaanisia happoja tai heikkoja orgaanisia emäksiä.,
tasapainotilan ratkaisu happo-emäs-indikaattori, metyyli oranssi, heikko happo, voidaan esittää yhtälön, jossa käytämme HIn yksinkertainen edustus monimutkainen metyyli oranssi-molekyyli:
\
\}{}}=4.0×10^{-4}\]
anioni metyyli oranssi,−, keltainen, ja nonionized muodossa, HIn, on punainen. Kun metyyli-oranssin liuokseen lisätään happoa, lisääntynyt hydroniumionipitoisuus siirtää tasapainon kohti ionisoimatonta punaista muotoa Le Chatelierin periaatteen mukaisesti. Jos lisäämme pohjan, siirrämme tasapainon kohti keltaista muotoa., Tämä käytös on täysin analoginen puskurien toiminnan kanssa.
indikaattorin väri on näkyvä tulos kahden lajin In− ja HIn-pitoisuuksien suhteesta. Jos suurin osa ilmaisin (tyypillisesti noin 60-90% tai enemmän) on läsnä In− sitten näemme, väri In− ioni, joka olisi keltainen metyyli oranssi. Jos suurin osa on läsnä HIn, niin näemme väri HIn molekyyli: punainen metyyli oranssi., Esimerkiksi metyyli oranssi, voimme järjestää yhtälö Ka ja kirjoittaa:
-\} {}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}\]
-\} {\mathit{K}_a}=\dfrac{}{}}\]
-\} {\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
-\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
-\} {}\right)}\]
-\} {}\right)\tai\:pH=p\mathit{K}_a+log\left(\dfrac{}{}\right)}\]
viimeinen kaava on sama kuin Henderson-Hasselbalch yhtälö, jota voidaan käyttää kuvaamaan tasapainon indikaattoreita.,
Kun on sama numeerinen arvo, kuten Ka, suhde on yhtä suuri kuin 1, mikä tarkoittaa, että 50% indikaattori on läsnä punainen muoto (HIn) ja 50% on keltainen ionisessa muodossa (−), ja ratkaisu näyttää oranssi väri. Kun hydroniumionipitoisuus kasvaa 8 × 10-4 metriin (pH 3,1), liuos muuttuu punaiseksi. Värimuutoksia ei ole näkyvissä, jotta hydroniumionipitoisuus (pH: n lasku) kasvaisi entisestään. Hydroniumionipitoisuus on 4 × 10-5 M (pH 4.,4) suurin osa ilmaisin on keltainen ioni-muodossa, ja laski edelleen hydronium-ioni pitoisuus (pH: n nousu) ei tuota näkyvää värin muutos. PH-arvon välillä 3.1 (punainen) ja 4.4 (keltainen) on väri-vaihda väli metyyli oranssi; lausutaan värin muutos tapahtuu näiden pH-arvot.
indikaattoreina voidaan käyttää monia eri aineita seurattavan reaktion mukaan., Esimerkiksi punainen kaali mehu sisältää sekoitus värillinen aineita, jotka muuttuvat syvän punainen alhaisessa pH: vaaleansininen väli pH: keltainen korkea pH (Luku \(\PageIndex{1}\)). Kaikissa tapauksissa hyvällä indikaattorilla on kuitenkin oltava seuraavat ominaisuudet:
- värimuutoksen on oltava helposti havaittavissa.
- värimuutoksen on oltava nopea.
- indikaattorimolekyyli ei saa reagoida titrattavan aineen kanssa.
- minimoidaan virheet, ilmaisin pitäisi olla pKin, että on majoitusliike, yhden pH-yksikön lämpötila pH vastaavuus pisteen titrauksella.,

Punainen kaali mehu sisältää aineiden seos, jonka väri riippuu pH: sta. Kuhunkin koeputkeen, joka sisältää liuosta, jossa punainen kaali mehu veteen, mutta liuosten pH vaihtelee pH = 2.0 (äärimmäisenä vasemmalla) pH = 11.0 (äärimmäisenä oikealla). PH = 7,0: ssa liuos on sininen.,
on kehitetty synteettisiä indikaattoreita, jotka täyttävät nämä kriteerit ja kattavat lähes koko pH-alueen. Kuva \(\PageIndex{2}\) näyttää likimääräisen pH-alueen, jolla jotkut yleiset indikaattorit muuttavat väriä ja niiden värin muutosta. Lisäksi jotkut indikaattorit (kuten tymolinsininen) ovat polyproottisia happoja tai emäksiä, jotka muuttavat väriä kahdesti laajalti erotetuilla pH-arvoilla.
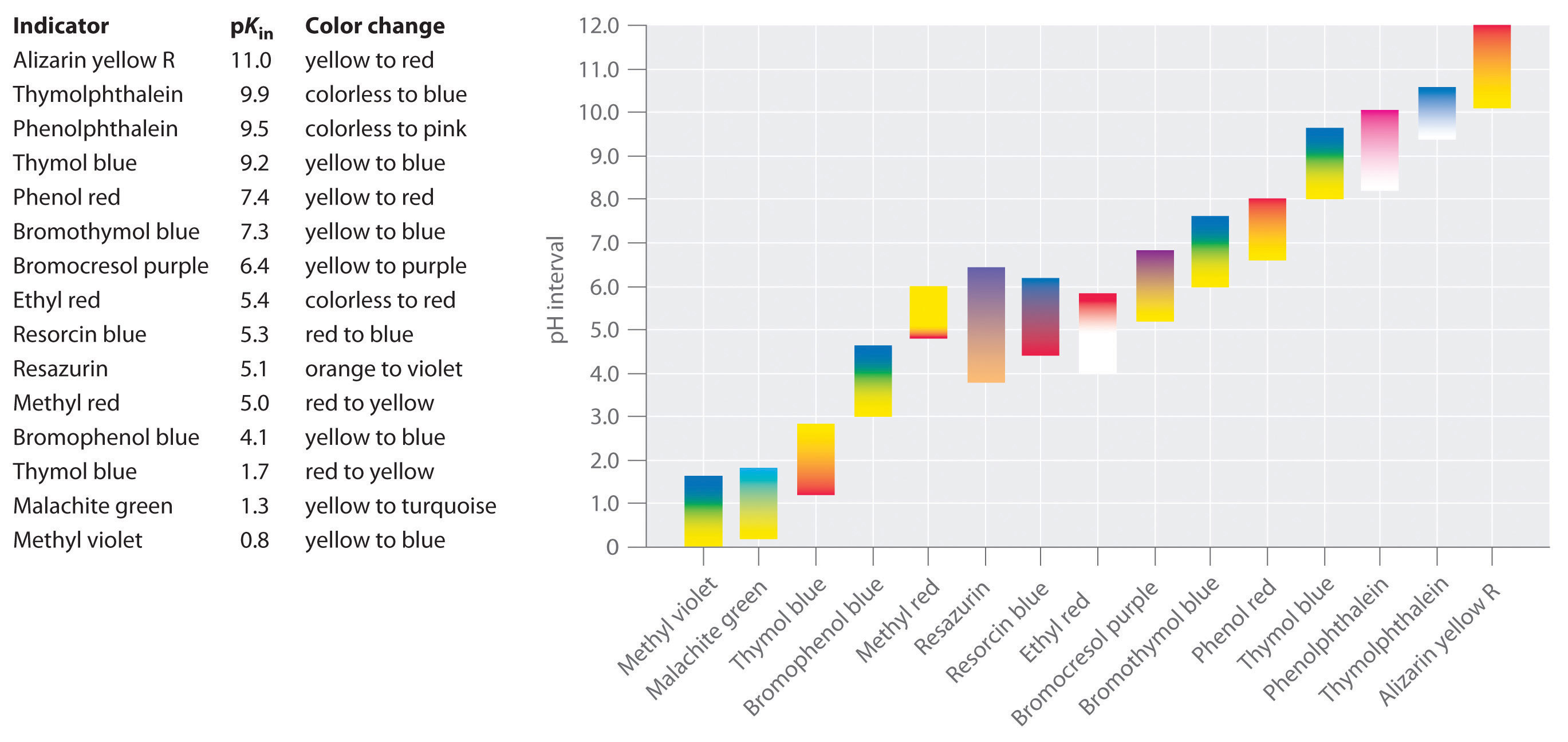
on tärkeää olla tietoinen siitä, että indikaattorin väri ei muutu äkillisesti tietyllä pH-arvo; sen sijaan, se todella tapahtuu pH-titraus aivan kuten mikä tahansa muu happo tai emäs. Koska pitoisuus HIn vähenee ja pitoisuus Vuonna− lisää, liuoksen väri muuttuu hiljalleen ominaisuus väri HIn, että In−. Kuten kohdassa 16 todetaan, suhde muuttuu 0: sta.,1 pH yksi yksikkö alle pKin 10 at pH yksi yksikkö yläpuolella pKin. Näin useimmat indikaattorit muuttavat väriä noin kahden pH-yksikön pH-alueella.
– Olemme todenneet, että hyvä indikaattori pitäisi olla pKin arvo, joka on lähellä lämpötila pH vastaavuus kohta. Vahva happo, vahva emäs-titraus, valinta indikaattori ei ole erityisen kriittinen, koska hyvin suuri muutos pH, joka tapahtuu noin vastaavuus kohta., Sen sijaan väärän indikaattorin käyttäminen heikon hapon tai heikon emäksen titrauksessa voi johtaa suhteellisen suuriin virheisiin, kuten kuviossa \(\PageIndex{3}\) esitetään. Tämä luku osoittaa, tontit pH vs. määrä base lisätty titrauksessa 50,0 mL 0.100 M liuosta vahva happo (HCl) ja heikko happo (etikkahappo), jossa 0.100 M \(NaOH\). PH-alueet, joilla näkyy myös kaksi yleistä indikaattoria(metyylinpunainen, \(pK_{in} = 5.0\) ja fenoliftaleiini, \(pK_{in} = 9.5\)) vaihtoväri., Vaakasuorat palkit osoittavat pH-alueet, joiden yli molemmat indikaattorit vaihtavat väriä, ylittävät HCl-titrauskäyrän, jossa se on lähes pystysuora. Näin ollen molemmat indikaattorit vaihtaa väriä, kun pohjimmiltaan sama määrä \(NaOH\) on lisätty (noin 50 mL), joka vastaa vastaavuus kohta. Sen sijaan etikkahapon titraus antaa hyvin erilaisia tuloksia riippuen siitä, käytetäänkö indikaattorina metyylipunaista vai fenoliftaleiinia., Vaikka pH-arvon yli, joka fenoliftaleiini muutokset väri on hieman suurempi kuin pH vastaavuuden näkökulmasta vahvan hapon titrausta, virhe on vähäinen, koska rinne tämän osan titrausta, käyrä. Aivan kuten HCl-titrauksessa, fenoliftaleiinimittari muuttuu vaaleanpunaiseksi, kun etikkahappoliuokseen on lisätty noin 50 mL \(NaOH\). Sen sijaan, metyylipunaa alkaa muuttua punaisesta keltaiseksi noin pH 5, joka on lähellä midpoint etikkahapon titraus, ei vastaavuutta kohta., Lisäämällä vain noin 25-30 mL \(NaOH\) aiheuttaa siis metyylinpunainen indikaattori muuttaa väriä, jolloin valtava virhe.
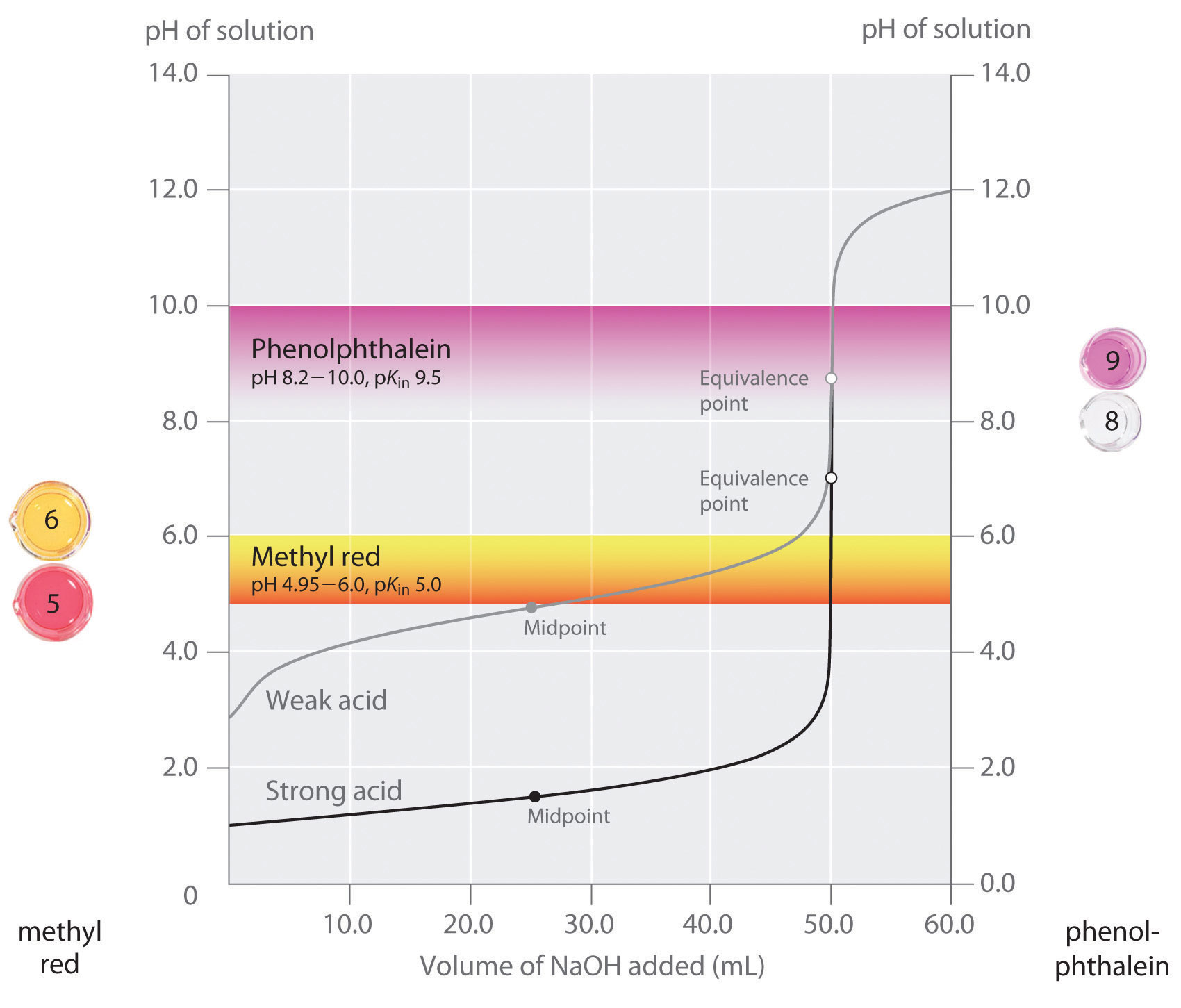
kuvaaja on esitetty tulokset, jotka on saatu käyttämällä kahta indikaattoria (metyylipunaa ja fenoliftaleiini) varten titraus 0.100 M ratkaisut ja vahva happo (HCl) ja heikko happo (etikkahappo), jossa 0.100 M \(NaOH\)., Koska jyrkkyys titrausta, käyrä vahva happo ympäri vastaavuus vaiheessa, joko ilmaisin tulee nopeasti muuttaa värin vastaavuus kohta titrauksessa vahva happo. Sen sijaan, pKin varten metyylipunaa (5.0) on hyvin lähellä pKa etikkahappoa (4.76); midpoint väri muutos metyylipunaa tapahtuu lähellä midpoint, titraus, eikä vastaavuutta kohta.
yleensä, titrauksia ja vahvat hapot vahvat emäkset (ja päinvastoin), mikä tahansa ilmaisin pK välillä noin 4,0-10,0 tekee., Titrauksessa on heikko happo, kuitenkin, pH, vastaavuus kohta on suurempi kuin 7.0, joten indikaattori, kuten fenoliftaleiini tai tymolia sininen, pKin > 7.0, tulisi käyttää. Päinvastoin, titrauksessa heikko pohja, jossa pH vastaavuus kohta on alle 7.0, indikaattori, kuten metyyli-punainen tai bromocresol sininen, pKin < 7.0, tulisi käyttää.
Esimerkiksi \(\PageIndex{1}\)
titraus heikko happo, vahva emäs, joka indikaattorin olisi paras valinta?,
- Metyyli Oranssi
- bromikresolivihreää
- Phenolphtalein
Ratkaisu
oikea vastaus on C. titraus heikko happo vahva pohja, taivuta pohjan heikko happo tekee pH vastaavuus kohta suurempi kuin 7. Siksi, haluaisit indikaattori muuttaa, että pH alue. Sekä metyyli oranssi ja bromikresolivihreää vaihtaa väriä happamassa pH: ssa, kun taas phenolphtalein muutoksia perus pH.,
on olemassa monia erilaisia indikaattoreita, joilla on eri värejä ja pKin arvot on myös kätevä tapa arvioida pH ratkaisu ilman kalliita elektroninen pH-mittari ja herkkä pH-elektrodi. Paperi tai muovi nauhat kyllästetty yhdistelmiä indikaattoreita käytetään ”pH-paperilla”, jonka avulla voit arvioida pH: n ratkaisu yksinkertaisesti kastamalla pala pH-paperia ja vertaamalla saatua väri standardien painettu säiliö (Kuva \(\PageIndex{4}\)).,
Tiivistelmä
Happo–emäs indikaattorit ovat yhdisteitä, jotka muuttavat väriä tietyssä pH: ssa., Ne ovat yleensä heikkoja happoja tai emäksiä, joiden muutokset väri vastaa deprotonoituu tai protonation indikaattorin itse.
Avustajat ja Attribuutiot
-
Paul Kukkia (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) ja Richard Langley (Stephen F. Austin State University) kanssa edistävät tekijät. OpenStax Collegen tuottama oppikirja-sisältö on lisensoitu Creative Commons Attribution License 4.0-lisenssillä. Lataa ilmaiseksi osoitteesta http://cnx.org/contents/85abf193-2bd…[email protected]).
- {malli.,ContribBoundless()}}















