Kemia Ei-Liigaan (Suomi)
Oppimisen Tavoitteet
- Kuvaile molekyylejä, joiden muodot ovat vaikuttaneet VSEPR-teoria.
- Määrittele yksinäinen pari.
- kuvaa, miten yksinäiset parielektronit vaikuttavat molekyyligeometriaan.
Miten electroscope työtä?
elektroskooppi on Laite, jolla tutkitaan latausta. Kun positiivisesti varautunut objektin (sauva) lähestyy ylä-post, elektronien virtaus päälle purkki jättäen kaksi kultaa lehdet postivley ladattu., Lehdet hylkivät toisiaan, koska molemmat pitävät positiivisia, kuten Latauksia. Se VSEPR-teoria sanoo, että elektroni paria, myös joukko, kuten maksut hylkivät toisiaan niin, että muoto molekyylin säätää niin, että valence electron-paria pysyä mahdollisimman kaukana toisistaan kuin mahdollista.

Keski-Atomin kanssa Ei Yksinäinen Paria
jotta voit helposti ymmärtää tyyppisiä molekyylejä mahdollista, käytämme yksinkertainen järjestelmä tunnistaa osia tahansa molekyyli.,
A = keski-atomi molekyyli
B = atomien ympärillä keski-atom
Alaindeksejä, kun B tulee tarkoittamaan, että useita B-atomit, jotka ovat sitoutuneet keski-atom. Esimerkiksi AB 4 on molekyyli, jonka keskusatomia ympäröi neljä kovalenttisesti sidottua atomia. Ei ole myöskään väliä, ovatko nämä sidokset yhden, kahden tai kolmen sidoksen sidoksia.
AB2: Beryllium-hydridiakut (BeH2)
Beryllium hydride koostuu keski-beryllium atom, jossa kaksi erillistä joukkovelkakirjojen vetyatomit. Muista, että se rikkoo octet-sääntöä.,
S-Be-H
Mukaan vaatimus, että elektroni paria maksimoida niiden etäisyys toisistaan, kaksi liimaus paria BeH 2 molekyylejä järjestää itse suoraan vastakkaisilla puolilla keski Olla atom. Tuloksena oleva geometria on lineaarinen molekyyli, joka esitetään kuvassa 1 ”pallo ja keppi” – mallissa.

Kuva 1. Berylliumhydridimalli.
bond-kulma H-Be-S on 180°, koska sen lineaarinen geometria.,
hiilidioksidi on toinen esimerkki molekyyli, joka kuuluu AB-2 luokkaan. Sen Lewis-rakenne koostuu kaksoissidosten välillä keski hiilen ja hapen atomien (ks. Kuva 2).

Kuva 2. Hiilidioksidisidos.
vastenmielisyys välillä kaksi ryhmää neljä elektronia (kaksi paria) ei ole erilainen kuin vastenmielisyys kaksi ryhmää kaksi elektronia (yksi pari) vuonna BeH 2-molekyylin. Hiilidioksidi on myös lineaarista (KS.kuva 3).,

Kuva 3. Hiilidioksidi.
AB3: Boori Trifluoride (BF3)
Boori trifluoride koostuu keski-boorin atomin kanssa kolme yhden joukkovelkakirjojen fluoriatomia (ks. Kuva 4). Booriatomilla on myös epätäydellinen oktetti.
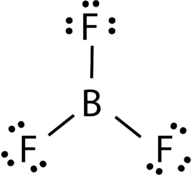
Kuva 4. Booritrifluoridisidos.
BF 3-molekyylin geometriaa kutsutaan trigonaaliseksi planaariksi (KS.kuva 5). Fluoriatomit on sijoitettu tasasivuisen kolmion kärkiin., F-B-F-kulma on 120° ja kaikki neljä atomia sijaitsevat samassa tasossa.

Kuva 5. Booritrifluoridimalli.
AB4: Metaani (CH4)
Metaani on orgaaninen yhdiste, joka on ensisijainen osa luonnon kaasua. Sen rakenne koostuu keski-hiiliatomin kanssa neljä yhden joukkovelkakirjojen vetyatomit (ks. Kuva 6). Maksimoidakseen etäisyyden toisistaan sidoselektronien neljä ryhmää eivät ole samassa tasossa., Sen sijaan jokainen vetyatomi sijaitsee tetraedroniksi kutsutun geometrisen muodon kulmissa. Hiiliatomi on tetraedrin keskellä. Tetraedrin jokainen sivu on tasasivuinen kolmio.

Kuva 6. Metaanin tetraedrinen rakenne.
molekyyli geometria metaani-molekyylin on tetraedri (ks. Kuva 7). H-C-H-sidoskulmat ovat 109,5°, mikä on suurempi kuin 90°, mitä ne olisivat, jos molekyyli olisi planar., Kun piirustus rakenteellinen kaava molekyylin, kuten metaania, se on edullista pystyä osoittamaan, kolmiulotteinen merkki sen muoto. Alla olevaa rakennekaavaa kutsutaan perspektiivipiirustukseksi. Katkoviiva bond on tarkoitus visualisoida kuin väistymässä sivulle, kun taas kiinteä kolmio bond on tarkoitus visualisoida kuin tulossa ulos sivulta.

Kuva 7. Metaaninäkökulmamalli.
Miten kaikki nämä vaatteet sopivat niin pieneen tilaan?,
kun matkustamme, otamme usein paljon enemmän tavaraa kuin tarvitsemme. Se, että yrittää mahduttaa kaiken matkalaukkuun, voi olla todellinen haaste. Meidän on ehkä pakattava tai vain puristettava kaikki sisään. Atomien on usein järjestettävä uudelleen paikka, jossa elektronit ovat luodakseen vakaamman rakenteen.

Keski-Atomin kanssa Yksi tai Useampi Yksinäinen Paria
molekyyli-geometriat molekyylien muutos, kun keski-atom on yksi tai useampi yksinäinen paria elektroneja., Elektroniparien kokonaismäärä, sekä sidosparit että yksinäiset parit, johtaa niin sanottuun elektronin domeenigeometriaan. Kun yksi tai useampi liimaus paria elektroneja on korvattu yksinäinen pari, molekyyli geometria (todellinen muoto) molekyyli on muutettu. Edellisessä jaksossa vahvistettujen A-ja B-tunnusten mukaisesti käytämme E: tä edustamaan keskiatomin (a) yksinäistä paria. Alaindeksiä käytetään, kun on useampi kuin yksi yksinäinen pari. Yksinäiset parit ympäröivillä atomeilla (B) eivät vaikuta geometriaan.,
AB3E: Ammoniakki, NH3
ammoniakin molekyyli sisältää kolme yhden joukkovelkakirjat ja yksi yksinäinen pari keski-typpi-atomi (ks. Kuva 8).

Kuva 8. Ionipari elektroneja ammoniakissa.
verkkotunnuksen geometria-molekyyli, jossa neljä elektroni paria on tetraedri, koska oli nähnyt CH-4 . Ammoniakkimolekyylissä yksi elektronipareista on sidosparin sijaan yksinäinen pari. NH 3: n molekyyligeometriaa kutsutaan trigonaaliseksi pyramidiksi (KS.Kuva 9).,

Kuva 9. Ammoniakkimolekyyli.
muistuttaa, että tetraedrisen CH 4-molekyylin sidoskulma on 109,5°. Jälleen, korvaaminen yksi sidottu elektroni paria yksinäinen pari pakkaa kulma hieman. H-N-H-kulma on noin 107°.
AB2E2: Veden, H2O
vesimolekyyli koostuu kahdesta liimaus paria ja kaksi yksinäistä paria (ks. Kuva 10).

Kuva 10. Yksinäinen elektronipari vedessä.,
Kuten metaania ja ammoniakkia, domain geometria-molekyyli, jossa neljä elektroni paria on tetraedri. Vesimolekyylissä kaksi elektroniparia ovat pikemminkin yksinäisiä pareja kuin sidospareja. Vesimolekyylin molekyyligeometria taipuu. H-O-H-sidoksen kulma on 104.5°, joka on pienempi kuin bond kulma NH3 (ks. Kuva 11).

Kuva 11. Vesimolekyyli.,
AB4E: Rikki Tetrafluoride, SF4
Lewis rakenne SF 4 sisältää neljä yksinkertaisia sidoksia ja yksinäinen pari rikkiä atom (ks. Kuva 12).

Kuva 12. Ioniparin elektronit SF4: ssä.
rikki atom on viisi electron-ryhmät noin se, joka vastaa trigonal bipyramidal domain geometria, kuten PCl 5 (ks. Kuva 13). Muista, että trigonaalisessa bipyramidaaligeometriassa on kolme ekvatoriaalista atomia ja kaksi aksiaalista atomia, jotka on kiinnitetty keskusatomiin., Yksinäisen parin suuremman vastenmielisyyden vuoksi se on yksi Päiväntasaajan atomeista, jotka korvataan yksinäisellä parilla. Molekyylin geometriaa kutsutaan vääristyneeksi tetraedroniksi tai seesawiksi.

Kuva 13. Pallo-ja keppimalli SF4: lle .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- yksinäisten parielektronien läsnäolo vaikuttaa molekyylin kolmiulotteiseen muotoon.
Käytäntö
Keski-Atomin kanssa Ei Yksinäinen Paria
Käytä alla olevaa linkkiä vastaamaan seuraaviin kysymyksiin:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Mikä on muoto PF-5 ?
- mitä C-H bod-kulmia ennustaisimme metaanille, jos molekyyli olisi planaarinen?
- millä molekyylillä oktaedrin konfiguraatio on?,
Keski-Atomin kanssa Yksi tai Useampi Yksinäinen Paria
Käytä alla olevaa linkkiä vastaamaan seuraaviin kysymyksiin:
- Mikä on yleinen periaate käsitellä molekyylejä, joissa on enemmän kuin neljä elektroni paria?
- kuvassa, jossa keskiatomin ympärillä on viisi elektroniparia, miksi asetelma on oikealla parempana?
- kuvassa kuuden elektroniparin kanssa, miksi yksinäisten parien kokoonpano 180o: ssa on vakaampi?,
Arvostelu
Keski-Atomin kanssa Ei Yksinäinen Paria
- Mitkä ovat bond näkökulmista hiilidioksidia?
- minkä molekyylin sidoskulmat ovat 109,5 ° ?
- mikä on BF 3-molekyylin geometria?
Keski-Atomin kanssa Yksi tai Useampi Yksinäinen Paria
- Miksi vesi on taivutettu geometria?
- miksi ammoniakki ei ole planaarimolekyyli?
- miten xenon-tetrafluoridin kokoonpano kirjoitettaisiin ABE-järjestelmän avulla?















