17.3: Sav-Bázis Indikátorok
Tanulási Célok
- Magyarázza a funkció, a színe megváltozik, a sav-bázis indikátorok
- megmutatom, hogyan válasszuk ki a megfelelő mutató egy titrálás kísérlet
- Meghatározza a savas disszociációs állandók Ka vagy Kai a mutatók.
egyes szerves anyagok színe hígított oldatban változik, amikor a hidrónium-ion koncentrációja eléri a meghatározott értéket., Például a fenolftalein színtelen anyag bármilyen vizes oldatban, amelynek hidrónium-ion koncentrációja nagyobb, mint 5,0 × 10-9 M (pH < 8.3). Több alapvető oldatban, ahol a hidrónium-ion koncentrációja kevesebb, mint 5, 0 × 10-9 M (pH > 8, 3), piros vagy rózsaszín. Az olyan anyagokat, mint a fenolftalein, amelyek az oldat pH-jának meghatározására használhatók, sav-bázis mutatóknak nevezik. A sav-bázis mutatók gyenge szerves savak vagy gyenge szerves bázisok.,
Az egyensúlyi oldatban a sav-bázis indikátor metil-narancs, egy gyenge sav, képviseli egyenlet, amit használni HIn, mint egy egyszerű ábrázolása, a komplex metil-narancs molekula:
\
\}{}}=4.0×10^{-4}\]
Az anion a metil-narancs -, A−, sárga, a nonionized formában, HIn, piros. Amikor savat adunk a metil-narancs oldatához, a megnövekedett hidrónium-ion koncentráció az egyensúlyt a nonionizált vörös forma felé mozdítja el, a Le Chatelier elvével összhangban. Ha bázist adunk hozzá,az egyensúlyt a sárga forma felé toljuk., Ez a viselkedés teljesen analóg a pufferek hatásával.
az indikátor színe a két faj In− és HIn koncentrációinak arányának látható eredménye. Ha a mutató nagy része (általában körülbelül 60-90% vagy több) van jelen, mint a−, akkor látjuk az in− ion színét, amely sárga lenne a metil-narancs esetében. Ha a legtöbb HIn-ként van jelen, akkor látjuk a HIn molekula színét: piros a metil-narancs esetében., A metil-narancs, át tudjuk állítani az egyenlet a Ka írni:
\}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}\]
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
a\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:vagy a\\: pH=p\mathit{K}_a+log\left(\dfrac{}{}\right)}\]
Az utolsó képlet ugyanaz, mint a Henderson-Hasselbalch egyenlet, amelynek segítségével le lehet írni az egyensúlyi mutatók.,
Ha azonos számértékkel rendelkezik, mint a Ka, az to aránya 1, ami azt jelenti, hogy a mutató 50%− a piros formában (HIn), 50% pedig sárga ionos formában (In -) van jelen, az oldat narancssárga színű. Amikor a hidrónium-ion koncentrációja 8 × 10-4 M-re nő (3,1 pH), az oldat pirosra fordul. A hidrónium-ion koncentráció további növekedése (a pH csökkenése) esetén a színváltozás nem látható. Hidrónium-ion koncentrációja 4 × 10-5 M (pH 4.,4), a mutató nagy része sárga ionos formában van, a hidrónium-ion koncentráció további csökkenése (a pH növekedése) nem eredményez látható színváltozást. A 3.1 (piros) és 4.4 (sárga) közötti pH-tartomány a metil-narancs színváltozási intervalluma; a kifejezett színváltozás ezen pH-értékek között történik.
számos különböző anyag használható indikátorként, a nyomon követendő reakciótól függően., Például a vörös káposzta lé olyan színes anyagok keverékét tartalmazza,amelyek alacsony pH-n a mélyvörösről világoskékre, köztes pH-n a sárgára, magas pH-n (\Pageindex{1}\). Minden esetben azonban egy jó mutatónak a következő tulajdonságokkal kell rendelkeznie:
- a színváltozást könnyen észlelni kell.
- a színváltozásnak gyorsnak kell lennie.
- az indikátormolekula nem reagálhat a titrált anyaggal.
- a hibák minimalizálása érdekében a mutatónak olyan pKin-vel kell rendelkeznie, amely a titrálás egyenértékűségi pontján a várt pH-érték egy pH-egységén belül van.,

a vörös káposzta lé olyan anyagok keverékét tartalmazza, amelyek színe a pH-tól függ. minden kémcső vörös káposzta lé oldatot tartalmaz vízben, de az oldatok pH-ja a pH = 2,0-tól (balra) a pH = 11,0-ig (jobbra) változik. PH = 7,0 esetén az oldat kék.,
szintetikus mutatókat fejlesztettek ki, amelyek megfelelnek ezeknek a kritériumoknak, és gyakorlatilag a teljes pH-tartományt lefedik. A \(\PageIndex{2}\) ábra azt a hozzávetőleges pH-tartományt mutatja, amely felett néhány közös mutató megváltoztatja a színt és a színváltozást. Ezenkívül egyes mutatók (például a timolkék) poliprotikus savak vagy bázisok, amelyek széles körben elválasztott pH-értékeken kétszer megváltoztatják a színt.
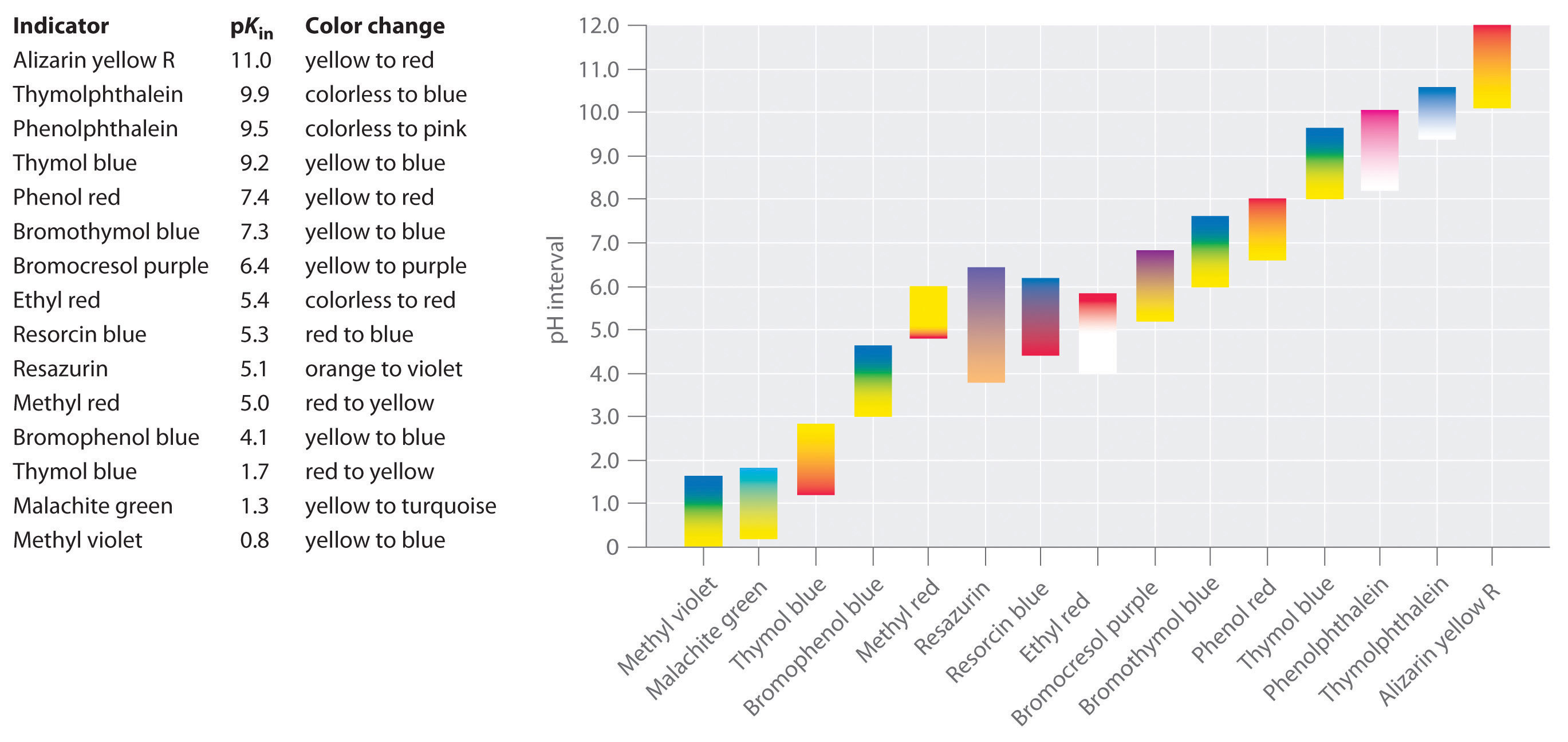
fontos tudni, hogy egy mutató nem változik hirtelen egy adott pH-értéknél; ehelyett valójában pH-titráláson megy keresztül, mint bármely más sav vagy bázis. Amint a HIn koncentrációja csökken, az In− koncentrációja nő, az oldat színe lassan változik a HIn jellegzetes színétől az In-színig. Amint azt a 16. szakaszban látni fogjuk, a / Arány 0-ról változik.,1 egy pH egy egység alatt pKin 10 egy pH egy egység felett pKin. Így a legtöbb mutató körülbelül két pH-egység pH-tartományában változtatja meg a színt.
kijelentettük, hogy egy jó mutatónak olyan pKin-értékkel kell rendelkeznie, amely az egyenértékűségi ponton közel áll a várt pH-hoz. Erős sav-erős bázis titrálás esetén a mutató kiválasztása nem különösebben kritikus az egyenértékűségi pont körül bekövetkező nagyon nagy pH-változás miatt., Ezzel szemben a gyenge sav vagy gyenge bázis titrálására szolgáló rossz indikátor használata viszonylag nagy hibákat eredményezhet, amint azt a \(\PageIndex{3}\) ábra mutatja. Ez az ábra azt mutatja, telkek pH versus térfogata bázis adunk a titrálás 50,0 mL 0,100 M oldat erős sav (HCl) és gyenge sav (ecetsav) 0,100 M \(NaOH\). A pH-tartományok, amelyek felett két közös mutató (metil-piros, \(pk_{in} = 5.0\), valamint fenolftalein, \(pK_{in} = 9.5\)) színváltozás is látható., A vízszintes sávok jelzik azokat a pH-tartományokat, amelyeken mindkét mutató színe megváltozik a HCl titrálási görbén, ahol szinte függőleges. Ezért mindkét mutató megváltoztatja a színt, ha lényegében ugyanazt a \(NaOH\) térfogatot adják hozzá (körülbelül 50 mL), ami megfelel az egyenértékűségi pontnak. Ezzel szemben az ecetsav titrálása nagyon eltérő eredményeket ad attól függően, hogy metilvöröset vagy fenolftaleint használnak-e indikátorként., Bár a pH-tartomány, amelyen a fenolftalein színe megváltozik, kissé nagyobb, mint a pH az erős sav titrálás egyenértékűségi pontján, a hiba elhanyagolható lesz a titrálási görbe ezen részének lejtése miatt. Csakúgy, mint a HCl titrálásnál, a fenolftalein indikátor rózsaszínűvé válik, amikor körülbelül 50 mL \(NaOH\) – t adtak az ecetsavoldathoz. Ezzel szemben a metilvörös a pH 5 körül pirosról sárgára változik, ami közel van az ecetsav titrálásának középpontjához, nem pedig az egyenértékűségi ponthoz., Csak körülbelül 25-30 mL \(NaOH\) hozzáadása ezért a metil-piros indikátor színét megváltoztatja, ami hatalmas hibát eredményez.
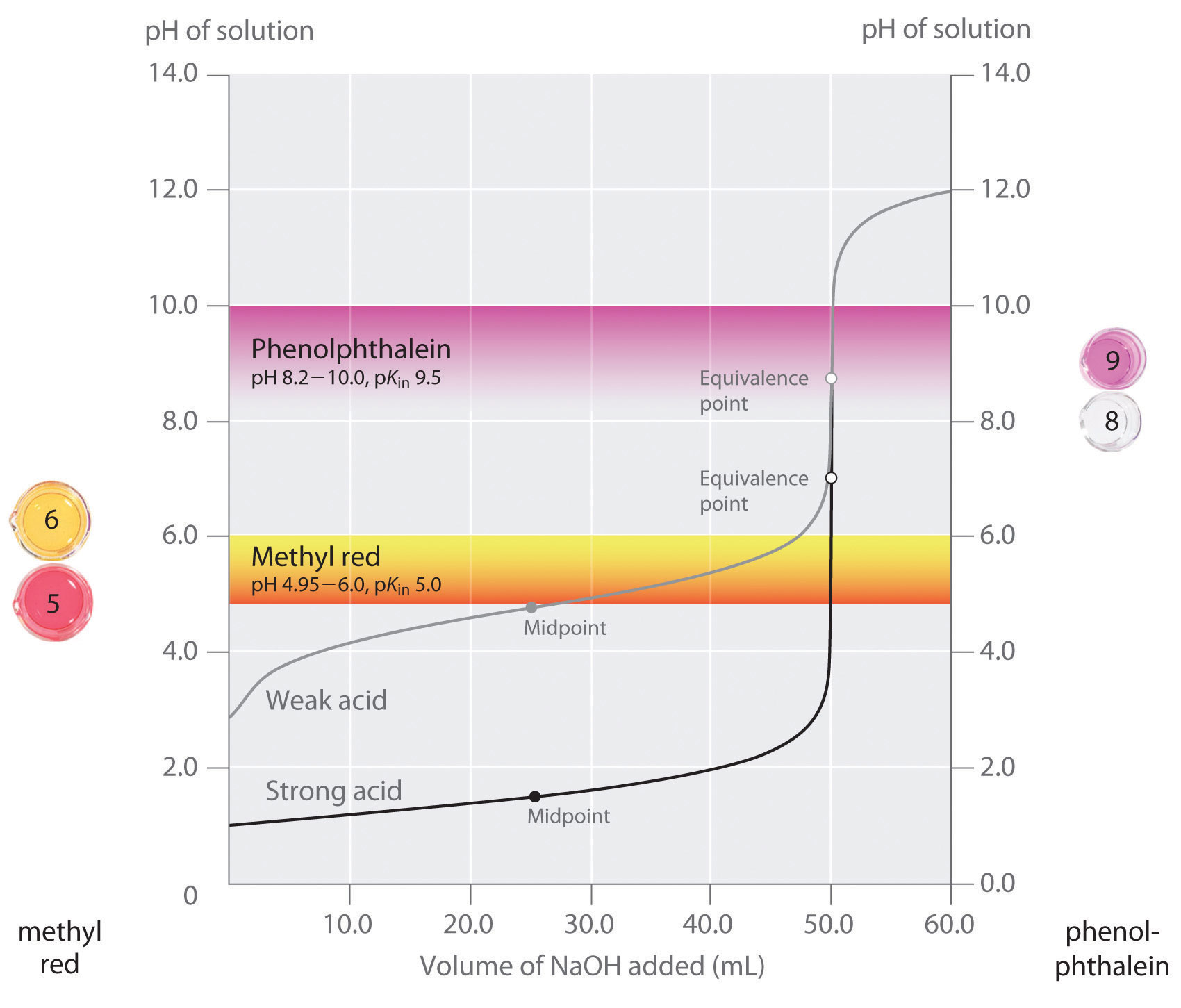
A grafikon azt mutatja, hogy a kapott eredmények segítségével a két mutató (metil-vörös, fenolftalein) a titrálás a 0.100 M megoldások erős sav (HCl) gyenge sav (ecetsav) a 0.100 M \(NaOH\)., Az erős sav titrálási görbéjének meredeksége miatt az egyenértékűségi pont körül bármelyik mutató gyorsan megváltoztatja a színt az erős sav titrálásának egyenértékűségi pontján. Ezzel szemben a metil-vörös (5.0) pKin nagyon közel van az ecetsav pKa-jához (4.76); a metil-vörös színváltozásának középpontja a titrálás középpontja közelében történik, nem pedig az egyenértékűségi ponton.
általában az erős bázisú erős savak titrálására (és fordítva) minden olyan mutató, amelynek PK-je körülbelül 4, 0-10, 0 között van, megteszi., A titrálás egy gyenge sav, azonban a pH-az ekvivalencia pont nagyobb, mint 7.0, így egy-egy jelző, például a fenolftalein vagy timol kék, a pKin > 7.0 kell használni. Ezzel szemben egy gyenge bázis titrálásához, ahol az egyenértékűségi ponton a pH kisebb, mint 7,0, olyan indikátort kell használni, mint a metil-vörös vagy a bromokrezol kék, pKin < 7,0.
példa \ (\PageIndex{1}\)
egy erős bázisú gyenge sav titrálásakor melyik mutató lenne a legjobb választás?,
- metil-Narancs
- Bromokrezol Zöld
- fenolftalein
oldat
a helyes válasz C. egy erős bázisú gyenge sav titrálásakor a gyenge sav konjugált bázisa a pH-t 7-nél nagyobb egyenértékűségi ponton teszi. Ezért azt szeretné, ha egy mutató megváltozna ebben a pH-tartományban. Mind a metil-narancs, mind a bromokrezol zöld színe savas pH-tartományban változik, míg a fenolftalein alap pH-ban változik.,
számos különböző, különböző színű és pKin-értékű mutató megléte kényelmes módot nyújt egy megoldás pH-értékének becslésére drága elektronikus pH-mérő és törékeny pH-elektróda használata nélkül. A mutatók kombinációjával impregnált papírt vagy műanyag csíkokat “pH-papírként” használják, amely lehetővé teszi az oldat pH-értékének becslését azáltal, hogy egyszerűen egy darab pH-papírt merít bele, és összehasonlítja a kapott színt a tartályra nyomtatott szabványokkal (\Pageindex{4}\)).,
összefoglaló
a sav–bázis mutatók olyan vegyületek, amelyek egy adott pH-n megváltoztatják a színt., Jellemzően gyenge savak vagy bázisok, amelyek színváltozása megfelel a mutató deprotonációjának vagy protonációjának.
közreműködők és attribútumok
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) és Richard Langley (Stephen F. Austin State University) közreműködő szerzőkkel. Tankönyv tartalom által termelt OpenStax College licenc alatt Creative Commons Attribution License 4.0 licenc. Letöltés ingyen itt: http://cnx.org/contents/85abf193-2bd…[email protected]).
- {sablon.,ContribBoundless ()}}















