Chemistry for Non-Majors (Magyar)
tanulási célok
- leírják azokat a molekulákat, amelyek formáit a VSEPR elmélet befolyásolja.
- határozza meg a magányos pár.
- írja le, hogy a magányos pár elektronok hogyan befolyásolják a molekuláris geometriát.
hogyan működik az elektroszkóp?
az elektroszkóp olyan eszköz, amelyet a töltés tanulmányozására használnak. Amikor egy pozitív töltésű tárgy (a rúd) közeledik a felső oszlophoz, az elektronok az edény tetejére áramlanak, így a két arany levél postivley töltődik., A levelek taszítják egymást, mivel mindkettő posztív, mint a díjak. A VSEPR-elmélet szerint az elektronpárok, valamint a hasonló töltések halmaza taszítják egymást úgy, hogy a molekula alakja úgy alakuljon ki, hogy a valenciaelektron-Párok a lehető legtávolabb maradjanak egymástól.

központi Atom nincs magányos pár
annak érdekében, hogy könnyen megértsük a lehetséges molekulák típusát, egy egyszerű rendszert használunk bármely molekula részeinek azonosítására.,
a = központi atom egy molekulában
B = a központi atomot körülvevő atomok
A B után a B atomok számát jelöli, amelyek a Központi a atomhoz kapcsolódnak. Például az AB 4 egy olyan molekula, amelynek központi atomja négy kovalens kötésű atomot vesz körül. Ismét nem számít, hogy ezek a kötvények egyszeri, kettős vagy hármas kötvények.
AB2: berillium-hidrid (BeH2)
a berillium-hidrid egy központi berillium-atomból áll, két hidrogénatomhoz való egyetlen kötéssel. Emlékezzünk vissza, hogy megsérti az oktett szabályt.,
H-Be-H
annak a követelménynek megfelelően, hogy az elektronpárok maximalizálják egymástól való távolságukat, a BeH 2 molekulákban lévő két kötési pár a központi be atom közvetlenül ellentétes oldalán helyezkedik el. A kapott geometria egy lineáris molekula, amely az 1. ábrán látható egy “labda and stick” modellben.

1.ábra. Berillium hidrid modell.
a H-Be-H kötés szöge lineáris geometriája miatt 180°.,
a szén-dioxid egy másik példa egy olyan molekulára, amely az AB 2 kategóriába tartozik. Lewis szerkezete kettős kötésből áll a központi szén és az oxigénatomok között (lásd a 2.ábrát).

2.ábra. Szén-dioxid kötés.
a négy elektron (két pár) két csoportja közötti repulzió nem különbözik a két elektron (egy pár) két csoportjának repulziójától a BeH 2 molekulában. A szén-dioxid szintén lineáris (lásd a 3. ábrát).,

3.ábra. Szén-dioxid.
AB3: Bór-Trifluorid (BF3)
Bór-trifluorid áll egy központi bór atom három egyszemélyes kötvények, hogy a fluor atomok (4. Ábra). A bór atomnak hiányos oktettje is van.
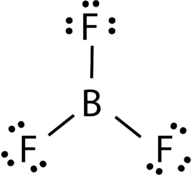
4.ábra. Bór-trifluorid kötés.
a BF 3 molekula geometriáját trigonális síknak nevezzük (lásd 5.ábra). A fluor atomok egy egyenlő oldalú háromszög csúcsán helyezkednek el., Az F-B-F szög 120°, mind a négy atom ugyanabban a síkban helyezkedik el.

5.ábra. Bór-trifluorid modell.
AB4: metán (CH4)
A metán egy szerves vegyület, amely a földgáz elsődleges összetevője. Szerkezete egy központi szénatomból áll, négy hidrogénatomhoz való egyetlen kötéssel (lásd a 6.ábrát). Annak érdekében, hogy maximalizálják egymástól való távolságukat, a kötő elektronok négy csoportja nem ugyanabban a síkban fekszik., Ehelyett a hidrogénatomok mindegyike egy geometriai alakzat sarkán fekszik, amelyet tetraédernek neveznek. A szénatom a tetraéder közepén helyezkedik el. A tetraéder minden arca egyenlő oldalú háromszög.

6. A metán tetraéderes szerkezete.
a metánmolekula molekuláris geometriája tetraéderes (lásd a 7.ábrát). A H-C-H kötési szögek 109,5°, ami nagyobb, mint a 90°, ami akkor lenne, ha a molekula sík lenne., Egy molekula, például a metán szerkezeti képletének rajzolásakor előnyös az alakjának háromdimenziós karakterének jelzése. Az alábbi szerkezeti képletet perspektívarajznak nevezik. A pontozott vonalkötést úgy kell megjeleníteni, mint az oldalra való visszahúzódást, míg a szilárd háromszögkötést úgy kell megjeleníteni, mint az oldalról.

7.ábra. Metán perspektíva modell.
hogyan illeszkedhetnek ezek a ruhák egy ilyen kis helyre?,
utazáskor gyakran sokkal több dolgot veszünk, mint amennyire szükségünk van. Valódi kihívás lehet az, ha mindent egy bőröndbe illesztünk. Lehet, hogy át kell csomagolnunk, vagy csak be kell préselnünk az egészet. Az atomoknak gyakran át kell rendezniük az elektronok helyét, hogy stabilabb szerkezetet hozzanak létre.

központi Atom egy vagy több magányos párral
a molekulák molekuláris geometriája megváltozik, amikor a központi atomnak egy vagy több magányos elektronpárja van., Az elektronpárok teljes száma, mind a kötéspárok, mind a magányos Párok, az úgynevezett elektron domain geometriához vezet. Ha az elektronok egy vagy több kötéspárját egy magányos pár váltja fel, a molekula molekuláris geometriája (tényleges alakja) megváltozik. Az előző részben megállapított A és B szimbólumokkal összhangban az E-t használjuk, hogy egy magányos párt képviseljünk a központi atomon (A). Az alsó indexet akkor használják, ha egynél több magányos pár van. A környező atomok (B) magányos párjai nem befolyásolják a geometriát.,
AB3E: ammónia, NH3
az ammónia molekula három egykötést és egy magányos párt tartalmaz a központi nitrogénatomon (lásd a 8.ábrát).

8.ábra. Magányos pár elektronok ammóniában.
a négy elektronpárral rendelkező molekula tartománygeometriája tetraéderes, amint azt a CH 4 esetében láttuk . Az ammónia molekulában az egyik elektronpár egy magányos pár, nem pedig egy kötő pár. Az NH 3 molekuláris geometriáját trigonális piramisnak nevezzük (lásd a 9.ábrát).,

9.ábra. Ammónia molekula.
emlékezzünk arra, hogy a tetraéderes CH 4 molekula kötési szöge 109,5°. Ismét az egyik ragasztott elektronpár cseréje egy magányos párral kissé összenyomja a szöget. A H-N-H szög körülbelül 107°.
AB2E2: víz, H2O
egy vízmolekula két kötőpárból és két magányos párból áll (lásd a 10.ábrát).

10.ábra. Magányos pár elektronok a vízen.,
ami a metánt és az ammóniát illeti, a négy elektronpárral rendelkező molekula tartománygeometriája tetraéderes. A vízmolekulában az elektronpárok közül kettő magányos pár, nem pedig kötési pár. A vízmolekula molekuláris geometriája hajlított. A H-O-H kötési szög 104,5°, ami kisebb, mint az NH3 kötési szöge (lásd a 11.ábrát).

11.ábra. Vízmolekula.,
AB4E: kén-tetrafluorid, SF4
Az SF 4 Lewis szerkezete négy különálló kötést és egy magányos párot tartalmaz a kénatomon (lásd a 12.ábrát).

12.ábra. Magányos pár elektronok SF4.
a kénatomnak öt elektroncsoportja van körülötte, ami megfelel a trigonális bipiramidális domain geometriának, mint a PCl 5-ben (lásd a 13.ábrát). Emlékezzünk vissza, hogy a trigonális bipiramidális geometriának három Egyenlítői atomja van, és két axiális Atom kapcsolódik a központi atomhoz., Mivel a nagyobb taszítás egy magányos pár, ez az egyik Egyenlítői atomok, amelyek helyébe egy magányos pár. A molekula geometriáját torzított tetraédernek vagy látószögnek nevezik.

13.ábra. Ball and stick modell SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- a magányos pár elektronok jelenléte befolyásolja a molekula háromdimenziós alakját.
gyakorlat
központi Atom nincs magányos pár
használja az alábbi linket a következő kérdések megválaszolásához:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- mi a PF 5 alakja ?
- milyen C-H bod szögeket jósolnánk a metánra, ha a molekula sík lenne?
- milyen molekula rendelkezik egy oktaéder konfigurációjával?,
központi Atom egy vagy több magányos párral
használja az alábbi linket a következő kérdések megválaszolásához:
- mi az általános elv a négynél több elektronpárt tartalmazó molekulák kezelésében?
- a képen öt elektronpárral a központi atom körül, miért előnyös a jobb oldali elrendezés?
- a hat elektronpárral ellátott képen miért stabilabb a konfiguráció a magányos párokkal 180o-nál?,
központi Atom magányos Párok nélkül
- mik a kötési szögek a szén-dioxidban?
- milyen molekula kötési szöge 109,5 ° ?
- mi a BF 3 molekula geometriája?
központi Atom egy vagy több magányos párral
- miért van a víz hajlított geometriája?
- miért nem planáris molekula az ammónia?
- hogyan írnánk a xenon-tetrafluorid konfigurációját az ABE rendszer használatával?
Szójegyzék
központi Atom magányos Párok nélkül
- mik a kötési szögek a szén-dioxidban?
- milyen molekula kötési szöge 109,5 ° ?
- mi a BF 3 molekula geometriája?
központi Atom egy vagy több magányos párral
- miért van a víz hajlított geometriája?
- miért nem planáris molekula az ammónia?
- hogyan írnánk a xenon-tetrafluorid konfigurációját az ABE rendszer használatával?















