Chemistry for Non-Majors
Obiettivi formativi
- Descrivere molecole le cui forme sono influenzate dalla teoria VSEPR.
- Definire coppia solitaria.
- Descrivi come gli elettroni della coppia solitaria influenzano la geometria molecolare.
Come funziona un elettroscopio?
Un elettroscopio è un dispositivo utilizzato per studiare la carica. Quando un oggetto caricato positivamente (l’asta) si avvicina al palo superiore, gli elettroni fluiscono verso la parte superiore del vaso lasciando le due foglie d’oro postivley cariche., Le foglie si respingono a vicenda poiché entrambe tengono postive, come cariche. La teoria VSEPR dice che le coppie di elettroni, anche un insieme di cariche simili, si respingeranno a vicenda in modo tale che la forma della molecola si regolerà in modo che le coppie di elettroni di valenza rimangano il più distanti possibile.

Atomo centrale senza coppie solitarie
Al fine di comprendere facilmente i tipi di molecole possibili, useremo un semplice sistema per identificare le parti di qualsiasi molecola.,
A = atomo centrale in una molecola
B = atomi che circondano l’atomo centrale
I pedici dopo il B denotano il numero di atomi B che sono legati all’atomo centrale A. Ad esempio, AB 4 è una molecola con un atomo centrale circondato da quattro atomi legati covalentemente. Ancora una volta, non importa se tali obbligazioni sono singole, doppie o triple obbligazioni.
AB2: idruro di berillio (BeH2)
L’idruro di berillio è costituito da un atomo centrale di berillio con due singoli legami con gli atomi di idrogeno. Ricorda che viola la regola dell’ottetto.,
H-Be-H
Secondo il requisito che le coppie di elettroni massimizzino la loro distanza l’una dall’altra, le due coppie di legame nelle molecole BeH 2 si disporranno direttamente sui lati opposti dell’atomo centrale Be. La geometria risultante è una molecola lineare, mostrata nella Figura 1 in un modello “palla e bastone”.

Figura 1. Berillio idruro modello.
L’angolo di legame da H-Be-H è 180° a causa della sua geometria lineare.,
L’anidride carbonica è un altro esempio di molecola che rientra nella categoria AB 2. La sua struttura di Lewis è costituita da doppi legami tra il carbonio centrale e gli atomi di ossigeno (vedi Figura 2).

Figura 2. Legame di anidride carbonica.
La repulsione tra i due gruppi di quattro elettroni (due coppie) non è diversa dalla repulsione dei due gruppi di due elettroni (una coppia) nella molecola BeH 2. Anche l’anidride carbonica è lineare (vedi Figura 3).,

Figura 3. Anidride carbonica.
AB3: Trifluoruro di boro (BF3)
Il trifluoruro di boro è costituito da un atomo centrale di boro con tre singoli legami con gli atomi di fluoro (vedere Figura 4). L’atomo di boro ha anche un ottetto incompleto.
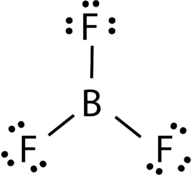
Figura 4. Legame del trifluoruro del boro.
La geometria della molecola BF 3 è chiamata planare trigonale (vedi Figura 5). Gli atomi di fluoro sono posizionati ai vertici di un triangolo equilatero., L’angolo F-B – F è di 120° e tutti e quattro gli atomi si trovano sullo stesso piano.

Figura 5. Trifluoruro di boro modello.
AB4: Metano (CH4)
Il metano è un composto organico che è il componente primario del gas naturale. La sua struttura è costituita da un atomo di carbonio centrale con quattro singoli legami con atomi di idrogeno (vedi Figura 6). Al fine di massimizzare la loro distanza l’uno dall’altro, i quattro gruppi di elettroni di legame non si trovano sullo stesso piano., Invece, ciascuno degli atomi di idrogeno si trova agli angoli di una forma geometrica chiamata tetraedro. L’atomo di carbonio è al centro del tetraedro. Ogni faccia di un tetraedro è un triangolo equilatero.

Figura 6. Struttura tetraedrica del metano.
La geometria molecolare della molecola di metano è tetraedrica (vedi Figura 7). Gli angoli di legame H-C-H sono 109,5°, che è più grande dei 90° che sarebbero se la molecola fosse planare., Quando si disegna una formula strutturale per una molecola come il metano, è vantaggioso essere in grado di indicare il carattere tridimensionale della sua forma. La formula strutturale sottostante è chiamata disegno prospettico. Il legame linea tratteggiata deve essere visualizzato come sfuggente nella pagina, mentre il legame triangolo solido deve essere visualizzato come proveniente dalla pagina.

Figura 7. Modello prospettico metano.
Come possono tutti questi vestiti adattarsi a uno spazio così piccolo?,
Quando viaggiamo, spesso prendiamo molta più roba di cui abbiamo bisogno. Cercare di inserire tutto in una valigia può essere una vera sfida. Potremmo dover riconfezionare o semplicemente spremere tutto in. Gli atomi spesso devono riorganizzare dove si trovano gli elettroni per creare una struttura più stabile.

Atomo centrale con una o più coppie Solitarie
Le geometrie molecolari delle molecole cambiano quando l’atomo centrale ha una o più coppie solitarie di elettroni., Il numero totale di coppie di elettroni, sia coppie di legame che coppie solitarie, porta a quella che viene chiamata la geometria del dominio degli elettroni. Quando una o più coppie di elettroni di legame viene sostituita con una coppia solitaria, la geometria molecolare (forma effettiva) della molecola viene alterata. In linea con i simboli A e B stabiliti nella sezione precedente, useremo E per rappresentare una coppia solitaria sull’atomo centrale (A). Un pedice verrà utilizzato quando c’è più di una coppia solitaria. Le coppie solitarie sugli atomi circostanti (B) non influenzano la geometria.,
AB3E: Ammoniaca, NH3
La molecola di ammoniaca contiene tre legami singoli e una coppia solitaria sull’atomo centrale di azoto (vedi Figura 8).

Figura 8. Elettroni coppia solitaria in ammoniaca.
La geometria del dominio per una molecola con quattro coppie di elettroni è tetraedrica, come si è visto con CH 4 . Nella molecola di ammoniaca, una delle coppie di elettroni è una coppia solitaria piuttosto che una coppia di legame. La geometria molecolare di NH 3 è chiamata piramidale trigonale (vedi Figura 9).,

Figura 9. Molecola di ammoniaca.
Ricordiamo che l’angolo di legame nella molecola tetraedrica CH 4 è 109,5°. Ancora una volta, la sostituzione di una delle coppie di elettroni legate con una coppia solitaria comprime leggermente l’angolo. L’angolo H-N-H è di circa 107°.
AB2E2: Acqua, H2O
Una molecola d’acqua è costituita da due coppie di legami e due coppie solitarie (vedi Figura 10).

Figura 10. Elettroni coppia solitaria sull’acqua.,
Per quanto riguarda il metano e l’ammoniaca, la geometria del dominio per una molecola con quattro coppie di elettroni è tetraedrica. Nella molecola d’acqua, due delle coppie di elettroni sono coppie solitarie piuttosto che coppie di legame. La geometria molecolare della molecola d’acqua è piegata. L’angolo di legame H-O-H è 104,5°, che è più piccolo dell’angolo di legame in NH3 (vedere Figura 11).

Figura 11. Molecola d’acqua.,
AB4E: Zolfo Tetrafluoruro, SF4
La struttura di Lewis per SF 4 contiene quattro legami singoli e una coppia solitaria sull’atomo di zolfo (vedi Figura 12).

Figura 12. Elettroni coppia solitaria in SF4.
L’atomo di zolfo ha cinque gruppi di elettroni attorno ad esso, che corrisponde alla geometria del dominio bipiramidale trigonale, come in PCl 5 (vedi Figura 13). Ricordiamo che la geometria bipiramidale trigonale ha tre atomi equatoriali e due atomi assiali attaccati all’atomo centrale., A causa della maggiore repulsione di una coppia solitaria, è uno degli atomi equatoriali che vengono sostituiti da una coppia solitaria. La geometria della molecola è chiamata tetraedro distorto o altalena.

Figura 13. Palla e bastone modello per SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- La presenza di elettroni a coppia solitaria influenza la forma tridimensionale della molecola.
Pratica
l’Atomo Centrale Senza Lone Pairs
Utilizzare il link sottostante per rispondere alle seguenti domande:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Qual è la forma di PF 5 ?
- Quali angoli C-H bod prevederemmo per il metano se la molecola fosse planare?
- Quale molecola ha la configurazione di un ottaedro?,
Atomo centrale con una o più coppie solitarie
Usa il link sottostante per rispondere alle seguenti domande:
- Qual è il principio generale nel trattare molecole contenenti più di quattro coppie di elettroni?
- Nell’immagine con cinque coppie di elettroni attorno all’atomo centrale, perché è preferita la disposizione a destra?
- Nella foto con sei coppie di elettroni, perché la configurazione con le coppie solitarie a 180o tra loro è più stabile?,
Recensione
Atomo centrale senza coppie solitarie
- Quali sono gli angoli di legame nell’anidride carbonica?
- Quale molecola ha angoli di legame di 109,5 ° ?
- Qual è la geometria della molecola BF 3?
Atomo centrale con una o più coppie solitarie
- Perché l’acqua ha una geometria piegata?
- Perché l’ammoniaca non è una molecola planare?
- Come scriveremmo la configurazione per il tetrafluoruro di xeno usando il sistema ABE?















