Frontiere nella scienza delle piante
Introduzione
La corretta progressione della maturazione dei frutti è essenziale per ottenere sia una qualità ottimale del frutto che una lunga durata, caratteristiche importanti che determinano i mercati dei Tuttavia, la maturazione è un processo complesso in cui sono coinvolti molti fattori, incluso il controllo ormonale, che regola i cambiamenti biochimici e fisiologici che conferiscono proprietà organolettiche e nutrizionali finali del frutto., Tradizionalmente, i frutti carnosi sono stati classificati in base al processo di maturazione in frutti climaterici e non climaterici. Frutti climaterici come pomodori o banane richiedono un aumento della frequenza respiratoria e della produzione di etilene per scatenare il processo di maturazione in una risposta autocatalitica (Barry e Giovannoni, 2007; Liu et al., 2015)., Antagonisticamente, i frutti non climaterici come gli agrumi o l’uva non presentano uno scoppio né nell’etilene né nella respirazione prima dell’inizio della maturazione, e in questi frutti la maturazione è controllata principalmente dall’accumulo progressivo dell’acido abscissico del fitormone (ABA; Rodrigo et al., 2006; Castellarin et al., 2011). Tuttavia, nuovi studi stanno rafforzando l’idea che il processo di maturazione non è solo governato dalla produzione di un fitormone, ma sembra piuttosto essere il risultato di un equilibrio ormonale controllato (Symons et al., 2012; Teribia et al., 2016; Li et al., 2019).,
Le auxine, l’acido salicilico (SA) e la melatonina sono fitormoni coinvolti nella segnalazione e nella regolazione di molti processi cruciali nelle piante. Le auxine sono state ampiamente descritte come regolatori di crescita e sviluppo con funzioni multiple nelle piante (vedi Taylor-Teeples et al., 2016); SA innesca la risposta di difesa contro i patogeni biotrofici ed emi-biotrofici (Loake e Grant, 2007) oltre ad avere un ruolo importante sotto stress abiotico (Dong et al., 2014; Wani et al., 2017), fioritura e controllo del ciclo cellulare (Carswell et al., 1989; Eberhard et al.,, 1989, rispettivamente); e la melatonina non solo è stata trovata per avere funzioni simili all’auxina (Chen et al., 2009; Zuo et al., 2014; Wen et al., 2016) ma è stato anche suggerito di agire come un potenziale antiossidante in alcune piante (Arnao e Hernández-Ruiz, 2015) e un regolatore delle risposte delle piante ai patogeni (Chen et al., 2018). È interessante notare che questi tre ormoni condividono un precursore comune-corismato -, quindi si verifica un cross-talk metabolico tra di loro, e un certo numero di geni deve essere regolato finemente per deviare il metabolismo del corismato verso questi composti., Negli ultimi anni, diverse recensioni hanno affrontato la biosintesi e il ruolo dell’auxina (Paul et al., 2012), SA (Asghari e Aghdam, 2010) e melatonina (Feng et al., 2014; Arnao e Hernández-Ruiz, 2018) in frutta. Tuttavia, la loro biosintesi e le loro funzioni sono state per lo più descritte separatamente. Qui, discuteremo gli aspetti comuni e differenziali della biosintesi, del metabolismo e della funzione di auxina, SA e melatonina nella crescita e maturazione dei frutti climaterici e non climaterici., L’accento sarà posto sui punti chiave della diversione metabolica nella loro biosintesi dal corismato, sul ruolo regolatorio durante la maturazione dei frutti climaterici e non climaterici e sul loro ruolo nella modulazione della biosintesi dei composti bioattivi, che determina in gran parte la qualità del frutto.
Fitormoni derivati dal corismato
Il corismato è il prodotto finale della via dello shikimato e svolge un ruolo chiave nella biosintesi dei fitormoni (Figura 1)., Il corismato dà origine ad amminoacidi aromatici, incluso il triptofano, e attraverso diverse reazioni, inclusa la conversione del triptofano in acido indolo-3-piruvico da parte della triptofano aminotransferasi (TA); può generare l’auxina indolo-3-acido acetico (IAA). TA è stato proposto come enzima chiave universale per la biosintesi IAA non solo negli organi vegetativi (Enríquez-Valencia et al., 2018) ma anche nello sviluppo di organi riproduttivi (Reyes-Olalde et al., 2017), compresa la crescita e la maturazione dei frutti (Estrada-Johnson et al., 2017)., Al contrario, quando viene attivata l’isocorismato sintasi (ICS), il corismato può essere convertito in isocorismato e quest’ultimo può essere trasformato in SA. Nonostante il fatto che questa via sia stata identificata per la prima volta nei batteri, è attualmente ben consolidata anche nelle piante (Wildermuth et al., 2001; Uppalapati et al., 2007; Catinot et al., 2008; Garcion et al., 2008; Abreu e Munné-Bosch, 2009). Infine, il triptofano può trasformarsi in triptamina dall’enzima triptofano decarbossilasi (PMS)., Sebbene questa sia un’altra delle molteplici vie della biosintesi IAA (la triptamina si trasforma in indolo-3-acetaldeide e successivamente in IAA), la PMS è stata anche proposta come il primo enzima limitante la velocità nella via della melatonina (Kang et al., 2007). La TDC è stata identificata per la prima volta nella famiglia Apocynaceae (De Luca et al., 1989) per essere successivamente descritto in un certo numero di sistemi vegetali (Byeon et al., 2012, 2014; Zhao et al., 2013; Wei et al., 2018)., Dopo la decarbossilazione, la triptamina viene convertita in serotonina dalla triptamina-5-idrossilasi, e quindi la serotonina si trasforma in N-acetil-serotonina per produrre infine melatonina nel citosol (Figura 1).
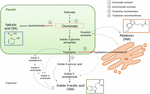
Figura 1. Biosintesi di acido indolo-3-acetico (IAA), acido salicilico (SA) e melatonina (Mel) da corismato. Tutti e tre i composti condividono un precursore finale comune (corismato, quadrato in arancione) dalla via dello shikimato., I principali punti di deviazione sono indicati con frecce rosse e gli enzimi corrispondenti sono numerati in ordine di divergenza di discesa da shikimate. Le frecce tratteggiate in grassetto indicano più di un passo tra i composti. Sottili frecce tratteggiate indicano percorsi che non sono ancora ben definiti.
Gli enzimi chiave-devianti che portano alla sintesi degli ormoni della via del corismato sono stati recentemente identificati nei frutti carnosi (Figura 1). ICS, la cui espressione ha dimostrato di essere cruciale per la tolleranza allo stress biotico (Garcion et al.,, 2008; Zeng e Lui, 2010), è stato identificato in pomodori e mele. Zhu et al. (2016) ha riportato la sovraespressione di ICS1 (isocorismato sintasi 1) in condizioni di conservazione a freddo nel pomodoro, mentre Zhang et al. (2017) ha trovato l’attivazione di un fattore di trascrizione coinvolto nella via di segnalazione SA correlata all’agente patogeno che induce l’espressione di ICS nelle mele. È stata riportata una maggiore attività della PMS nei frutti acerbi di pepe dopo l’infezione da agenti patogeni – attraverso un aumento dell’espressione di TDC1 e TDC2 (Park et al., 2013) – e nella fase di crescita nel frutto di gelso (Wang et al., 2016)., Infine, la TA è stata identificata nella vite, sia a pre-che a véraison (Böttcher et al., 2013; Gouthu e Deluc, 2015, rispettivamente) e durante la maturazione delle fragole (Estrada-Johnson et al., 2017). È degno di nota, tuttavia, che i geni e gli enzimi descritti nei frutti climaterici (cioè, ICS) non sono stati identificati nei frutti non climaterici (cioè, PMS e TA) e viceversa; quindi, ulteriori studi sono imperativi per colmare queste lacune di conoscenza e capire meglio come questi punti di deviazione sono regolati congiuntamente durante la maturazione dei frutti.,
Ruolo dei fitormoni derivati dal corismato nei frutti climaterici e non climaterici
Svelare i meccanismi dello sviluppo della frutta è stata una delle principali sfide della recente ricerca agronomica per le sue implicazioni economiche. In questo contesto, i fitormoni sono stati indicati come driver responsabili della maturazione dei frutti, in particolare l’etilene e l’ABA nei frutti climaterici e non climaterici, rispettivamente. Tuttavia, che questi fitormoni potrebbero regolare lo sviluppo della frutta da solo è stato presto dimostrato di essere troppo semplice., Dopo un’ampia ricerca e con il miglioramento della chimica analitica e delle tecniche molecolari, molti altri ormoni sono stati confermati come potenziali regolatori dello sviluppo e della maturazione dei frutti, compresi i fitormoni derivati dal corismato.
Le auxine si incrociano con altri ormoni durante l’allegagione, la crescita e la maturazione
Le auxine sono un gruppo di ormoni vegetali che svolgono un ruolo essenziale nello sviluppo della frutta, sia esercitando la propria influenza che modulando l’espressione di altri fitormoni., I contenuti endogeni di IAA sono particolarmente elevati durante l’allegagione e durante le fasi di sviluppo della crescita iniziale, dopo di che le quantità di IAA tendono a diminuire prima dell’inizio della maturazione, sia in menopausa (Zaharah et al., 2012) e frutti non climaterici (Symons et al., 2012; Teribia et al., 2016), con apparentemente alcune eccezioni, come peaches (Tatsuki et al., 2013) e alcune varietà di prugne (El-Sharkawy et al., 2014; Figura 2A). È stato dimostrato che IAA è coinvolto nell’iniziazione della frutta in combinazione con gibberelline (Mezzetti et al., 2004; Serrani et al., 2010; Bermejo et al., 2018; Hu et al.,, 2018). La compromissione della biosintesi o della segnalazione IAA generalmente porta alla partenocarpia della frutta, sebbene possa anche provocare una maturazione anormale in alcuni frutti (Wang et al., 2005; Liu J. et al., 2018; Reig et al., 2018). Alti contenuti di IAA nelle fasi iniziali dello sviluppo del frutto promuovono la crescita del frutto a causa dell’implicazione dell’auxina nella divisione cellulare in combinazione con citochinine e nel controllo dell’espansione cellulare in combinazione con gibberelline (Liao et al., 2018)., Durante questo periodo, la diafonia ormonale tra auxine e gibberelline consente inoltre di modellare la frutta normale in una regolazione perfezionata mediata da fattori di risposta auxina (ARFs; Liao et al., 2018; Liu S. et al., 2018).
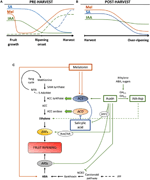
Figura 2. Ruolo di IAA, SA e Mel durante lo sviluppo di frutti climaterici e non climaterici. Modello che riassume le interazioni di IAA, SA e Mel durante la maturazione dei frutti climaterici e non climaterici durante (A) pre e (B) post – raccolta., Le linee tratteggiate indicano dinamiche alternative del contenuto di fitormoni in alcuni frutti (vedere il testo per la discussione). (C) Panoramica dell’interazione di IAA, SA e Mel con la biosintesi dell’acido abscissico e dell’etilene (ABA) nei frutti climaterici e non climaterici. L’auxina è un regolatore positivo della biosintesi dell’etilene mediante l’attivazione dei geni ACC sintasi (ACS) e l’induzione dell’espressione dei fattori di risposta all’etilene (ERFs). L’auxina inoltre reprime la produzione di ABA tramite la repressione della diossigenasi 9-cis-epossicarotenoide (NCED) e l’inibizione dei geni dello stress ABA-responsive (ARS) da parte della proteina ARF2., I contenuti endogeni di IAA possono essere ridotti dalle proteine GH3, la cui sintesi è promossa da etilene, ABA e zuccheri. La linea discontinua indica il possibile ruolo di IAA da parte di IAA-Asp come fattore di maturazione che migliora l’etilene in alcuni frutti. La melatonina aumenta la produzione di ABA ed etilene, sebbene l’ACS possa essere inibito a seconda del contenuto di melatonina. SA agisce come un inibitore dell’etilene che reprime i geni dell’ACC ossidasi (ACO), sebbene possa promuovere l’espressione di ACS., MTA, 50-metiltioadenosina; S-AdoMet, S-adenosil-metionina; SAM sintasi, S-adenosil-metionina sintasi; ACC, acido 1-amminociclopropano-1-carbossilico; IPP, isopentenil difosfato.
Sono state segnalate riduzioni del contenuto endogeno di IAA prima dell’inizio della maturazione in diversi frutti. Queste riduzioni sono state correlate alla coniugazione IAA con acido aspartico (IAA-Asp) da parte delle sintetasi IAA-amido, GH3-1 e GH3-2 (Figura 2C)., Infatti, GH3-1 e GH3-2 hanno mostrato una maggiore espressione durante lo sviluppo precoce dei frutti e, in particolare, durante l’inizio della maturazione sia nei frutti climaterici, come i pomodori (Sravankumar et al., 2018) e mele (Onik et al., 2018), così come nei frutti non climaterici, come le bacche d’uva (Böttcher et al., 2010, 2011) e lamponi (Bernales et al., 2019)., È interessante notare che le bacche d’uva hanno mostrato una maggiore espressione di GH3-1 dopo l’applicazione di ABA e ethephon, il che potrebbe spiegare il coinvolgimento dell’etilene nel controllo dei contenuti IAA dopo l’inizio della maturazione, anche nei frutti non climaterici (Böttcher et al., 2010). In effetti, diversi studi evidenziano la stretta interazione tra auxine ed etilene nella maturazione dei frutti, con un’influenza reciproca tra di loro (Tadiello et al., 2016a; Busatto et al., 2017)., Per i frutti climaterici, è necessario aumentare il contenuto di IAA per attivare l’espressione dei geni ACC sintasi (ACS), che codificano ACC sintasi, che a sua volta porterà alla produzione di etilene innescando il processo di maturazione (Figura 2C; Tatsuki et al., 2013). Frutti come pomodori (Li et al., 2016) o banane (Choudhury et al.,, 2008), che di solito sperimentano contenuti IAA ridotti prima dell’inizio della maturazione, mostrano un ritardo di maturazione quando IAA o analoghi sono applicati in modo esogeno, mentre frutti come le pesche, i cui contenuti IAA aumentano progressivamente fino a completa maturazione, mostrano una maturazione accelerata quando vengono applicate le auxine (Tadiello et al., 2016b). Pertanto, una regolazione stretta, complessa e differenziale delle interazioni auxina-etilene deve esistere in vari frutti durante la maturazione pre-raccolta., Inoltre, i contenuti di IAA diminuiscono prima dell’inizio della maturazione in alcuni frutti non climaterici per de-reprimere la diossigenasi 9-cis-epossicarotenoide (NCED) e iniziare la sintesi ABA (Figura 2C; Jia et al., 2016). È interessante notare che questo processo è anche mediato dalla coniugazione IAA attraverso una maggiore attività GH3-1 (Böttcher et al., 2010). Tuttavia, Estrada-Johnson et al. (2017) ha dimostrato che, sebbene i contenuti IAA diminuiscano durante la maturazione delle fragole, l’espressione delle famiglie geniche FaAux/IAA e FaARF è indotta nei recipienti rossi, suggerendo il coinvolgimento della segnalazione auxina nei frutti completamente maturi.,
Durante il post-raccolto, il contenuto di auxina di solito rimane invariante o tende a diminuire a causa di processi ossidativi che possono dare luogo a piccole, ma progressive riduzioni del contenuto endogeno di IAA (Figura 2B). I trattamenti auxina dopo la raccolta ritardano la sovra-maturazione in alcuni frutti (Chen et al., 2016; Moro et al., 2017) e aumentare il contenuto di alcuni acidi organici, mantenendo l’acidità della frutta (Li et al., 2017), suggerendo così che anche l’auxina svolge un ruolo significativo nel controllo della maturazione dei frutti durante il post-raccolto.,
Ruoli multipli dell’acido salicilico durante lo sviluppo e la maturazione dei frutti
L’acido salicilico è un altro fitormone derivato dal corismato che è stato principalmente correlato al suo effetto protettivo sotto stress biotico per controllare le perdite pre-raccolta e post-raccolta derivate dall’infezione da frutta patogeno (Babalar et al., 2007; Cao et al., 2013). In generale, i contenuti endogeni di SA libero sono più alti all’inizio dello sviluppo del frutto e poi diminuiscono progressivamente (Oikawa et al., 2015). Lu et al. (2015) ha riportato un aumento secondario di SA durante la seconda fase di crescita dei frutti di pesca., L’applicazione esogena di SA nelle banane ha ritardato il processo di maturazione riducendo lo scoppio respiratorio e il rapporto polpa-buccia, oltre a diminuire l’attività degli enzimi legati alla degradazione della parete cellulare e al sistema antiossidante (Srivastava e Dwivedi, 2000). Inoltre, il trattamento dei ciliegi dolci con acido salicilico e acetilsalicilico (ASA) ha aumentato il peso, la fermezza e il colore delle ciliegie in fase commerciale (Giménez et al., 2014). Applicazione esogena di SA o metil salicilato (MeSA) durante la post-raccolta, ritardata sovra-maturazione in frutti come kiwi (Zhang et al.,, 2003), e ciliegie dolci (Valero et al., 2011). Inoltre, i trattamenti con salicilico o ASA alleviato lesioni agghiaccianti di melograni (Sayyari et al., 2011), pomodori (Aghdam et al., 2014), e avocado (Glowacz et al., 2017). SA interagisce anche con l’etilene attraverso l’inibizione dell’espressione dell’ACC ossidasi (ACO) (Shi e Zhang, 2012). Sorprendentemente, un aumento del contenuto di espressione di ACS nelle pere si trova anche dopo l’applicazione di SA in modo regolato dalla dose (Shi et al., 2013; Shi e Zhang, 2014). Pertanto, la regolazione della produzione di etilene dipendente da SA è finemente regolata (Figura 2C).,
Melatonina: un regolatore emergente per il controllo dello sviluppo della frutta
La melatonina è anche un ormone vegetale dalla via derivata dal corismato che ha guadagnato molta attenzione negli ultimi anni (Hernández-Ruiz et al., 2005; Arnao e Hernández-Ruiz, 2018; Sharif et al., 2018). Recentemente, la melatonina è stata indicata come un fattore importante per l’allegagione, in modo simile agli effetti IAA (Figura 2A; Liu S. et al., 2018). Inoltre, è stata osservata la produzione circadiana di questo fitormone (Kolář et al., 1997)., Durante la maturazione sugli alberi, le uve trattate con melatonina hanno mostrato una maggiore sincronicità e un aumento di peso quando maturano completamente (Meng et al., 2015). Inoltre, un altro recente studio di Xu et al. (2018) ha descritto che la melatonina potrebbe promuovere la maturazione delle bacche d’uva attraverso la sua interazione con ABA ed etilene, così come il perossido di idrogeno. È stato dimostrato che la melatonina conferisce tolleranza al raffreddamento durante la conservazione a freddo della frutta, che sembra essere principalmente correlata alla sua attività antiossidante (Cao et al., 2018; Aghdam et al., 2019)., Durante la post-raccolta, i pomodori hanno mostrato una maggiore emissione di etilene dopo l’applicazione di melatonina a 50 µM (Sun et al., 2015), contrariamente alle pere, dove l’applicazione esogena di melatonina a 100 µM ha inibito la produzione di etilene (Zhai et al., 2018), o frutti di banana, dove la melatonina a 50-200 µM ha inibito l’espressione di ACS e ACO (Figura 2C; Hu et al., 2017). Sebbene diversi effetti dell’applicazione della melatonina possano essere correlati a un effetto di dosaggio, sono necessarie ulteriori ricerche per comprendere meglio il ruolo della melatonina nel controllo dello sviluppo della frutta.,
Cross-Talk dei fitormoni derivati dal corismato nel controllo dello sviluppo della frutta
È stato dimostrato che durante lo sviluppo e la maturazione della frutta si verifica una diafonia ormonale tra fitormoni derivati dal corismato. Breitel et al. (2016) ha scoperto che le auxine possono interagire con SA attraverso ARF2 (Figura 2C) e che la sovraespressione di ARF2 nel pomodoro ha comportato un contenuto inferiore di SA e un significativo ritardo di maturazione., Ciò indica che le auxine potrebbero limitare la produzione di SA durante lo sviluppo della frutta, il che potrebbe spiegare un compromesso tra la crescita della frutta (mediata dall’auxina) e l’attivazione delle difese biotiche (mediate dalla SA). Inoltre, l’applicazione esogena di SA sui frutti di papaya ha provocato un’espressione alterata di diversi geni IAA, alcuni dei quali sono down-regolati mentre altri up-regolati (Liu et al., 2017)., In questo caso, i risultati sono stati inconcludenti di ciò che realmente si verifica endogeno nel presunto cross-talk tra auxina e SA durante la maturazione dei frutti e sono necessarie ulteriori ricerche in questo e in altri frutti climaterici. In ogni caso, è chiaro che IAA e SA sono strettamente correlati, non solo metabolicamente ma anche funzionalmente. Infine, diversi studi hanno riportato l’influenza della melatonina sulla biosintesi e/o segnalazione IAA e SA (recensita in Arnao e Hernández-Ruiz, 2018), anche se a nostra conoscenza, nessuno di questi studi è stato eseguito né in menopausa né in frutti non climaterici.,
Modulazione della biosintesi dei composti bioattivi da parte dei fitormoni derivati dal corismato
I composti bioattivi (compresi i composti fenolici, gli isoprenoidi e le vitamine antiossidanti) non solo sono stati ampiamente studiati come responsabili di specifiche proprietà organolettiche degli alimenti, ma anche dei loro effetti protettivi nelle cellule umane contro i processi ossidativi nello sviluppo di malattie neurodegenerative e cardiovascolari, 1999; Mueller et al., 2010; Storione e Ronnenberg, 2010; Björkman et al., 2011)., I composti fenolici contribuiscono in modo significativo a conferire sapori specifici, come i tannini-responsabili del gusto amaro o astringente di alcuni frutti, e colori, come i pigmenti antociani-responsabili dei colori della frutta rossa, blu e viola (Croteau et al., 2000). La rilevanza dei composti fenolici per il consumo umano è stata associata a un effetto protettivo contro i processi ossidativi in relazione alla salute cardiovascolare e del sistema nervoso centrale, nonché a un ridotto rischio di tumori del tratto gastrointestinale (Björkman et al., 2011)., I carotenoidi, tetraterpeni appartenenti agli isoprenoidi, svolgono un ruolo nella protezione contro i processi foto-ossidativi e come pigmenti organici; sono responsabili del colore giallo-arancio dei frutti (Tapiero et al., 2004). I carotenoidi dietetici sono pensati per fornire benefici per la salute nel ridurre il rischio di malattie degli occhi e alcuni tipi di tumori a causa del loro ruolo di antiossidanti (Johnson, 2002). Le vitamine C ed E, tra cui l’acido ascorbico e i tocoferoli, rispettivamente, sono fattori di qualità nutrizionale essenziali nei frutti con molte attività biologiche nell’uomo (Miret e Müller, 2017)., Considerando il ruolo rilevante di tutti questi composti bioattivi come composti che promuovono la salute nei frutti, la modulazione del loro accumulo è di fondamentale importanza sia nei frutti climaterici che non climaterici (Vasconsuelo e Boland, 2007). La maggior parte di questi composti bioattivi si accumula ad alti livelli durante la maturazione dei frutti, quando i frutti verdi meno appetibili conversano in un frutto nutrizionalmente ricco, colorato e gustoso (Daood et al., 1996; Ranalli et al., 1998; Dumas et al., 2003; Singh et al., 2011)., Tuttavia, una volta iniziata, la maturazione non può essere bloccata e generalmente porta a una maturazione eccessiva che influisce negativamente sulla qualità del frutto (Kumar et al., 2014). Pertanto, ridurre al minimo il deterioramento della frutta post-raccolta mentre si ottengono alti contenuti di composti bioattivi rimane una delle maggiori sfide da risolvere.
L’auxina è stata identificata come un importante regolatore della biosintesi dei carotenoidi durante la maturazione dei frutti di pomodoro climaterici. La maturazione nel pomodoro è associata alla degradazione della clorofilla e allo spostamento delle xantofille ai caroteni (β-carotene e licopene) (Fraser et al., 1994)., IAA sembra ritardare la maturazione del pomodoro reprimendo l’etilene e diversi trascritti di carotenoidi a monte tra cui Psy, Ziso, Pds, Critiso e Clasi 1-3 e, d’altra parte, promuovendo l’accumulo di trascritti β-Lyc1 e Crtr-β1, con conseguente contenuto più elevato di xantofille e clorofilla a (Su et al., 2015). Inoltre, in alcuni frutti non climaterici come la ciliegia e le bacche d’uva, l’auxina sembra anche modulare la biosintesi dell’antociano e quindi controllare i processi di maturazione dei frutti. Teribia et al., (2016) ha riportato una correlazione negativa tra IAA e il contenuto di antociani che indica che l’accumulo di antociani inizia quando il contenuto di IAA diminuisce. Inoltre, l’applicazione dell’acido benzotiazolo-2-ossiacetico (BTOA), composto sintetico simile all’auxina, ha ritardato l’up-regulation dei geni che promuovono gli enzimi della biosintesi degli antociani come la calcone sintasi e l’UDP-glucosio:flavonoide 3-O-glucosiltransferasi nelle bacche d’uva (Davies et al., 1997).,
I trattamenti pre e post – raccolta con salicilati, tra cui SA e i suoi derivati ASA e MeSA, sono stati segnalati per regolare l’accumulo di composti bioattivi che portano a una migliore attività antiossidante nei frutti climaterici e non climaterici. Diversi frutti come prugna, ciliegia e albicocche sono noti per avere una vita breve con un rapido deterioramento della qualità dopo la raccolta. Pertanto, vi è una costante ricerca di trattamenti che migliorano e mantengono la qualità della frutta, e in particolare il contenuto di composti bioattivi con effetti benefici sulla salute., I trattamenti di prugne con SA, ASA e MeSA hanno portato a significativi contenuti più elevati di acido ascorbico, antociani e composti fenolici sia alla raccolta che dopo una conservazione a freddo prolungata (40 giorni a 4°C; Martínez-Esplá et al., 2017). Risultati simili potrebbero essere osservati per i trattamenti pre-raccolta con SA, ASA e MeSA nelle ciliegie dolci (Giménez et al., 2014, 2015, 2017). Inoltre, il trattamento post-raccolta con SA, ASA o MeSA ha mantenuto il contenuto fenolico totale e il contenuto di antociani durante la conservazione a freddo nel melograno (Sayyari et al., 2011), ciliegia dolce (Valero et al.,, 2011), ciliegia di corniola (Dokhanieh et al., 2013), e albicocca (Wang et al., 2015). Questi risultati suggeriscono che i salicilati possono essere coinvolti nell’attivazione della fenilalanina ammoniaca liasi, che è il principale enzima coinvolto nella via biosintetica dei composti fenolici (Martínez-Esplá et al., 2017).
Recentemente, la melatonina ha dimostrato di regolare la maturazione dei frutti e modulare i composti bioattivi. I trattamenti post-raccolta con melatonina nei frutti di pesco hanno aumentato la tolleranza al raffreddamento attivando sistemi antiossidanti., La lesione da raffreddamento si verifica nei frutti di pesca durante la conservazione a bassa temperatura (tra 2 e 7,6°C) caratterizzata da doratura della carne, maturazione anormale e maggiore sensibilità al decadimento (Lurie e Crisosto, 2005). Cao et al. (2018) ha riferito che le pesche trattate con melatonina hanno mostrato una maggiore abbondanza di trascrizione dei geni di biosintesi dell’acido ascorbico PpGME, PpGPP e PpGLDH al settimo e PpGMPH al 21 ° e 28 ° giorno di conservazione rispetto al controllo con conseguente aumento del contenuto di acido ascorbico., Inoltre, la melatonina ha indotto aumenti nelle attività di G6PDH, SKDH e PAL, che sono gli enzimi essenziali per la biosintesi dei composti fenolici. Gli autori suggeriscono che il trattamento con melatonina protegge la frutta di pesco in una certa misura da lesioni agghiaccianti attivando specificamente la biosintesi dei composti fenolici (Gao et al., 2018). Inoltre, un’analisi di proteomica differenziale senza etichetta ha rivelato l’effetto della melatonina sulla promozione della maturazione dei frutti e dell’accumulo di antociani dopo la raccolta nei frutti di pomodoro (Sun et al., 2016)., Gli autori hanno riferito che la melatonina esogena ha aumentato otto enzimi relativi alla via antocianina tra cui tra l’altro flavonol-3-idrossilasi, flavanone 3 beta-idrossilasi, antocianidina sintasi/leucoantocianidina diossigenasi e antocianidina 3-O-glucosiltransferasi. Inoltre, il trattamento post-raccolto con melatonina ha aumentato i fenoli totali e gli antociani nei frutti di fragola (Aghdam e Fard, 2016) e ha ritardato la perdita di fenoli totali, flavonoidi e antociani nei frutti di litchi (Zhang et al., 2018)., I trattamenti con melatonina hanno aumentato il contenuto di fenoli, antociani e flavonoidi nelle bacche d’uva (Xu et al., 2017). Inoltre, la melatonina è stata riportata per migliorare l’accumulo di licopene e la produzione di etilene nei pomodori, suggerendo che la melatonina può aumentare il contenuto di licopene influenzando la biosintesi e la segnalazione dell’etilene (Sun et al., 2015)., La partecipazione dell’etilene nella regolazione indotta dalla melatonina dei composti bioattivi è stata osservata anche nelle bacche d’uva, dove il trattamento a doppio blocco dell’etilene ha mostrato effetti ridotti della melatonina sul contenuto di polifenoli (Xu et al., 2017).
Conclusione
Si conclude che i fitormoni derivati dal corismato, tra cui auxina, SA e melatonina, non solo condividono un precursore comune, ma svolgono ruoli essenziali nella regolazione della crescita e della maturazione dei frutti., Un cross-talk metabolico e funzionale tra loro e con altri fitormoni avviene in modo spaziotemporale per regolare finemente lo sviluppo di frutti climaterici e non climaterici. Le differenze nelle dinamiche all’interno dei frutti climaterici e non climaterici dimostrano che la risposta degli ormoni derivati dal corismato non è universale ma piuttosto fortemente specifica per specie. Inoltre, i fitormoni derivati dal corismato modulano anche l’accumulo di composti bioattivi, influenzando così la qualità del frutto., Sono tuttavia necessarie ulteriori ricerche per capire meglio come (i) altri ormoni, come l’etilene e l’ABA, modulano la loro biosintesi studiando i principali punti di deviazione metabolica, (ii) interagiscono a livello funzionale e molecolare e (iii) modulano congiuntamente la biosintesi dei composti bioattivi e di conseguenza influenzano non solo la crescita e la maturazione dei frutti, ma anche la qualità dei frutti climaterici e non climaterici.
Contributi dell’autore
SM-B ha concepito e progettato la recensione con l’aiuto di MP-L. MP-L, PM, MM e SM-B hanno scritto il manoscritto., MP-L figure preparate con l’aiuto di PM. Tutti gli autori hanno contribuito alla discussione delle idee, hanno rivisto e approvato il manoscritto finale.
Finanziamento
Questo lavoro è stato finanziato da un premio ICREA Academia assegnato a SM-B dal governo catalano.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Böttcher, C., Boss, PK, e Davies, C. (2011)., Le preferenze del substrato acilico di una IAA-amido sintetasi spiegano le variazioni nella maturazione delle bacche dell’uva (Vitis vinifera L.) causate da diversi composti auxinici che indicano l’importanza della coniugazione auxina nello sviluppo delle piante. J. Scad. Bot. 62, 4267–4280. doi: 10.1093/jxb/err134
PubMed Abstract | CrossRef Full Text/Google Scholar
Glowacz, M., Bill, M., Tinyane, PP, e Sivakumar, D. (2017)., Mantenimento della qualità post-raccolta degli avocado “Hass” conservati a freddo alterando il contenuto e la composizione degli acidi grassi con l’uso di composti volatili naturali-jasmonato di metile e salicilato di metile. J. Sic. Cibo. Agric. 97, 5186–5193. doi: 10.1002 / jsfa.8400
PubMed Abstract | CrossRef Full Text/Google Scholar
Zeng, W., and He, S. Y. (2010). Un ruolo prominente del recettore flagellin FLAGELLIN-SENSING2 nel mediare la risposta stomatica a Pseudomonas syringae pv pomodoro DC3000 in Arabidopsis. Impianto Physiol. 153, 1188–1198. doi: 10.1104 / pp. 110.,157016
PubMed Abstract | CrossRef Full Text | Google Scholar















