17.3:酸塩基指標
学習目標
- 酸塩基指標の機能と色の変化について説明する
- 滴定実験に適した指標を選択する方法を示す
- 指標の酸性解離定数KaまたはKaiを決定する。
ヒドロニウムイオン濃度が特定の値に達すると、希釈溶液中で特定の有機物質が色を変えます。, 例えば、フェノールフタレインは、ヒドロニウムイオン濃度が5.0×10-9M(pH<8.3)より大きい任意のaqueous液中の無色の物質である。 ヒドロニウムイオン濃度が5.0×10-9M(pH>8.3)未満のより塩基性の溶液では、赤色またはピンク色である。 溶液のpHを決定するために使用することができるフェノールフタレインのような物質は、酸塩基指標と呼ばれる。 酸塩基指標は、弱有機酸または弱有機塩基のいずれかである。,弱酸である酸塩基指示薬メチルオレンジの溶液中の平衡は、複雑なメチルオレンジ分子の単純な表現としてHInを使用する式で表すことができる:
\
\}{}}=4.0×10^{-4}\]
メチルオレンジの陰イオン、In−は黄色であり、非イオン化形態、HInは赤色である。 メチルオレンジの溶液に酸を添加すると,ヒドロニウムイオン濃度の増加は,Lechatelierの原理に従って,平衡を非イオン化赤色形態にシフトさせる。 ベースを追加すると、平衡が黄色の形に向かってシフトします。, この動作は、バッファの動作と完全に類似しています。
インジケータの色は、二つの種の濃度の比の目に見える結果であるIn−とHIn。 インジケータのほとんど(典型的には約60−90%以上)がIn−として存在する場合、メチルオレンジの場合は黄色になるIn-イオンの色が表示されます。 ほとんどがHInとして存在する場合、HIn分子の色が表示されます:メチルオレンジの場合は赤です。, メチルオレンジの場合、Kaの方程式を再配置して次のように書くことができます。
\}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}\]
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\right)=log\left(\dfrac{}{}\right)}\right)\right)\right)\left(\mathit{K}_a}\right)\right)\right)\right)\right)\right)\right)\right)\right)\right)\right)\right)\left(\mathit{K}_a\right)\right)\right)\right)\right)\right)\right)\right)\right)\right)p>
\)-ログ(\mathit{k}_a)=-ログ\左(\dfrac{}{}\右)}\]
\}{}\右)\:または\:ph=p\mathit{k}_a+ログ\左(\dfrac{}{}\右)}\]
最後の式は、ヘンダーソンと同じです-指標の平衡を記述するために使用することができるハッセルバルヒ方程式。,
Kaと同じ数値を持つ場合、toの比率は1に等しく、指標の50%が赤い形(HIn)で存在し、50%が黄色のイオン形(In−)であり、溶液はオレンジ色に見えることを意味する。 ヒドロニウムイオン濃度が8×10-4M(ph3.1)に増加すると、溶液は赤色に変わる。 ヒドロニウムイオン濃度のさらなる増加(phの低下)に対しては、色の変化は見えない。 4×10-5Mのヒドロニウムイオン濃度で(pHは4.,4)、表示器のほとんどは黄色いイオンの形態にあり、hydroniumイオン集中のそれ以上の減少(pHの増加)は目に見える色の変更を作り出しません。 3.1(赤)と4.4(黄色)間のpHの範囲はメチルのオレンジの色変化間隔です;顕著な色の変更はこれらの水素イオン濃度指数の間で起こります。
監視すべき特定の反応に応じて、多くの異なる物質を指標として使用することができる。, 例えば、赤キャベツジュースには、低pHでは濃い赤色から中間pHでは薄い青色に変化し、高pHでは黄色に変化する着色物質の混合物が含まれています(図\(\PageIndex{1}\))。 しかし、すべての場合において、良好な指標は次の特性を有する必要があります。
- 色の変化を容易に検出する必要があります。
- 色の変化は急速でなければなりません。
- 指示薬分子は、滴定される物質と反応してはならない。誤差を最小限に抑えるために、指示薬は、滴定の等価点において予想されるphの一つのph単位内にあるpkinを有するべきである。,

図\(\PageIndex{1}\):赤キャベツジュースに天然に存在するpH指標。 ウィキペディアの画像curtesty。 赤キャベツジュースには、色がpHに依存する物質の混合物が含まれています。各試験管には、水に赤キャベツジュースの溶液が含まれていますが、溶液のpHはpH=2.0(左端)からpH=11.0(右端)まで変化します。 PH=7.0では、溶液は青色である。,
これらの基準を満たし、実質的に全pH範囲をカバーする合成指標が開発されている。 図\(\PageIndex{2}\)は、いくつかの一般的な指標が色を変化させるおおよそのpH範囲とその色の変化を示しています。 さらに、いくつかの指標(チモールブルーなど)は、広く分離されたpH値で二度色を変えるポリプロトン酸または塩基である。
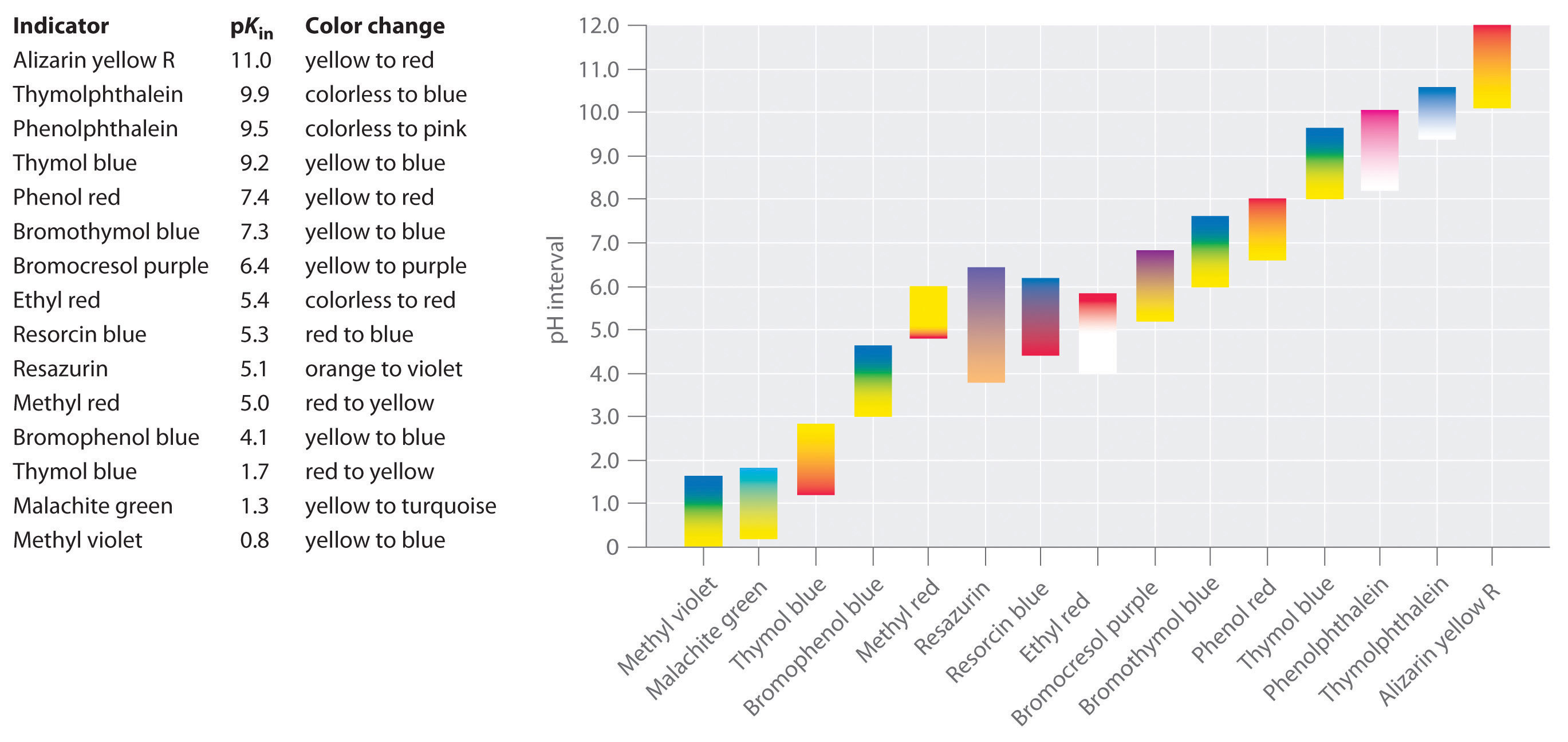
図\(\PageIndex{2}\):いくつかの一般的な酸塩基指標。, おおよその色が、pKin値および色が変化するpH範囲とともに示されています。 指標は特定のpH値で急激に色が変化するのではなく、実際には他の酸や塩基と同じようにpH滴定を受けることに注意すること Hinの濃度が減少し,In-の濃度が増加するにつれて,溶液の色はHinの特徴的な色からIn-の色にゆっくりと変化した。 セクション16で見るように、/比率は0から変更されます。,PKinより下のpH一単位で1-pKinより上のpH一単位で10。 これによりましてほとんどの指標に変色以上のpH範囲につpH。
我々は、良好な指標は、等価点で予想されるpHに近いpKin値を有するべきであると述べている。 強酸-強塩基滴定の場合、指示薬の選択は、等価点周辺で起こるpHの非常に大きな変化のために特に重要ではない。, 対照的に、弱酸または弱塩基の滴定に間違った指示薬を使用すると、図\(\PageIndex{3}\)に示すように、比較的大きな誤差が生じる可能性があります。 この図は、50.0mLの強酸(HCl)および弱酸(酢酸)の0.100m溶液を0.100m\(NaOH\)で滴定するために添加された塩基の体積に対するpHのプロットを示しています。 二つの一般的な指標(メチルレッド、\(pK_{in}=5.0\)、およびフェノールフタレイン、\(pK_{in}=9.5\))が色を変えるpH範囲も示されています。, 水平バーは、両方の指示薬が色を変化させるpH範囲を示し、HCl滴定曲線を横切り、ほぼ垂直である。 したがって、本質的に同じ量の\(NaOH\)が加えられたとき(約50mL)、これは等価点に対応する。 これに対して、酢酸の滴定は、メチルレッドまたはフェノールフタレインが指示薬として使用されるかどうかによって非常に異なる結果を与える。, フェノールフタレインが色を変化させるph範囲は強酸滴定の等価点でのphよりわずかに大きいが,滴定曲線のこの部分の傾きのために誤差は無視できる。 HCl滴定と同様に、約50mLの\(NaOH\)が酢酸溶液に添加されると、フェノールフタレイン指示薬はピンク色に変わります。 対照的に、メチルレッドは、等価点ではなく、酢酸滴定の中点近くにあるpH5の周りで赤色から黄色に変化し始める。, 従って\(NaOH\)の約25-30のmLだけ加えることによりメチルの赤い表示器は巨大な間違いに終って色を、変えます。
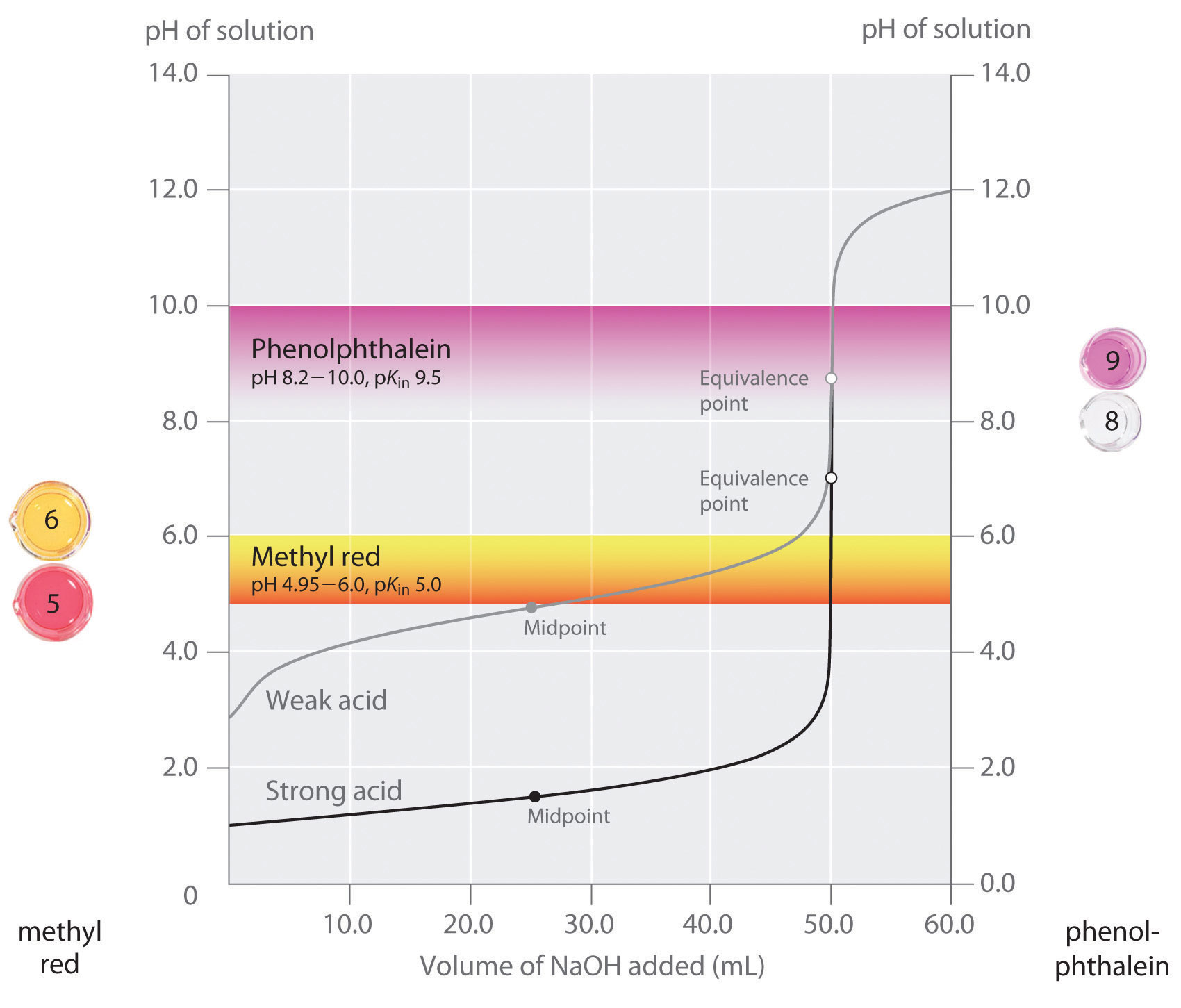
図\(\PageIndex{3}\):酸塩基滴定のための正しい指標の選択 グラフは、0.100M溶液の滴定のための二つの指標(メチルレッドとフェノールフタレイン)0.100m\(naoh\)を有する強酸(hcl)および弱酸(酢酸)の。, 等価点の周りの強酸の滴定曲線の急峻さのために、いずれかの指標は、強酸の滴定の等価点で急速に色を変化させる。 対照的に、メチルレッド(5.0)のpKinは酢酸(4.76)のpKaに非常に近く、メチルレッドの色変化の中点は、等価点ではなく滴定の中点付近で起こる。
一般に、強塩基を有する強酸の滴定(およびその逆)の場合、約4.0および10.0の間にpKを有する指標が行う。, しかし、弱酸の滴定には、等価点でのpHが7.0より大きいため、pKin>7.0のフェノールフタレインやチモールブルーなどの指標を使用する必要があります。 逆に、等価点でのpHが7.0未満の弱塩基の滴定には、pKin<7.0のメチルレッドまたはブロモクレゾールブルーなどの指示薬を使用する必要があります。
例\(\PageIndex{1}\)
強塩基を有する弱酸の滴定において、どの指標が最良の選択であろうか?,
- メチルオレンジ
- ブロモクレゾールグリーン
- フェノールフタレイン
溶液
正しい答えはCです。強塩基を有する弱酸の滴定において、弱酸の共役塩基は等価点でのpHを7より大きくする。 したがって、そのpH範囲でインジケータを変更する必要があります。 メチルオレンジとブロモクレゾールグリーンは酸性ph範囲で色を変化させ,フェノールフタレインは塩基性phで変化させた。,
異なる色およびpKin値を有する多くの異なる指標の存在は、高価な電子pH計および壊れやすいpH電極を使用せずに溶液のpHを推定する便利な方 指標の組み合わせを含浸させた紙またはプラスチックストリップは”pH紙”として使用され、pH紙を単に浸漬し、得られた色を容器に印刷された標準と比較することによって溶液のpHを推定することができる(図\(\PageIndex{4}\))。,
図\(\PageIndex{4}\):pH紙。 pH紙には、異なるpH値で色が変化する一連の指標が含まれています。 溶液のおおよそのpHは、単に紙片を溶液に浸漬し、提供された規格と色を比較することによって決定することができる。 概要
酸塩基指標は、特定のpHで色が変化する化合物です。, それらは、典型的には弱酸または塩基であり、その色の変化は指示薬自体の脱プロトン化またはプロトン化に対応する。
貢献者と帰属
-
ポール-フラワーズ(ノースカロライナ大学-ペンブルック)、クラウス-セオポルド(デラウェア大学)、リチャード-ラングレー(スティーブン-F-オースティン州立大学) 教科書コンテンツ制作OpenStax大学ラリークリエイティブ-コモンズ表示4.0ライセンス許諾します。 で無料でダウンロードhttp://cnx.org/contents/85abf193-2bd…[email protected])。
- {テンプレート。,コントリバウンドレス()}}















