非専攻のための化学 (日本語)
学習目標
- VSEPR理論の影響を受ける形状の分子を記述します。
- 孤独なペアを定義します。
- 孤立電子対電子が分子幾何学にどのように影響するかを記述します。li>
電気スコープはどのように機能しますか?
電気スコープは電荷を研究するために使用されるデバイスです。 正に帯電した物体(ロッド)が上部のポストに近づくと、電子は二つの金の葉postivleyが帯電したまま瓶の上部に流れます。, 葉は両方とも電荷のようにpostiveを保持するので、お互いを撃退します。 VSEPR理論は、原子価電子対ができるだけ離れているように分子の形状が調整されるように、電子対、同様の電荷のセットも互いに反発すると述べている。

孤立電子対のない中心原子
可能な分子の種類を簡単に理解するために、簡単なシステムを使用して分子の部分を特定します。,
a=分子中の中心原子
B=中心原子を取り囲む原子
Bの後の添字は、中心A原子に結合しているB原子の数を示すことになります。
a=分子中の中心原子
B= 例えば、AB4は、四つの共有結合した原子によって囲まれた中心原子を有する分子である。 ものでない場合には債券をシングル、ダブル、トリプルル債券があります。
AB2:水素化ベリリウム(BeH2)
水素化ベリリウムは、水素原子に二つの単結合を有する中心ベリリウム原子からなる。 リコールに違反するオクテットです。,
H-Be-H
電子対が互いからの距離を最大化するという要件に従って、BeH2分子の二つの結合対は、中心Be原子の直接反対側に配置されます。 結果として得られるジオメトリは線形分子であり、図1に”ボールとスティック”モデルで示されています。

図1. 水素化ベリリウムモデル。
H-Be-Hからの結合角は、その線形幾何学のために180°である。,
二酸化炭素は、AB2カテゴリーに該当する分子の別の例です。 そのルイス構造は、中心炭素と酸素原子の間の二重結合からなる(図2参照)。

図2. 二酸化炭素の結合。
四つの電子の二つのグループ(二対)間の反発は、BeH2分子中の二つの電子の二つのグループ(一対)の反発と変わらない。 二酸化炭素も線形です(図3参照)。,

図3. 二酸化炭素だ
AB3:三フッ化ホウ素(BF3)
三フッ化ホウ素は、フッ素原子に三つの単結合を持つ中心ホウ素原子で構成されています図4参照。 ホウ素原子も不完全なオクテットを持っています。
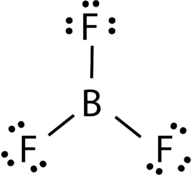
図4. 三フッ化ホウ素結合。
BF3分子の幾何学的形状は三角平面と呼ばれます(図5参照)。 フッ素原子は、正三角形の頂点に配置されています。, F-B-F角度は120°であり、四つの原子はすべて同じ平面にある。

図5. 三フッ化ホウ素モデル。
AB4:メタン(CH4)
メタンは天然ガスの主成分である有機化合物です。 その構造は、水素原子に四つの単結合を有する中心炭素原子からなる(図6参照)。 互いからの距離を最大にするために、結合電子の四つのグループは同じ平面上にありません。, 代わりに、水素原子のそれぞれは四面体と呼ばれる幾何学的形状の角にあります。 炭素原子は四面体の中心にあります。 四面体の各面は正三角形です。

図6. メタンの四面体構造。
メタン分子の分子形状は四面体です(図7参照)。 H-C-H結合角は109.5°であり、これは分子が平面である場合の90°よりも大きい。, メタンなどの分子の構造式を描画する場合、その形状の三次元的性質を示すことができることが有利である。 以下の構造式は透視図と呼ばれます。 点線の結合はページに後退するように視覚化され、実線の三角形の結合はページから出てくるように視覚化されます。

図7. メタンの視点モデル。
これらの服はどのようにしてこのような小さなスペースに収まりますか?,
私たちが旅行するとき、私たちはしばしば私たちが必要とするよりも多くのものを取ります。 スーツケースのそれにすべて合うことを試みることは実質の挑戦である場合もあ 私たちは再梱包するか、単にそれをすべて絞る必要があります。 原子はしばしば、より安定した構造を作り出すために電子がどこにあるかを再配置する必要があります。

一つ以上の孤立電子対を持つ中心原子
分子の分子構造は、中心原子が一つ以上の孤立電子対を持つときに変化します。, 結合対と孤立対の両方の電子対の総数は、電子ドメイン幾何学と呼ばれるものにつながります。 電子の結合対の一つ以上が孤立電子対に置き換えられると、分子の分子形状(実際の形状)が変化する。 前のセクションで確立されたaおよびB記号に従って、中心原子(A)上の孤立電子対を表すためにEを使用します。 添字は、孤独なペアが複数ある場合に使用されます。 周囲の原子(B)上の孤立電子対は幾何学的形状に影響しない。,
AB3E:アンモニア,NH3
アンモニア分子は、中心窒素原子上に三つの単結合と一つの孤立対を含んでいます(図8参照)。

図8. アンモニア中の孤立電子対。
CH4で見られたように、四つの電子対を持つ分子のドメイン幾何学は四面体である。 アンモニア分子では、電子対の一つは結合対ではなく孤立対である。 NH3の分子幾何学は三角錐と呼ばれています(図9参照)。,

図9. アンモニア分子。
四面体CH4分子の結合角は109.5°であることを思い出してください。 ここでも、結合した電子対の一方を孤立電子対に置き換えると、角度がわずかに圧縮されます。 H-N-Hの角度はおよそ107°である。
AB2E2:水、H2O
水分子は二つの結合対と二つの孤立対からなる(図10参照)。

図10. 水中の孤立電子対。,
メタンとアンモニアに関しては、四つの電子対を持つ分子の分域幾何学は四面体である。 水分子中では、二つの電子対は結合対ではなく孤立対である。 水分子の分子幾何学は曲がっています。 H-O-H結合角は104.5°であり、これはNH3の結合角よりも小さい(図11参照)。

図11. 水分子。,
AB4E:四フッ化硫黄,SF4
SF4のルイス構造は、四つの単結合と硫黄原子上の孤立対を含む図12参照。

図12. SF4における孤立電子対。
硫黄原子はその周りに五つの電子基を持ち、これはpcl5のように三角二錐ドメイン幾何学に対応しています(図13参照)。 三角二錐幾何学は、三つの赤道原子と二つの軸原子が中心原子に結合していることを思い出してください。, 孤立電子対のより大きな反発のために、それは孤立電子対に置き換えられる赤道原子の一つである。 分子の幾何学的形状は歪んだ四面体またはシーソーと呼ばれます。

図13. SF4のための球および棒モデル。,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- 孤立電子対の存在は、分子の三次元形状に影響を与えます。
練習
孤立電子対のない中心原子
以下の質問に答えるには、以下のリンクを使用してください。
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- PF5の形状は何ですか?
- 分子が平面であれば、メタンについてどのようなC-H bod角度を予測しますか?li>
- どのような分子が八面体の構成を持っていますか?,
一つ以上の孤立電子対を持つ中心原子
以下の質問に答えるには、以下のリンクを使用してください。
- 四つ以上の電子対を含む分子
- 中央原子の周りに五つの電子対を持つ写真では、なぜ右の配置が好ましいのですか?
- 六つの電子対を持つ画像では、なぜ互いに180oの孤立電子対を持つ構成がより安定ですか?,
レビュー
孤立電子対のない中心原子
- 二酸化炭素の結合角は何ですか?
- どの分子が109.5°の結合角を持っていますか?
- BF3分子の幾何学的形状は何ですか?
一つ以上の孤立電子対を持つ中心原子
- なぜ水は曲がった幾何学を持っていますか?li>
- なぜアンモニアは平面分子ではないのですか?
- ABEシステムを使用して四フッ化キセノンの構成をどのように書くのでしょうか?















