インフルエンザ(インフルエンザ)ワクチンの作り方
- 卵ベースのインフルエンザワクチン
- 細胞ベースのインフルエンザワクチン
- 組換えインフルエンザワクチン
米国には、米国食品医薬品局(FDA)によって承認された三つの異なるインフルエンザワクチンの製造技術があります外部アイコン:
- 卵ベースのインフルエンザワクチンの製造技術があります。ワクチン、
- 細胞ベースのインフルエンザワクチン、および
- 組換えインフルエンザワクチン。,
米国で市販されているすべてのインフルエンザワクチンは、民間部門の製造業者によって製造されている。 異なるメーカー別生産技術、インフルエンザワクチンを満たFDAの安全性と有効性の要件 異なるワクチンの違いに表示することができます。 参照型インフルエンザワクチン米国、2019-2020インフルエンザの季節別に表示することができます。
卵ベースのインフルエンザワクチン
インフルエンザワクチンが作られる最も一般的な方法は、卵ベースの製造プロセスを使用することです
70年以上にわたって使用されてきました。, 卵ベースのワクチン製造は、不活性化(殺された)ワクチン(通常は”インフルエンザショット”と呼ばれる)と弱毒化生ワクチン(通常は”鼻スプレーインフルエンザワクチン”と呼ばれる)
卵ベースの生産プロセスは、CDCまたはWHOグローバルインフルエンザサーベイランスおよび対応システムの他のラボパートナーから始まり、現在のFDA規制要件ごとに卵で栽培された候補ワクチンウイルス(Cvv), これらのCvvは受精鶏の卵にそれから注入され、ウイルスが複製するように数日間培養化されます。 ウイルスを含む液体は、卵から収穫される。 のための不活化インフルエンザワクチン(インフルエンザシュート)、ワクチンウイルスを不活性化(殺害し、ウイルス抗原は、精製したものである。 製造工程は質のテスト、詰物および配分と続きます。 鼻スプレーインフルエンザワクチン(すなわち、弱毒生インフルエンザワクチン–LAIV)の場合、開始Cvvは生きているが、異なる生産プロセスを経る弱化ウイルスである。, FDA試験を承認すべてのインフルエンザワクチンを前にリリースおよび出荷しています。
米国で使用するためのインフルエンザワクチンを作るためにこの生産技術を使用するいくつかの異なる製造業者があります。 この製造方法は、ワクチンを生産するために多数の鶏卵を必要とし、他の製造方法よりも時間がかかることがある。
細胞ベースのインフルエンザワクチン
また、2012年にFDAによって承認されたインフルエンザワクチンの細胞ベースの製造プロセスがあります。 最近まで、この生産プロセスはまた、FDA規制に従って卵成長Cvvから始まりました。, しかし、August31、2016、FDAは、米国で唯一のFDA承認細胞ベースのインフルエンザワクチンメーカーであるSeqirusの承認を発行し、細胞成長Cvvの使用を開始しました。 細胞の製造に不活化インフルエンザワクチンなどのインフルエンザの影).
細胞ベースのインフルエンザワクチ まず、CDCまたはその研究室のパートナーの一つは、ワクチンメーカーに提供されているCvvを作るために細胞内で増殖されたインフルエンザウイルスを使用し, 次に、ワクチン製造業者は、Cvvを(卵にではなく)培養mamm乳類細胞に接種し、Cvvが数日間複製する(すなわち、コピーを作る)ことを可能にする。 その後、細胞からウイルス含有液を採取し、ウイルス抗原を精製する。 製造工程は浄化およびテストと続きます。 最後に、FDAは放出および郵送物前にワクチンをテストし、承認します。
ワクチンの製造に使用されるワクチンウイルスは動物細胞で増殖するため、細胞ベースのインフルエンザワクチンの生産は鶏卵を必要としません。, 細胞ベースの技術にまたインフルエンザワクチンの製造工程のより速い開始のための潜在性があります。
前シーズンの細胞ベースのワクチンで使用されたウイルスは細胞内で増殖していましたが、2019-2020シーズン以前は、製造元に提供されたウイルスの一部は、もともと卵に由来していました。 2019-2020年のインフルエンザシーズンは、細胞ベースのワクチンで使用される四つのインフルエンザウイルスはすべて細胞由来であり、ワクチンは卵を含まな
詳細については、CDCの細胞ベースのインフルエンザワクチンwebページを参照してください。,
組換えインフルエンザワクチン
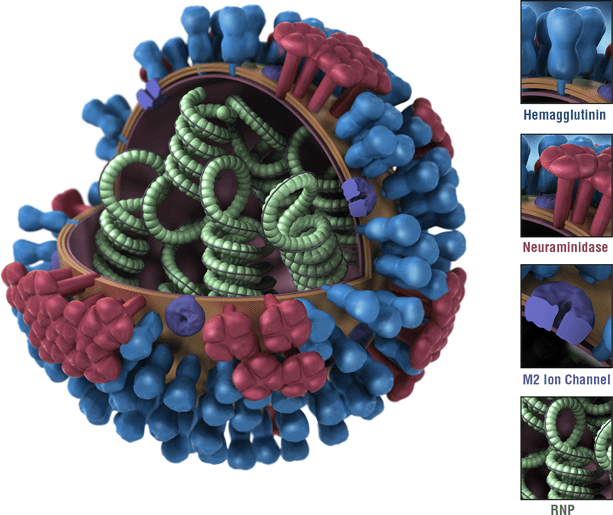
これはインフルエンザウイルスの写真です。 ウイルスのヘマグルチニン(HA)表面タンパク質は青色で描かれている。 インフルエンザウイルスのHAsは抗原です。 抗原は、免疫系によって認識され、防御免疫応答を引き起こすインフルエンザウイルスの特徴である。 最もインフルエンザワクチンの設計をトリガーに対する免疫反応のは、循環型インフルエンザワクチンの開発が始まりました。,
2013年に米国市場での使用が承認されたインフルエンザワクチンの第三の生産技術があり、組換え技術を使用することを含む外部アイコン。 組み換えインフルエンザワクチンを必要としないを持つ候補者にワクチンウイルス(CVV)サンプルで製造できます。 その代り、組換えのワクチンは総合的に作成される。 組換えワクチンを作るためには、インフルエンザの科学者は最初にDNA、すなわち、インフルエンザウイルスで見つけられるhemagglutinin(HA)と呼出される表面蛋白質を作, HAは抗原であり、これはヒト免疫系を引き起こしてウイルスを特異的に標的とする抗体を作り出すインフルエンザウイルスの特徴である。 インフルエンザウイルスHA抗原を作るためのこのDNAは、無脊椎動物に感染するウイルスであるバキュロウイルスと組み合わされます。 これは”組換え”ウイルスで起因します。 バキュロウイルスの役割は、インフルエンザウイルスHA抗原を宿主細胞に作るためのDNA指示を輸送するのを助けることである。 組換えウイルスが食品医薬品局(FDA)の修飾された宿主細胞ラインに入れば、セルに急速にHAの抗原を作り出すように指示します。, この抗原はバルク収集した、精製し、パッケージとして組み換えインフルエンザワクチン これらのワクチンはそれから公衆にワクチンのロットの解放を承認するFDA前にFDAによってテストされる質および効力です。
この製造方法は、卵成長ワクチンウイルスを必要とせず、製造プロセスにおいて鶏卵を全く使用しない。 同様の組換え製造プロセスを使用する米国市場には他のワクチンがありますが、現時点では米国での使用のためにFDAによって承認された組換え, この生産プロセスは、卵の成長や細胞ベースのワクチンウイルスの開発に適応したワクチンウイルスの選択によって制限されないため、最速です。
CDCおよびFDAは、季節性インフルエンザワクチンを含む、米国で認可されたすべてのワクチンの安全性を監視しています。 有害事象、禁忌および予防措置、スクリーニング、および安全なワクチン投与を含む、卵ベース、細胞ベースおよび組換えインフルエンザの安全性に関する詳細は、季節性インフルエンザワクチン安全性:臨床医のための要約で入手できます。,
- インフルエンザワクチンの進化と革命米国食品医薬品局のウェブサイトの外部アイコン。
- インフルエンザワクチン研究国立アレルギー感染症研究所、NIHのウェブサイト上の外部アイコン。
- インフルエンザワクチンの進歩















