静脈の不十分の処置及び管理
Venoablationは医学管理に不応な不快または潰瘍とのそれらのために予約されます。 外科およびendovenousアプローチの第一次目的は主要な還流の細道を取除くことによって静脈の不十分を訂正することです。,:
-
ストリッピングによる結紮
-
単純結紮および分割
-
硬化療法(結紮の有無にかかわらず)
-
刺し抜き(結紮の有無にかかわらず)
-
ラジオ波切除(rfa)
-
静脈切除のすべての方法が有効である(静脈瘤再発の有病率およびタイミングに関して医学および外科文献の間にいくつかの不一致があるが)。, 静脈の還流の全面的な容積があらゆるメカニズムによって重大な境界の下で減れば、静脈の潰瘍は直り、忍耐強い徴候は解決されます。 一般に、静脈結紮は、重度の症状を引き起こす伏在系における逆流を伴う慢性静脈不全(CVI)の症例のために予約されている。 したがって、逆流の診断は、通常、フォトプレチスモグラフィーまたは二重イメージングで術前に確立されなければならない。, 大伏在静脈(GSV)の症候性静脈瘤を有する患者では、深部閉塞を除外しなければならない;それは静脈結紮に対する絶対禁忌である。 表在静脈結紮前の深部静脈系の静脈造影が不可欠である。硬化療法は、硬化性物質を還流血管に注入または注入して、治療された血管の内皮破壊および線維化を生じさせることによって行われる。 静脈へのsclerosing代理店の直接注入は通常CVIよりもむしろtelangiectatic損害のために予約です。, PhlebotonicsはCVIのために有利であると証明されませんでした。
EVLTは、膝から鼠径部にレーザーファイバーを通過させ、静脈の全経過に沿ってレーザーエネルギーを送達することによって行われる。 血管壁の破壊に続いて、治療された血管の線維化が起こる。 使用されるレーザーの波長と変わる優秀な長期(>5年)結果および複雑化の低率をもたらすことを示しました。,
RFAは、膝から鼠径部に特別な無線周波数(RF)カテーテルを通過させ、熱傷が収縮を引き起こすまで、標的血管の制御された事前調整された加熱を行うことによって行われる。 このプロセスは、静脈の経過に沿って7cmごとに繰り返される。 最初の熱損傷に続いて、治療された血管の線維化が続く。 RFAは複雑化の低率と有効、であるために示されていました。 それは10年間までのフォローアップと確認された優秀な結果を作り出しました。,
血管下内視鏡穿孔手術(SEPS)もまた、CVIを治療するために用いられている。 内視鏡技術は、穿孔静脈を見つけて結紮するために使用される。 予備報告によると、敗血症の後、潰瘍の平均治癒時間は42日であり、再発率は3%であり、敗血症で治療された潰瘍は、従来治療された潰瘍よりも4倍速く治 さらに,SEPSの罹患率は従来の手術よりも有意に低かった。
全体として、患者の約8%がCVIに外科的介入を必要とする。, 異なるオプションは、異なる条件に適しています(下記参照)。 患者の心臓状態とバイタルサインを注意深く監視することは非常に重要です。 さらに、ヘモグロビンおよびヘマトクリットのレベルの周期的な監視は必要なintraoperativeデータ
静脈瘤出血
静脈瘤出血を有する患者は、通常、伝統的な管理が関与する血管を監督することである救急部(ED)に存在する。, 重大な失血があった患者は特に出血のvaricosityが大きければおよび上にあるティッシュが砕けやすければ病院に是認されるかもしれません。 血管をオーバーシューイングすると、ほとんどの場合、短期間のコントロールが得られますが、破裂した拡張した表面的な薄い壁の血管を切除することは何もしないため、出血の短期再発を引き起こす可能性もあります。
静脈瘤出血は、硫酸テトラデシルナトリウムによる一次硬化療法によって最もよく管理される。, Tretbarは3年の期間にわたる一次圧迫硬化療法によって首尾よく扱われた一連のケースを報告しました。
表在静脈不全
表在静脈治療のために、一次手術は、硬化療法は、より少ない合併症を生成し、早期およびフォローアップの両方で患者の満足度の高いレートを提供しているのに対し、早期再発の低いレートを提供しています。 外科的治療後の早期再発の可能性が低いほど、合併症のリスクが高くなります。,
saphenofemoral接合部の結紮による静脈ストリッピングは、表在静脈不全の場合に最も一般的に採用されている外科的アプローチであった。 現在、それはRFAおよびEVLTのようなendovenous切除の技術によってますます取り替えられています。
表在静脈障害に対する静脈結紮への元のアプローチは、GSVシステム全体の除去を含んでいた;このアプローチは、主に刺し抜き技術に取って代わられ 刺し傷の除去では、さまざまなレベルでGSVの上にいくつかの2-3mmの切開が行われます。, 静脈は下にある組織から解剖され、穿孔器は結紮される。 小さなフックまたは鈍い針は、できるだけ多くの静脈を抽出するために使用されます。典型的には、刺し抜きは、伏在神経またはひ腹神経への損傷を避けるために、GSV系における膝より上の領域に限定される。 この技術は伏在システムの還流が起こり、厳しい徴候を引き起こすCVIのために予約されます。 このため、手術前に逆流の診断を確立することが必須である。,
無能血管の単純結紮および分割は、この手順がGSVに適用されたときの逆流の早期再発の発生率が高いため、失敗した穿孔血管を治療する有効な方法ではない。
皮膚移植は、静脈不全が治療されていない限り非常に長い間生存せず、静脈不全が切除された後、通常、移植しなくても潰瘍は迅速に治癒する。,
深部静脈不全
深部静脈閉塞患者に対する手術の決定は、症状の重症度を慎重に評価し、腕と足の静脈圧を直接測定した後にのみ行われるべき 閉塞性疾患を有する多くの患者は広範な側副循環を有し、それらをより少なく症候性にするので、静脈造影だけでは十分ではない。 血餅溶解(例,組織プラスミノーゲン活性化剤またはウロキナーゼによる)および血栓切除が試みられているが,再発率が極めて高いために大部分が放棄されている。,
腸骨大腿疾患に対して、選択の手術は伏在静脈クロスオーバー移植片である。 この手順では、対側伏在静脈を動員し、その遠位端で分割し、次いで恥骨上にトンネルされ、罹患した側の大腿静脈に吻合される(下の画像を参照)。 結果は接木を通してそしてそのままな反対側の静脈システムへの静脈血の転換です。 比較的高い故障率(20%)のために、環状のポリテトラフルオロエチレン(PTFE)の接木は使用されます。 長期開存性は決定されていない。,
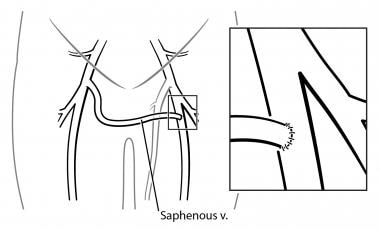 静脈不全腸骨大腿閉塞(パルマ手術)。 対側脚から伏在静脈は、患肢の大腿静脈に皮下トンネル化され、75%の累積開存性は5年である。 手続き和らげ静脈歇性跛行はありませんで癒して潰瘍または軽膨潤は小さい。
静脈不全腸骨大腿閉塞(パルマ手術)。 対側脚から伏在静脈は、患肢の大腿静脈に皮下トンネル化され、75%の累積開存性は5年である。 手続き和らげ静脈歇性跛行はありませんで癒して潰瘍または軽膨潤は小さい。 表在大腿静脈の閉塞のために、1954年にWarrenおよび1983年にHusniによって記述されたHusniバイパスが考慮され得る。 この手順では、同側GSVを採取し、その場膝窩-大腿静脈バイパスとして使用する。, その高い故障率(約40%)のために、Husniバイパスはまれに実行されます。 ステントを用いた低侵襲技術が記載されている。
弁形成術は、機能弁の先天性不在の患者のために予約されている。 静脈切開術を行い,弁尖を複雑にする。 適切な結果を確保するために、各カスプの20-25%を複製することをお勧めします。 弁の完全性を維持する作動の場所のまわりのPTFEの袖の付加は定期的である。, 穿孔静脈の結紮と組み合わせると、弁形成術は80年後の症例の5%において優れた結果をもたらす。
静脈セグメントの転位により、罹患した血管に近接している正常に機能する静脈が同定される。 その後、無能な静脈は解剖され、動員され、機能弁の遠位の正常な静脈に転置される。
静脈弁移植では、有能な腋窩または上腕静脈の弁containing有セグメントが動員され、膝窩または大腿系のいずれかに挿入される。, 脚静脈の無能なセグメントを切除し、移植セグメントに置き換えます。 同種移植片または死体静脈移植が評価されており、長期の結果は保留されています。,血管外漏出によるもの
-
不注意な動脈注射(四肢の喪失を引き起こす可能性がある)
RFAおよびEVLTの潜在的な合併症には、以下が含まれる。
-
皮膚の火傷
-
隣接する組織に対する熱傷
-
-
深部静脈に対する不注意な傷害
術後ケア
術後直後のヘパリン(または低分子量ヘパリン)による抗凝固およびワルファリンによる長期予防が推奨される。,
退院後の創傷感染のために頻繁に患者を観察し、術後1週間開始する。 縫合線かステープルは操作中の場所で皮の健康によって2-4週に普通、とどまります。
痛みや腫れの増加は、DVTを排除するための繰り返し二重超音波検査の適応である。
 静脈不全腸骨大腿閉塞(パルマ手術)。 対側脚から伏在静脈は、患肢の大腿静脈に皮下トンネル化され、75%の累積開存性は5年である。 手続き和らげ静脈歇性跛行はありませんで癒して潰瘍または軽膨潤は小さい。
静脈不全腸骨大腿閉塞(パルマ手術)。 対側脚から伏在静脈は、患肢の大腿静脈に皮下トンネル化され、75%の累積開存性は5年である。 手続き和らげ静脈歇性跛行はありませんで癒して潰瘍または軽膨潤は小さい。 














