植物科学におけるフロンティア
はじめに
最適な果実品質と長い貯蔵寿命の両方を達成するためには、果実熟成の正しい進行が不可欠であり、価格市場と最終的な利益を決定する重要な特性である。 しかし、熟成は、最終的な官能および栄養果実特性を与える生化学的および生理学的変化を調節するホルモン制御を含む多くの要因が関与する複雑なプロセスである。, 伝統的に、肉質の果実は、熟成プロセスに応じて更年期および非更年期の果実に分類されてきた。 トマトやバナナなどの更年期の果実は、自己触媒応答で熟成プロセスを解き放つために、呼吸速度およびエチレン生産の急増を必要とする(Barry and Giovannoni,2007;Liu et al., 2015)., きっ抗的には,柑橘類やブドウのような非更年期の果実は熟成開始前のエチレンや呼吸においてバーストを示さず,これらの果実では,成熟は主に植物ホルモンアブシジン酸の進行性の蓄積によって制御される(ABA;Rodrigo et al.,2006;Castellarin et al., 2011). それにもかかわらず、新しい研究は、熟成プロセスが一つの植物ホルモンの生産によって支配されるだけでなく、制御されたホルモンバランスの結果,2012;Teribia et al.,2016;Li et al., 2019).,
オーキシン、サリチル酸(SA)、およびメラトニンは、植物における多くの重要なプロセスのシグナル伝達および調節に関与する植物ホルモンである。 オーキシンは、植物において複数の機能を有する成長および発達の調節因子として広く記載されている(Taylor-Teeples et al.,2016);SAは、生物栄養性および半生物栄養性病原体に対する防御応答を引き起こす(Loake and Grant,2007)だけでなく、非生物的ストレス下で重要な役割を果たす(Dong et al.,2014;Wani et al.、2017)、開花および細胞周期制御(Carswell et al.,1989;Eberhard et al.,,1989,それぞれ);およびメラトニンは、オーキシン様機能を有することが見出されているだけでなく(Chen et al.,2009;Zuo et al.,2014;Wen et al.、2016)しかし、それはまた、いくつかの植物(Arnao and Hernández-Ruiz、2015)および病原体に対する植物応答の調節因子として作用することが示唆されている(Chen et al., 2018). 興味深いことに、これらの三つのホルモンは共通の前駆体–chorismate-を共有し、したがって、代謝クロストークは、それらの間で発生し、遺伝子の数は細かくこれらの, 過去数年の間に、いくつかのレビューは、オーキシンの生合成および役割に対処している(Paul et al.、2012)、SA(AsghariおよびAghdam、2010)およびメラトニン(Feng et al.,2014;Arnao and Hernández-Ruiz,2018)in fruits. しかしながら、それらの生合成および機能は、主に別々に記載されている。 ここでは,更年期および非更年期の果実の成長および熟成におけるオーキシン,SAおよびメラトニンの生合成,代謝および機能の共通および差異的側面について議論した。, コリスメイトからの生合成における代謝転換のキーポイント,更年期および非更年期の果実の熟成における調節的役割,果実品質を大きく決定する生理活性化合物の生合成の調節における役割に重点を置く。
コリスメイト由来の植物ホルモン
コリスメイトはシキメート経路の最終生成物であり、植物ホルモンの生合成に重要な役割を果たしている(図1)。, Chorismateは、トリプトファンを含む芳香族アミノ酸を生じさせ、トリプトファンアミノトランスフェラーゼ(TA)によるトリプトファンのインドール-3-ピルビン酸への変換を含むいくつかの反応を通じて、オーキシンインドール-3-酢酸(IAA)を生成することができる。 TAは、栄養臓器だけでなく、IAA生合成に対する普遍的な鍵酵素として提案されている(Enríquez-Valencia et al.、2018)だけでなく、生殖器官の発達においても(Reyes-Olalde et al.、2017)、果実の成長および熟成を含む(Estrada-Johnson et al., 2017)., 対照的に、イソコリスメイトシンターゼ(ICS)が活性化されると、コリスメイトはイソコリスメイトに変換され、後者はSAに変換されることができる。 この経路は細菌において最初に同定されたという事実にもかかわらず、現在、植物においても十分に確立されている(Wildermuth et al.,2001;Uppalapati et al.,2007;Catinot et al.,2008;Garcion et al.,2008;Abreu and Munné-Bosch,2009)。 最後に、トリプトファンは酵素トリプトファンデカルボキシラーゼ(TDC)によってトリプタミンに変わることができる。, これはIAA生合成の複数の経路の別のものであるが(トリプタミンはインドール-3-アセトアルデヒドに変わり、後にIAAに変わる)、TDCはまた、メラトニン経路における最初の律速酵素であることが提案されている(Kang et al., 2007). TDCは、アポシナ科ファミリーで最初に同定された(De Luca et al.,1989)いくつかの植物系において後述する(Byeon et al.,2012,2014;Zhao et al.,2013;Wei et al., 2018)., 脱炭酸後、トリプタミンはトリプタミン-5-ヒドロキシラーゼによってセロトニンに変換され、セロトニンはN-アセチル-セロトニンに変換され、最終的にサイトゾル中にメラトニンを生成する(図1)。
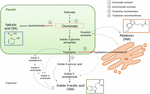
図1. Chorismateからのインドール-3-酢酸(IAA)、サリチル酸(SA)、およびメラトニン(Mel)の生合成。 すべての三つの化合物は、シキメート経路から共通の最終前駆体(chorismate、オレンジ色で二乗)を共有する。, 主要な転換点は赤い矢印で示され、対応する酵素はシキメートからの降下発散順に番号が付けられています。 太字の破線の矢印は、化合物間の複数のステップを示します。 細い破線の矢印は、まだ明確に定義されていない経路を示します。
肉質の果実では、コリスメイト経路ホルモンの合成につながる重要な転換酵素が最近同定されています(図1)。 ICSは、生物ストレス耐性にとって重要であることが示されている(Garcion et al.,,2008;Zeng and He,2010)は、トマトとリンゴで同定されている。 Zhu et al. (2016)は、トマトにおける低温貯蔵条件下でのICS1(isochorismate synthase1)の過剰発現を報告したが、Zhang et al. (2017)は、リンゴにおけるICS発現を誘導する病原体関連SAシグナル伝達経路に関与する転写因子の活性化を見出した。 Tdc1およびTDC2発現の増加を介して、病原体による感染により、未熟なコショウ果実においてTDC活性の増強が起こることが報告されている(Park et al.,2013)-そして桑の果実の成長段階で(Wang et al., 2016)., 最後に、TAは、pre-およびvéraisonの両方で、grapevineで同定されている(Böttcher et al.、2013;GouthuおよびDeluc、2015、それぞれ)ならびにイチゴ熟成中(Estrada-Johnson et al., 2017). しかしながら、更年期の果実(すなわちICS)に記載されている遺伝子および酵素は、非更年期の果実(すなわち、TDCおよびTA)およびその逆では同定されていないことは注目に値する。したがって、これらの知識のギャップを埋め、これらの転換点が果実熟成中にどのように共同で調節されるかをよりよく理解するためには、さらなる研究が不可欠である。,
更年期および非更年期の果実におけるChorismate由来の植物ホルモンの役割
果実発達のメカニズムを解明することは、その経済的意味のための最近の農学研究における主要な課題の一つとなっている。 この文脈では、植物ホルモンは、特に更年期および非更年期の果実におけるエチレンおよびABAの果実熟成の責任あるドライバーとして指摘されている。 但し、これらのphytohormonesが単独でフルーツの開発を調整できるこ, 広範な研究の後でそして分析化学および分子技術の改善を用いる、複数の他のホルモンはchorismate得られたphytohormonesを含むフルーツの開発そして熟すことの潜在的な調節因子として、確認されました。
オーキシンは、フルーツセット、成長および熟成中に他のホルモンとクロストーク
オーキシンは、自分の影響を発揮し、他の植物ホルモンの発現を調節する、フルーツの開発に不可欠な役割を果たしている植物ホルモンのグループである。, IAAの内因性contents量は、果実セットおよび初期成長発達段階において特に高く、その後、IAA量は更年期の両方において、熟成開始前に減少する傾向がある(Zahara et al.、2012)および非更年期果実(Symons et al.,2012;Teribia et al.,2016)、桃のような明らかにいくつかの例外を除いて(Tatsuki et al.、2013)およびいくつかの梅の品種(El-Sharkawy et al.,2014;図2A)。 IAAはジベレリンと組み合わせて果実セット開始に関与することが実証されている(Mezzetiti et al.,2004;Serrani et al.,2010;Bermejo et al.,2018;Hu et al.,, 2018). IAA生合成またはシグナル伝達の障害は、一般に、果実の単為結実をもたらすが、一部の果実では異常な熟成をもたらすこともある(Wang et al.,2005;Liu J.et al.,2018;Reig et al., 2018). 果実発育の初期段階におけるIAAの高い含量は、サイトカイニンと組み合わせた細胞分裂およびジベレリンと組み合わせた細胞拡張の制御におけるオーキシンの含意により、果実成長を促進する(Liao et al., 2018)., この期間中、オーキシンとジベレリンとの間のホルモンクロストークは、さらに、オーキシン応答因子によって媒介される微調整された調節における正常な果実形成を可能にする(ARFs;Liao et al.,2018;Liu S.et al., 2018).
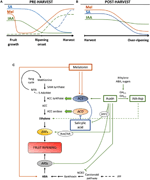
図2. 更年期および非更年期フルーツの開発の間のIAA、SAおよびMelの役割。 (A)収穫前および(B)収穫後の更年期果実および非更年期果実の熟成中のIAA、SA、およびMelの相互作用を要約するモデル。, 破線は、いくつかの果実における植物ホルモン含量の代替ダイナミクスを示す(議論のためのテキストを参照)。 (C)更年期および非更年期の果実におけるIAA,SAおよびMelとエチレンおよびアブシジン酸(ABA)生合成との相互作用の概要。 オーキシンはACC合成酵素遺伝子(ACS)の活性化およびエチレン応答因子(Erfs)の発現を誘導することによってエチレン生合成の正の調節因子である。 オーキシンはまた、9-cis-エポキシカロテノイドジオキシゲナーゼ(NCED)抑制とarf2タンパク質によってABA応答ストレス遺伝子(ARS)を阻害することによってABA産, 内因性IAAの内容は統合がエチレン、ABAおよび砂糖によって促進されるGH3蛋白質によって減らすことができます。 不連続線は,いくつかの果実におけるエチレンを増強する熟成因子としてのIAA-AspによるIAAの役割を示した。 ACSはメラトニンの内容によって禁じることができるがMelatoninはABAおよびエチレンの生産を高めます。 SAはACCオキシダーゼ(ACO)遺伝子を抑制するエチレンの阻害剤として作用するが,ACSの発現を促進することができる。, MTA,50-メチルチオアデノシン;S-AdoMet,S-アデノシル-メチオニン;SAMシンターゼ,S-アデノシル-メチオニンシンターゼ;ACC,1-アミノシクロプロパン-1-カルボン酸;IPP,イソペンテニル二リン酸。
内因性IAA含量の減少は、いくつかの果実において熟成の開始前に起こることが報告されている。 これらの還元は、IAA-アミド合成酵素、GH3-1およびGH3-2によるアスパラギン酸(IAA-Asp)とのiaa共役に関連している(図2C)。, 実際、GH3-1およびGH3-2は、トマトのような更年期の果実の両方において、早期果実発達中および最も特に熟成開始中により高い発現を示した(Sravankumar et al.,2018)およびリンゴ(Onik et al.、2018)、ならびにブドウ果実のような非更年期果実(Böttcher et al.,2010,2011)とラズベリー(Bernales et al., 2019)., 興味深いことに、ブドウの果実は、非更年期の果実であっても、熟成開始後のIAA含量の制御におけるエチレンの関与を説明することができるABAおよびethephonアプリケーション後に強化されたGH3-1発現を示した(Böttcher et al., 2010). 実際、いくつかの研究では、果実の熟成におけるオーキシンとエチレンの間の緊密な相互作用が強調されており、それらの間には相互の影響がある(Tadiello et al.,2016a;Busatto et al., 2017)., 更年期の果実では、ACCシンターゼをコードするACCシンターゼ遺伝子(ACS)の発現を活性化するためにIAAの含量を増加させる必要があり、これは熟成プロセスを引き起こすエチレン産生につながる(図2C;Tatsuki et al., 2013). トマトのような果物(Li et al.,2016)またはバナナ(Choudhury et al.,,2008)は、通常、熟成開始前にIAA含量が減少しているが、IAAまたは類似体が外生的に適用されると熟成遅延を示し、iaa含量が完全に熟すまで徐々に増加する桃のような果実は、オーキシンが適用されると加速された熟成を示す(Tadiello et al.、2016b)。 したがって、オーキシン-エチレン相互作用のタイトな複雑かつ差動調節は、収穫前の熟成中に様々な果実に存在しなければならない。, さらに、IAA含量は、9-cis-epoxycarotenoid dioxygenase(NCED)を脱抑制し、ABA合成を開始するために、いくつかの非更年期の果実では熟成開始前に減少します(図2C;Jia et al., 2016). 興味深いことに、このプロセスは、増強されたGH3-1活性を介したIAA結合によっても媒介される(Böttcher et al., 2010). それにもかかわらず、Estrada-Johnson et al. (2017)は、イチゴの熟成中にIAA含量が減少するが、FaAux/IAAおよびFaARF遺伝子ファミリーの発現が赤い容器で誘導されることを示し、完全熟成果実におけるオーキシンシグナル伝達の関与を示唆している。,
収穫後、オーキシン含量は通常、不変のままであるか、酸化プロセスのために減少する傾向があり、iaaの内因性contents有量の小さいが漸進的な減少を引き起こす可能性がある(図2B)。 収穫後のオーキシン処理は、いくつかの果実における過熟を遅らせる(Chen et al.,2016;Moro et al.、2017)およびいくつかの有機酸の含有量を増加させ、果実の酸性度を維持する(Li et al.,2017)、したがって、オーキシンは収穫後の果実の熟成の制御にも重要な役割を果たしていることを示唆している。,
果実発育および熟成中のサリチル酸の複数の役割
サリチル酸は、病原体の果実感染に由来する収穫前および収穫後の損失を制御するために、生物ストレス下でのその保護効果に主に関連している別のコリスメイト由来の植物ホルモンである(Babalar et al.,2007;Cao et al., 2013). 一般に、遊離SAの内因性contents量は、果実発育の開始時に高くなり、その後徐々に減少する(Oikawa et al., 2015). Lu et al. (2015)は、桃の果実の第二の成長段階におけるSAの二次的増加を報告した。, バナナにおけるSAの外因性適用は、呼吸バーストおよびパルプ対剥離比を減少させる熟成プロセスを遅らせるだけでなく、細胞壁分解およびantioxidant系(SrivastavaおよびDwivedi、2000)に関連する酵素の活性を低下させる。 さらに、サリチル酸およびアセチルサリチル酸(ASA)による甘い桜の処理は、商業段階でのチェリーの重量、硬さおよび色を増強した(Giménez et al., 2014). 収穫後のSAまたはサリチル酸メチル(Mesa)の外因性適用は、キウイのような果実における過剰熟成を遅らせる(Zhang et al.,、2003)、およびスイートチェリー(Valero et al., 2011). さらに、サリチル酸またはASAによる処置は、ザクロの冷え性損傷を軽減した(Sayyari et al.,2011),トマト(Aghdam et al.、2014)、およびアボカド(Glowacz et al., 2017). SAはまた、ACCオキシダーゼ(ACO)発現の阻害を介してエチレンと相互作用する(ShiおよびZhang、2012)。 驚くべきことに、ナシにおけるACS発現の増加した含量もまた、用量調節様式でSA適用後に見出される(Shi et al.,2013;市と張,2014). したがって、SAに依存するエチレン生産の規制は細かく規制されています(図2C)。,
Melatonin:フルーツの開発の制御のための出現の調整装置
Melatoninはまた近年多くの注目を集めているchorismate得られた細道からの植物ホルモンです(Hernández-Ruiz et al.,2005;Arnao and Hernández-Ruiz,2018;Sharif et al., 2018). 最近、メラトニンは、IAA効果と同様に、フルーツセットの重要な因子として指摘されている(図2A;Liu S.et al., 2018). さらに、この植物ホルモンの概日産生が観察されている(Kolaz et al., 1997)., 樹上熟成の間、メラトニンで処理されたブドウは、完全に熟すとより高い同期性および重量の増加を示した(Meng et al., 2015). さらに、別の最近の研究Xu et al. (2018)は、メラトニンがABAおよびエチレン、ならびに過酸化水素との相互作用によってブドウ果実の熟成を促進することができると述べた。 メラトニンは果実冷蔵中に冷え耐性を与えることが実証されており、これは主にそのantioxidant活性に関連していると思われる(Cao et al.,2018;Aghdam et al., 2019)., 収穫後、トマトは50μmでメラトニンを適用した後、エチレン放出の増加を示した(Sun et al.、2015)、100μmでのメラトニンの外因性適用がエチレン産生を阻害した梨とは対照的である(Zhai et al.,2018)、または50-200μmのメラトニンがACSおよびACOの発現を阻害したバナナ果実(図2C;Hu et al., 2017). Melatoninの適用の異なった効果が適量の効果と関連しているかもしれないがフルーツの開発の制御に於いてのmelatoninの役割をよりよく理解するためにそれ以上,
果実の発達の制御におけるChorismate由来の植物ホルモンのクロストーク
chorismate由来の植物ホルモン間のホルモンのクロストークは、果実の発達と熟成中に起こることが示されている。 Breitel et al. (2016)は、オーキシンがARF2を介してSAと相互作用することを見出し(図2C)、トマトにおけるARF2の過剰発現は、SAの含有量が低く、著しい熟成遅延をもたらしたことを見出した。, これは、オーキシンが果実の成長(オーキシンによって媒介される)と生物防御の活性化(SAによって媒介される)との間のトレードオフを説明するかもしれな さらに、パパイヤ果実へのSAの外因性適用は、いくつかのIAA遺伝子の発現を変化させ、そのうちのいくつかはダウンレギュレートされ、他のものはアップレギュレートされる(Liu et al., 2017)., この場合,果実の熟成中にオーキシンとSAの間の推定上のクロストークにおいて実際に内生的に起こることは決定的ではなく,この果実および他の更年期果実においてさらなる研究が必要である。 いずれの場合においても、IAAとSAは代謝的にだけでなく機能的にも密接に関連していることは明らかである。 最後に、いくつかの研究では、iaaおよびSA生合成および/またはシグナル伝達に対するメラトニンの影響が報告されている(ArnaoおよびHernández-Ruiz、2018でレビュー)が、我々の知る限り、これらの研究のいずれも更年期でも非更年期の果実でも行われなかった。,
Chorismate由来の植物ホルモンによる生理活性化合物の生合成の調節
生理活性化合物(フェノール化合物、イソプレノイド、酸化防止剤ビタミンを含む)は、食品の特定の感覚刺激特性の原因として広く研究されているだけでなく、神経変性および心血管疾患および特定のタイプの癌の発症における酸化プロセスに対するヒト細胞におけるそれらの保護効果についても研究されている(Liu et al.,1999;Mueller et al.,2010;Sturgeon and Ronnenberg,2010;Björkman et al., 2011)., フェノール化合物は、特定の果実の苦味または収斂味を担うタンニンなどの特定の風味を付与するのに大きく寄与し、アントシアニン色素などの色は、赤、青および紫の果実色を担う(Croteau et al., 2000). ヒトの消費に対するフェノール化合物の関連性は、心血管系および中枢神経系の健康に関連する酸化プロセスに対する防御効果、ならびに胃腸管の癌, 2011)., カロテノイド、イソプレノイドに属するテトラテルペンは、光酸化プロセスに対する保護および有機色素としての役割を果たす;それらは果実のオレンジ-黄色の色を担う(Tapiero et al., 2004). 食物カロテノイドは、抗酸化物質としての役割のために、眼疾患および特定の種類の癌のリスクを減少させる上で健康上の利点をもたらすと考えられている(Johnson、2002)。 アスコルビン酸およびトコフェロールを含むビタミンCおよびEは、それぞれ、ヒトにおける多くの生物学的活性を有する果物において必須の栄養品質要因である(MiretおよびMüller、2017)。, 果物における健康促進化合物としてのこれらすべての生理活性化合物の関連する役割を考慮すると、それらの蓄積の調節は更年期および非更年期 これらの生物活性化合物のほとんどは、果実の熟成中に高レベルで蓄積され、その際には、味の良くない緑色の果実が栄養豊富で、着色され、おいしい実,1996;Ranalli et al.,1998;Dumas et al.,2003;Singh et al., 2011)., しかしながら、一旦開始されると、熟成は停止することができず、一般に、果実の品質に悪影響を及ぼす過剰熟成につながる(Kumar et al., 2014). したがって、生理活性化合物の高い含有量を得ながら、収穫後の果実の腐敗を最小限に抑えることは、解決するための最大の課題の一つです。
オーキシンは更年期のトマト果実の熟成中のカロテノイド生合成の重要な調節因子として同定されている。 トマトにおける熟成は、クロロフィルの分解およびキサントフィルのカロテン(β-カロテンおよびリコピン)へのシフトと関連している(Fraser et al., 1994)., IAAは、エチレンおよびPsy、Ziso、Pds、CritisoならびにChlase1-3を含むいくつかの上流のカロテノイド転写産物を抑制することによってトマトの熟成を遅らせ、一方、β-Lyc1およびCrtr-β1転写産物の蓄積を促進し、キサントフィルおよびクロロフィルaの含有量が高くなるようである(Su et al., 2015). さらに、チェリーおよびブドウの果実のようなある非climactericフルーツでオーキシンはまたアントシアニンの生合成を調整し、それによりフルーツの熟すプロセスを制御するようです。 Teribia et al., (2016)は、IAAとアントシアニン含量との間に負の相関が報告されており、IAA含量が減少するとアントシアニン蓄積が始まることを示している。 さらに、合成オーキシン様化合物ベンゾチアゾール-2-オキシ酢酸(BTOA)の適用は、ブドウ果実におけるカルコン合成酵素およびUDP-グルコース:フラボノイド3-O-グルコシルトランスフェラーゼのようなアントシアニン生合成の酵素を促進する遺伝子のアップレギュレーションを遅らせた(Davies et al., 1997).,
SAおよびその誘導体ASAおよびMeSAを含むサリチル酸塩による収穫前および収穫後の処理は、更年期および非更年期の果実の両方において改善されたantioxidant活性をもたらす生理活性化合物の蓄積を調節することが報告されている。 プラム、チェリーおよび杏子のような複数のフルーツは収穫の後で質の急速な低下の短い生命を過すために知られています。 したがって、果物の品質、特に有益な健康効果を有する生理活性化合物の含有量を改善および維持する治療法の絶え間ない探索がある。, SA、ASA、およびメサによるプラムの処理は、収穫時および長期の低温貯蔵後の両方でアスコルビン酸、アントシアニンおよびフェノール化合物の有意な高い含有量をもたらした(40日4℃;Martínez-Esplá et al。, 2017). スイートチェリーにおけるSA、ASA、およびMesaによる収穫前処理についても同様の結果が観察された(Giménez et al., 2014, 2015, 2017). さらに、SA、ASA、またはMesaによる収穫後処理は、ザクロ中の低温貯蔵中に、全フェノール含量およびアントシアニン含量を維持した(Sayyari et al.,2011),sweet cherry(Valero et al.,,2011),cornelian cherry(Dokhanieh et al.,2013)、およびapricot(Wang et al., 2015). これらの結果は,サリチル酸塩がフェノール化合物の生合成経路に関与する主要な酵素であるフェニルアラニンアンモニアリアーゼの活性化に関与していることを示唆している(Martínez-Espla et al., 2017).
最近、メラトニンは果実の熟成を調節し、生理活性化合物を調節することが示されている。 モモ果実におけるメラトニンによる収穫後処理は,antioxidant系を活性化することによって冷え耐性を増加させた。, 寒冷傷害は、肉の褐変、異常な熟成および腐敗に対するより高い感受性を特徴とする低温貯蔵(2-7.6℃)の間に桃の果実において起こる(Lurie and Crisosto、2005)。 Cao et al. (2018)は、メラトニンで処理した桃は、貯蔵の21日目と28日目にアスコルビン酸生合成遺伝子PpGME、PpGPP、およびPpGLDHの転写産物が対照と比較して高いことを報告し、アスコルビン酸contents有量を増加させた。, さらに、メラトニンは、フェノール化合物の生合成に不可欠な酵素であるG6PDH、SKDHおよびPALの活性の増加を誘導した。 著者らは、メラトニン処理は、フェノール化合物の生合成を特異的に活性化することによって、モモ果実をある程度冷え損傷から保護することを示唆している(Gao et al., 2018). さらに、ラベルフリー差分プロテオミクス分析は、トマト果実の収穫後に果実熟成とアントシアニン蓄積を促進するメラトニンの効果を明らかにした(Sun et al., 2016)., 著者らは、外因性メラトニンは、とりわけフラボノール-3-ヒドロキシラーゼ、フラバノン3β-ヒドロキシラーゼ、アントシアニジンシンターゼ/ロイコアントシアニジンジオキシゲナーゼ、アントシアニジン3-O-グルコシルトランスフェラーゼを含むアントシアニン経路に関連する八つの酵素を増加させることを報告した。 さらに、メラトニンによる収穫後処理は、イチゴ果実の総フェノールおよびアントシアニンを増加させ(AghdamおよびFard、2016)、およびライチ果実の総フェノール、フラボノイドおよびアントシアニンの損失を遅らせた(Zhang et al., 2018)., メラトニンによる処理は、ブドウ果実中のフェノール類、アントシアニンおよびフラボノイドの含量を増加させた(Xu et al., 2017). さらに、メラトニンは、トマトにおけるリコピンの蓄積およびエチレン生産を促進することが報告されており、メラトニンがエチレン生合成およびシ, 2015)., 生理活性化合物のメラトニン誘発調節におけるエチレンの関与もブドウ果実で観察されており、エチレンの二重ブロック処理は、ポリフェノール含量に対するメラトニンの減少した効果を示した(Xu et al., 2017).
結論
オーキシン、SAおよびメラトニンを含むchorismate由来の植物ホルモンは、共通の前駆体を共有するだけでなく、果実の成長および熟成の調節において重要な役割を果たすと結論付けられている。, それらの間および他の植物ホルモンとの代謝および機能的なクロストークは、更年期および非更年期の果実の発達を細かく調節するために時空間的 更年期および非更年期の果実内のダイナミクスの違いは、chorismate由来ホルモンの応答が普遍的ではなく、むしろ強く種特.であることを証明する。 さらに、chorismate由来の植物ホルモンも生理活性化合物の蓄積を調節し、果実の品質に影響を与えます。, しかしながら、(i)エチレンやABAなどの他のホルモンがどのようにしてそれらの生合成を調節しているかをよりよく理解するためには、(ii)それらが機能的および分子レベルで相互作用し、(iii)それらが共同で生理活性化合物の生合成を調節し、その結果、果実の成長および熟成だけでなく、更年期および非更年期の果実の品質にも影響を及ぼすかをよりよく理解するためには、さらなる研究が必要である。
著者の貢献
SM-BはMP-Lの助けを借りてレビューを考案し、設計しました。MP-L、PM、MM、およびSM-Bは原稿を書きました。, MP-LはPMの助けを借りて数字を準備しました。 すべての著者は、アイデアの議論に貢献し、最終的な原稿を改訂し、承認しました。
資金調達
この作品は、カタロニア政府によってSM-Bに与えられたICREA Academia awardによって資金提供されました。
利益相反声明
著者らは、この研究が潜在的な利益相反と解釈され得る商業的または財務的関係がない場合に行われたと宣言している。
Böttcher,C.,Boss,P.K.,And Davies,C.(2011)., IAA-アミド合成酵素のアシル基質選好は,植物発育におけるオーキシン共役の重要性を示す異なるオーキシン化合物によって引き起こされるブドウ(Vitisviniferal.)ベリー熟成の変化を説明した。 ジェイエクスプレス ボット 62, 4267–4280. doi:10.1093/jxb/err134
PubMed Abstract|CrossRef Full Text|Google Scholar
Glowacz,M.,Bill,M.,Tinyane,P.P.,and Sivakumar,D.(2017)., 天然の揮発性化合物–ジャスモン酸メチルおよびサリチル酸メチルを使用して脂肪酸の含有量および組成を変更することにより、冷間貯蔵された”ハス”アボカドの収穫後の品質を維持する。 ジェイ-サイエンス 食べ物!. アグリック 97, 5186–5193. doi:10.1002/jsfa.8400
PubMed Abstract|CrossRef Full Text|Google Scholar
Zeng,W.,and He,S.Y.(2010). フラジェリン受容体フラジェリンセンシング2シロイヌナズナにおけるシュードモナスsyringae pvトマトDC3000への気孔応答を仲介する上での顕著な役割。 プラントフィジオール 153, 1188–1198. 土井:10.1104/p110.,157016
PubMed Abstract | CrossRef Full Text | Google Scholar















