17.3:산 기초 지표
학습 목표
- 기능을 설명할 수 있고 색깔 변화의 산-염기 지표
- 는 방법을 보여줍 선택하려면 적절한 표시를 위해 적정 실험
- 결정하는 산성 분리 상수 Ka 또는 카이로의 지표입니다.
특정 유기 물질은 하이드로 늄 이온 농도가 특정 값에 도달하면 희석 용액에서 색이 변합니다., 예를 들어,페놀프탈레인은 무색 물질에서 모든 수용액으로 hydronium 이온 농도보다 5.0×10-9M(pH<8.3). 에 더 많은 기본적인 솔루션 hydronium 이온농도가 보다 적은 5.0×10-9M(pH>8.3),빨간색 또는 분홍색이다. 용액의 pH 를 결정하는 데 사용할 수있는 페놀프탈레인과 같은 물질을 산-염기 지표라고합니다. 산-염기 지표는 약한 유기산 또는 약한 유기 염기 중 하나입니다.,
균형 솔루션에서의 산-염기표 메틸렌지,약산,로 표시될 수 있는 방정식에서는 우리가 사용하는힌 간단하게 표현한 복잡한 메틸렌지 분자:
\
\}{}}=4.0×10^{-4}\]
의 음이온 메틸렌,에서,노란색, 과 nonionized 형태로,힌,이 빨간색입니다. 때 우리는 추가산 솔루션의 메틸렌지,증가 hydronium 이온의 농도 변화에 평형으로 nonionized 빨간색 양식에 따라,르 Chatelier 의 원리입니다. 우리가 기초를 더하면,우리는 평형을 노란색 형태쪽으로 이동시킵니다., 이 동작은 버퍼의 동작과 완전히 유사합니다.
지표의 색은−와 HIn 의 두 종의 농도의 비율의 가시적 인 결과입니다. 대부분의 지표(일반적으로 약 60-90%이상)가 In−로 존재한다면,우리는 메틸 오렌지의 경우 황색 일 인 이온의 색을 봅니다. 대부분이 HIn 으로 존재한다면,우리는 hin 분자의 색을 봅니다:메틸 오렌지의 경우 빨간색., 에 대한 메틸렌지,우리는 우리를 다시 배치할 수 있습 방정식에 대한 Ka,write:
\}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}\]
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=로그\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:나\:pH=p\mathit{K}_a+log\left(\dfrac{}{}\right)}\]
마지막식과 같은 헨더슨-Hasselbalch 방정식을 설명하는데 사용될 수 있 평형의 지표입니다.,
경우에는 동일한 수치로 카,의 비율은 1,는 것을 의미의 50%지시자 존재에 빨간 형식(힌)고 50%에서 노란색이온성 양식(−)및 솔루션이 나타납 오렌지 색상입니다. 하이드로 늄 이온 농도가 8×10-4M(3.1 의 pH)로 증가하면 용액이 적색으로 변합니다. 하이드로 늄 이온 농도의 추가 증가(pH 의 감소)에 대해서는 색상의 변화가 보이지 않습니다. 4×10-5M 의 하이드로 늄 이온 농도에서(4 의 pH.,4),지표의 대부분은 황색 이온 형태이며,하이드로 늄 이온 농도의 추가 감소(pH 의 증가)는 가시적 인 색 변화를 일으키지 않는다. 3.1(적색)과 4.4(황색)사이의 pH 범위는 메틸 오렌지의 색-변화 간격이다;뚜렷한 색 변화는 이들 pH 값 사이에서 일어난다.
모니터링 할 특정 반응에 따라 많은 다른 물질이 지표로 사용될 수 있습니다., 예를 들어,붉은 양배추,주스 혼합물을 포함 컬러 물질에서 변경 깊은 빨간에 낮은 pH 를 밝은 파란색이에서 중간 pH 에 노란색 고 pH(그림\(\PageIndex{1}\)). 모든 경우에,하지만,좋은 지표는 다음과 같은 속성이 있어야합니다:
- 색상을 변경해야 합 쉽게 검출할 수 있습니다.
- 색상 변경이 신속해야합니다.
- 지표 분자는 적정되는 물질과 반응해서는 안됩니다.
- 오류를 최소화하기 위해 표시기는 적정의 등가 지점에서 예상되는 pH 의 한 pH 단위 내에있는 pKin 을 가져야합니다.,

붉은 양배추 주스 혼합물을 포함한 물질의 색상에 따라 달라집 pH. 각 시험관을 포함 솔루션 붉은 양배추의 주스에서는 물이지만,pH 의 솔루션에는 다양 pH=2.0(맨 왼쪽)pH=11.0(오른쪽). PH=7.0 에서 용액은 파란색입니다.,
이러한 기준을 충족시키고 사실상 전체 pH 범위를 포괄하는 합성 지표가 개발되었습니다. 그림\(\PageIndex{2}\)는 일부 일반적인 지표가 색상을 변경하는 대략적인 pH 범위와 색상 변화를 보여줍니다. 또한,일부 지표(예:티몰 블루)는 널리 분리 된 pH 값에서 색상을 두 번 변경하는 폴리 프로 틱 산 또는 염기입니다.
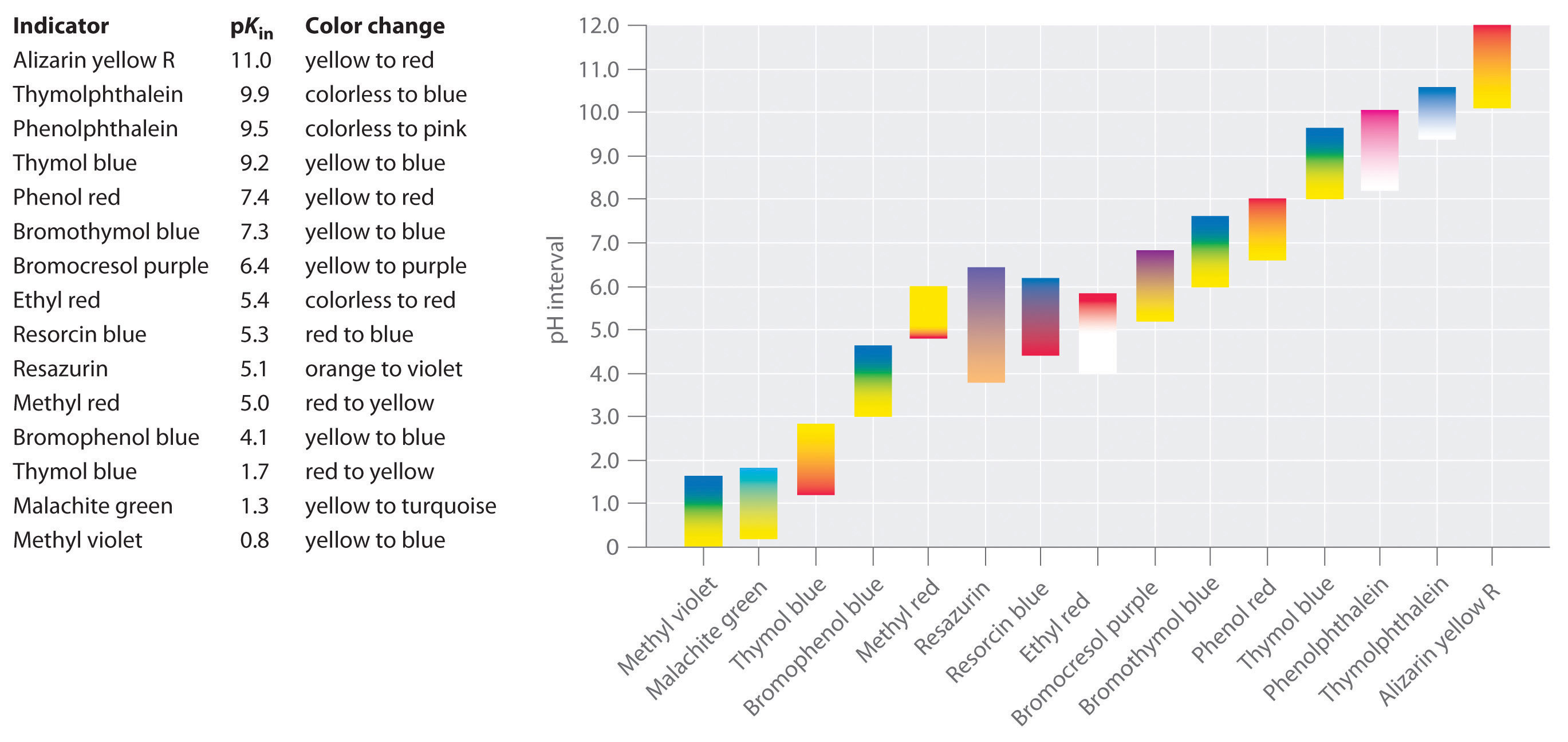
는 것이 중요하다는 것을 알고 있는 지표 색상을 변경하지 않는 갑자기에서 특정 pH 값을 대신,그것이 실제로 겪은 pH 의 적정처럼 다른 어떤 산십시오. HIn 의 농도가 감소하고 in−의 농도가 증가함에 따라 용액의 색은 hin 의 특징적인 색에서 In−의 색으로 천천히 변합니다. 섹션 16 에서 볼 수 있듯이/비율은 0 에서 변경됩니다.,1pkin 아래의 pH 한 단위에서 pkin 위의 ph 한 단위에서 10. 따라서 대부분의 지표는 약 2 개의 pH 단위의 pH 범위에 걸쳐 색을 변화시킨다.
우리는 좋은 지표가 등가 점에서 예상되는 pH 에 가까운 pKin 값을 가져야한다고 명시했다. 에 대한 강한 산 강력한 기반을 적정법의 선택에 표시되지 않은 특히 중요 때문에 매우 큰 변화 pH 발생하는 주위 동일 지점입니다., 에 대비를 사용하여 잘못된 표시에 대한 적정법의 약한 산성 또는 약한 자료에서 발생할 수 있습이 상대적으로 큰 오류로서,그림\(\PageIndex{3}\). 이 그림의 플롯을 표시한다 pH 대량의 베이스 위해 추가의 적정 50.0mL 의 0.100M 솔루션의 강산(HCl)및 약 산(아세트산)와 0.100M\(NaOH\). PH 범위는 두 개의 일반적인 지표(메틸 레드,\(서 확{에}=5.0\),그리고 페놀프탈레인,\(서 확{에}=9.5\))색상을 변경도 표시됩니다., 수평 막대는 두 지표가 거의 수직 인 hcl 적정 곡선을 가로 지르는 색상을 변경하는 pH 범위를 나타냅니다. 따라서 본질적으로 동일한 부피의\(NaOH\)가 추가되었을 때(약 50mL)두 지표 모두 색상이 바뀌며 이는 등가 점에 해당합니다. 반면에,적정 아세트산의 줄 것이 매우 다른 결과에 따라 여부 메틸 빨간 또는 페놀프탈레인 것으로 사용되는 지표이다., 지만 pH 범위는 페놀프탈레인 변화 컬러보다 약간 크 pH 에서 동등한 시점의 강산 적정에 오류가 될 것입니다 무시할 때의 기울기에 이 부분을 적정 곡선입니다. Hcl 적정과 마찬가지로 페놀프탈레인 지시약은 약 50ml 의\(NaOH\)가 아세트산 용액에 첨가되었을 때 분홍색으로 변할 것입니다. 반면에,메틸에 빨간은 변화하기 시작해서 주변에 pH5,근처에있는 중 아세트산 적정지 않는 동등한 지점입니다., 약 25-30mL 의\(NaOH\)만 첨가하면 메틸 적색 표시기가 색이 바뀌어 큰 오류가 발생합니다.
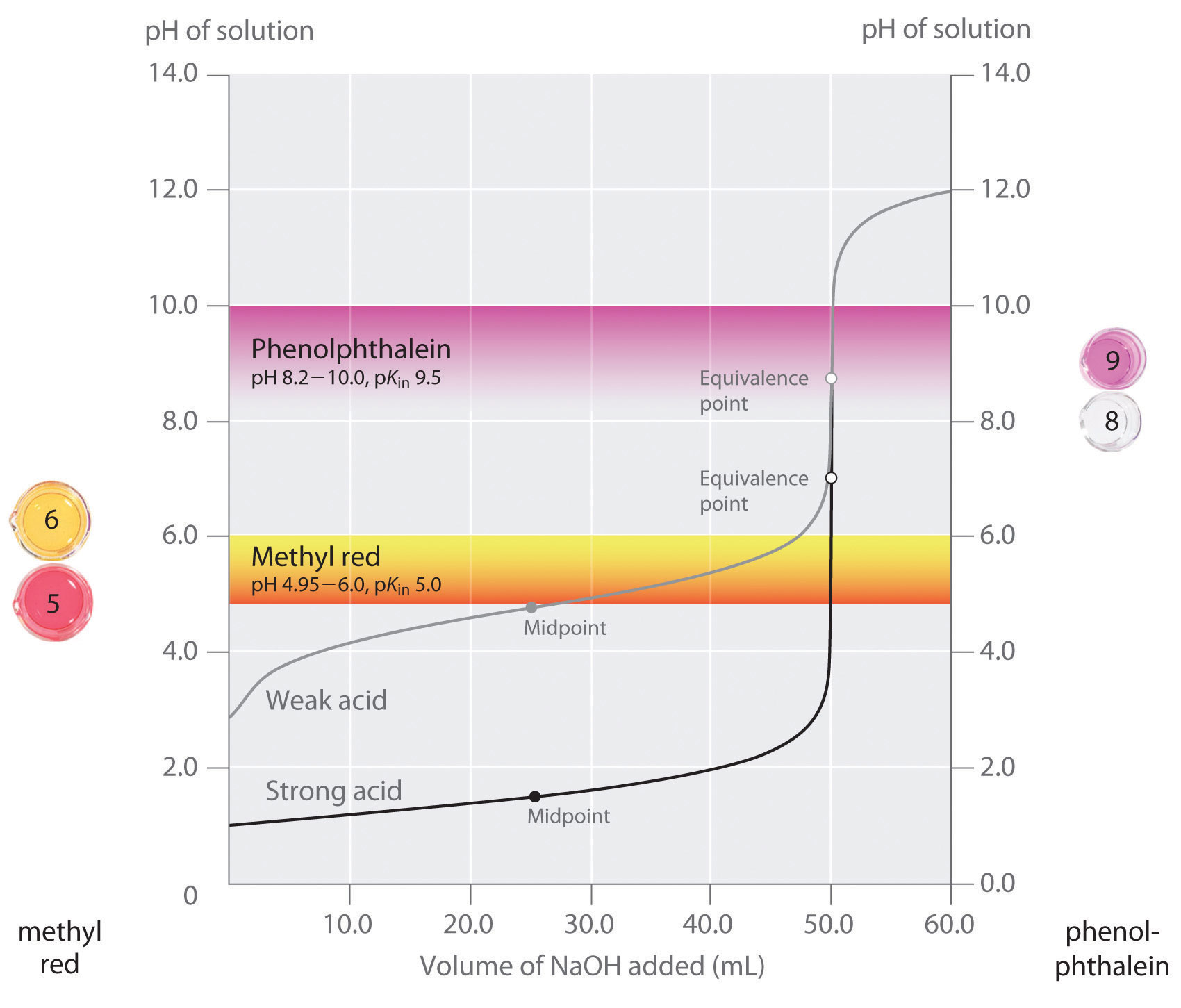
그래프 표시합을 사용하여 얻은 결과를 두 개의 지표(메틸 빨간색이고 페놀프탈레인)에 대한 적정의 0.100M 솔루션의 강산(HCl) 약 산(아세트산)와 0.100M\(NaOH\)., 때문에 경사도의 적정곡선의 강력한 산의 주위에 동등한 시점,하나에 표시할 것이 빠르게 색상을 변경에 동등한 지점을 위한 적정의 강산입니다. 반면에,pKin 에 대한 메틸 레드(5.0)은 아주 가까이 pKa 아세트산(4.76);중간점의 색깔 변화에 대한 메틸 레드 근처에서 발생 중 적정 보다는 오히려서 동등한 지점입니다.
일반적으로,강염기(또는 그 반대)를 갖는 강산의 적정의 경우,약 4.0 과 10.0 사이의 pK 를 갖는 임의의 지표가 할 것이다., 에 대한 적정법의 약한 산,그러나,pH 에서 동등한 지점은 7.0 이상,그래서 지시자와 같은 페놀프탈레인 또는 티몰 블루,pKin>7.0,사용되어야 합니다. 반대로,에 대한 적정법의 약한 자료는 pH 에서 동등한 시점보다 적은 7.0 으로 표시 메틸 빨간 또는 bromocresol 블루,pKin<7.0,사용되어야 합니다.
예\(\PageIndex{1}\)
에서 적정법의 약한 산과 강력한 기반 지표는 것이 최고의 선택입니까?,
- 메틸렌지
- Bromocresol 그린
- Phenolphtalein
솔루션
정답은 C. 에서 적정법의 약한 산과 강력한 기반,결합되는 베이스의 약한 자산 pH 에서 동등한 시점보다 큰 7. 따라서 해당 pH 범위에서 지표가 변경되기를 원할 것입니다. 메틸 오렌지와 브로 모 크레졸 녹색은 모두 산성 pH 범위에서 색을 변화시키는 반면 페놀프탈레인은 염기성 pH 에서 변화합니다.,
의 존재는 많은 서로 다른 지시자와 함께 다양한 색상과 pKin 값 또한 편리한 방법을 제공합 추정 pH 의 솔루션을 사용하지 않고 비싼 전자 pH 측정기고 깨지기 쉬운 pH 전극. 종이 또는 플라스틱 스트립태의 조합으로 지표로 사용된”산도 종이는”할 수 있도록 개발되고 있습니다 pH 솔루션의 단순히 찍기의 조각을 pH 으로 종이 그리고 비교 결과 색상으로 기준에 인쇄된 컨테이너(그림\(\PageIndex{4}\)).,
요약
산–염기 지표물 변화하는 색상에서 특정 pH., 이들은 전형적으로 색의 변화가 지표 자체의 탈 단백질 화 또는 양성자 화에 해당하는 약산 또는 염기이다.
참가자와 속성
-
폴 꽃(대학교 노스 캐롤라이나-펨브로크),클라우스 Theopold(델라웨어 대학의)및 리처드 랭리(스티븐 F. 오스틴 주립대학교)으로 공헌하고자 한다. OpenStax College 에서 제작 한 교과서 콘텐츠는 Creative Commons Attribution License4.0 라이센스에 따라 라이센스가 부여됩니다. http://cnx.org/contents/85abf193-2bd…[email protected])에서 무료로 다운로드하십시오.
- {템플릿.,나는 이것을 할 수 없다.















