에 대한 화학 Non-전공
학습 목표
- 설명하는 분자 그의 형태에 의해 영향을 받 VSEPR 이론이다.<리>론 쌍을 정의합니다.
- 고독한 쌍 전자가 분자 기하학에 어떻게 영향을 미치는지 설명하십시오.
전기 스코프는 어떻게 작동합니까?
전기 스코프는 전하를 연구하는 데 사용되는 장치입니다. 할 때는 긍정적으로 부과 개체(rod)접근 상 게시,전자 흐름을 최고의 항아리를 떠나서 두 개의 금 잎 postivley 청구합니다., 잎은 둘 다 혐의와 같은 postive 를 보유하기 때문에 서로 격퇴합니다. 이 VSEPR 이론을 말하는 전자쌍한 설정의 요금과 같은 것,서로를 격퇴하는 등 모양의 분자 조정됩니다 그래서는 원자가 전자 쌍 숙박로부터 멀리 떨어져서 서로 가능합니다.

중앙 원자 없이 고독한 쌍
하기 위해 쉽게 이해의 유형이 가능한 분자,우리가 사용하는 간단한 시스템의 일부를 파악할 수 있도록 어떤 분자입니다.,
A=중앙 원자 분자
B=원자 주변 중앙 원자
아랫 첨자 후 B 나타내는 것이다 수 B 있는 원자 접착 중앙 atom. 예를 들어,AB4 는 4 개의 공유 결합 된 원자로 둘러싸인 중심 원자를 가진 분자이다. 다시 말하지만,그 채권이 단일,이중 또는 삼중 채권인지는 중요하지 않습니다.
AB2:베릴륨 수소화물(BeH2)
베릴륨 수소화물의 구성 중앙 베릴륨 원자와 두 단일 결합을 수소 원자를 함유하고 있습니다. 옥텟 규칙을 위반한다는 것을 상기하십시오.,
H-될-H
요구 사항에 따라하는 전자쌍을 극대화의 거리에서 다른 하나는,두 개의 접합 쌍 BeH2 분자의 배열 자체에 직접 반대쪽의 중앙이 될 원자입니다. 결과 기하학은”볼 및 스틱”모델의 그림 1 에 표시된 선형 분자입니다.

그림 1. 베릴륨 수 소화물 모델.
h-Be-H 로부터의 결합 각은 선형 형상 때문에 180°이다.,
이산화탄소는 AB2 범주에 속하는 분자의 또 다른 예입니다. 그 루이스 구조는 중심 탄소와 산소 원자 사이의 이중 결합으로 구성됩니다(그림 2 참조).

그림 2. 이산화탄소 결합.
반발 두 그룹 사이에는 네 개의 전자가(두 쌍)보다 더 다른 반발의 두 그룹이의 두 개의 전자(one pair)에 BeH2 분자입니다. 이산화탄소도 선형입니다(그림 3 참조).,

그림 3. 이산화탄소.
AB3:붕소 플루오르화(BF3)
플루오르화 붕소로 구성되어 있 중앙 붕소 원자는 세 가지 단일채를 불소 원자(그림 4 참조). 붕소 원자는 또한 불완전한 옥텟을 갖는다.
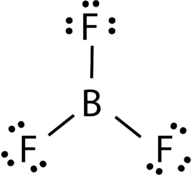
그림 4. 붕소 트리 플루오 라이드 결합.
BF3 분자의 기하학을 삼각 평면이라고합니다(그림 5 참조). 불소 원자는 정삼각형의 꼭지점에 위치합니다., F-B-F 각도는 120°이며 4 개의 원자는 모두 같은 평면에 놓여 있습니다.

그림 5. 붕소 트리 플루오 라이드 모델.
AB4:메탄(CH4)
메탄은 천연 가스의 주성분 인 유기 화합물입니다. 그 구조는 수소 원자에 4 개의 단일 결합을 갖는 중심 탄소 원자로 구성된다(그림 6 참조). 서로 거리를 최대화하기 위해,결합 전자의 4 개 그룹은 동일한 평면에 놓이지 않는다., 대신,수소 원자 각각은 사면체라고 불리는 기하학적 모양의 모서리에 놓여 있습니다. 탄소 원자는 사면체의 중심에 있습니다. 사면체의 각면은 정삼각형입니다.

그림 6. 메탄의 사면체 구조.
메탄 분자의 분자 기하학은 사면체입니다(그림 7 참조). H-C-H 결합 각은 109.5°로 분자가 평면이면 90°보다 큽니다., 메탄과 같은 분자에 대한 구조식을 그릴 때,그 형상의 3 차원 특성을 나타낼 수있는 것이 유리하다. 아래의 구조식을 원근 도면이라고합니다. 점선 채권시으로 후퇴하는 동안 페이지의 삼각형 솔리드 본드시로 나오는 페이지입니다.

그림 7. 메탄 관점 모델.
이 모든 옷은 어떻게 그런 작은 공간에 들어갈 수 있습니까?,
우리가 여행 할 때,우리는 종종 더 많은 물건보다 우리가 필요합니다. 여행 가방에 그것을 모두 맞추려고 노력하는 것은 진정한 도전이 될 수 있습니다. 우리는 다시 포장하거나 그냥 모두 집어 넣어야 할 수도 있습니다. 원자는보다 안정적인 구조를 만들기 위해 종종 전자가있는 곳을 재 배열해야합니다.

중심 원자로 하나 이상의 고독한 쌍
분자 분자의 형상을 변경할 때 중앙 원자는 하나 이상 혼자의 쌍., 결합 쌍과 고독한 쌍 모두 전자쌍의 총 수는 전자 도메인 기하학이라고 불리는 것을 유도합니다. 전자의 결합 쌍 중 하나 이상이 고독한 쌍으로 대체되면 분자의 분자 기하학(실제 모양)이 변경됩니다. 이전 섹션에서 확립 된 A 및 B 기호를 유지하면서 e 를 사용하여 중심 원자(A)에서 고독한 쌍을 나타낼 것입니다. 첨자는 둘 이상의 고독한 쌍이있을 때 사용됩니다. 주변 원자(B)의 고독한 쌍은 기하학에 영향을 미치지 않습니다.,
AB3E:암모니아,NH3
암모니아 분자 포함되어 세 가지 단 하나 채권과 한 고독한 쌍에 질소 원자(그림 8).

그림 8. 암모니아의 고독한 쌍 전자.
4 개의 전자쌍을 가진 분자에 대한 도메인 기하학은 CH4 로 보았 듯이 사면체입니다. 암모니아 분자에서 전자 쌍 중 하나는 결합 쌍이 아닌 고독한 쌍입니다. NH3 의 분자 기하학을 삼각 피라미드 형이라고합니다(그림 9 참조).,

그림 9. 암모니아 분자.
사면체 CH4 분자의 결합 각은 109.5°임을 상기하십시오. 다시,결합 된 전자 쌍 중 하나를 고독한 쌍으로 대체하면 각도가 약간 압축됩니다. H-N-H 각도는 약 107°입니다.
AB2E2:물,H2O
는 물 분자로 구성되어 있는 두 개의 접합 쌍과 두 개의 고독한 쌍이다(그림 10).

그림 10. 물 위의 고독한 쌍 전자.,
으로 메탄과 암모니아 도메인 형상에 대한 분자과 함께 네 개의 전자 쌍은 사면체. 물 분자에서 전자 쌍 중 두 개는 결합 쌍이 아닌 고독한 쌍입니다. 물 분자의 분자 기하학은 구부러져 있습니다. H-O-H 결합 각도는 104.5°로 nh3 의 결합 각도보다 작습니다(그림 11 참조).

그림 11. 물 분자.,
AB4E:황 사 SF4
루이스 구조에 대한 SF4 포함되 네 하나의 채권 및 외로운 쌍에 황 atom(그림 12).

그림 12. Sf4 에서 고독한 쌍 전자.
유황 원자는 다섯 전자 그룹 주위에,그것에 해당하는 삼각 bipyramidal 도메인 형상으로,PCl5(그림 13 참조). 을 기억하는 삼각 bipyramidal 기하학은 세 가지 적도 원자와 두 개의 축 방향 원자에 부착된 중앙 atom., 고독한 쌍의 반발력이 더 크기 때문에 고독한 쌍으로 대체되는 적도 원자 중 하나입니다. 분자의 기하학은 왜곡 된 사면체 또는 시소라고합니다.

그림 13. Sf4 용 볼 및 스틱 모델.,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- 고독한 쌍 전자의 존재는 분자의 3 차원 모양에 영향을 미친다.
연습
중앙 원자 없이 고독한 쌍
아래 링크를 사용하여 다음과 같은 질문에 대답:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- 어떤 모양의 PF5?
- 분자가 평면이라면 메탄에 대해 어떤 C-H bod 각도를 예측할 수 있을까요?
- 어떤 분자가 팔면체의 구성을 가지고 있습니까?,
중심 원자로 하나 이상의 고독한 쌍
아래 링크를 사용하여 다음과 같은 질문에 대답:
- 어떤 것은 일반적인 원칙을 다루는 분자 보다는 더 많은 것을 포함하는 네 개의 전자 쌍?
- 중심 원자 주위에 5 개의 전자쌍이있는 그림에서 오른쪽의 배열이 선호되는 이유는 무엇입니까?
- 6 개의 전자쌍을 가진 그림에서,왜 서로 180o 에서 고독한 쌍을 갖는 구성이 더 안정적입니까?,
리뷰
중앙 원자 없이 고독한 쌍
- 어떤 채권의 각도에서 이산화탄소?
- 결합 각도가 109.5°인 분자는 무엇입니까?
- BF3 분자의 기하학은 무엇입니까?
중심 원자로 하나 이상의 고독한 쌍
- 왜 물이 굽은 형상?
- 암모니아가 평면 분자가 아닌 이유는 무엇입니까?
- 아베 시스템을 사용하여 크세논 테트라 플루오 라이드에 대한 구성을 어떻게 작성하겠습니까?















