17.3: Ácido-Base, Indicadores
os Objectivos de Aprendizagem
- Explicar a função e as mudanças de cor de ácido-base, indicadores
- Demonstrar como a escolha adequada do indicador para um experimento de titulação
- Determinar o ácido constantes de dissociação Ka ou Kai de indicadores.certas substâncias orgânicas mudam de cor na solução diluída quando a concentração de íon hidrônio atinge um valor particular., Por exemplo, a fenolftaleína é uma substância incolor em qualquer solução aquosa com uma concentração de íon hidrônio superior a 5,0 × 10-9 M (pH < 8.3). Em soluções mais básicas onde a concentração de íon hidrônio é inferior a 5,0 × 10-9 M (pH > 8.3), é vermelho ou rosa. Substâncias como a fenolftaleína, que podem ser usadas para determinar o pH de uma solução, são chamadas indicadores ácido-base. Os indicadores ácido-base são ácidos orgânicos fracos ou bases orgânicas fracas.,
O equilíbrio em uma solução de ácido-base indicador de metil orange, um ácido fraco, pode ser representada por uma equação em que usamos HIn como uma representação simples para o complexo de metil orange molécula:
\
\}{}}=4.0×10^{-4}\]
O ânion do metil orange, Em−, é amarelo, e o nonionized forma, Him, é vermelho. Quando adicionamos ácido a uma solução de laranja-metilo, a concentração aumentada de íon hidrônio muda o equilíbrio para a forma vermelha não-ionizada, de acordo com o princípio de Le Chatelier. Se adicionarmos a base, mudamos o equilíbrio para a forma amarela., Este comportamento é completamente análogo à ação dos buffers.
A cor de um indicador é o resultado visível da razão das concentrações das duas espécies em− e HIn. Se a maior parte do indicador (tipicamente cerca de 60-90% ou mais) está presente como In−, então nós vemos a cor do in− íon, que seria amarelo para laranja metila. Se a maioria está presente como HIn, então vemos a cor da molécula HIn: vermelho para laranja metila., O metil orange, podemos reordenar a equação para Ka e escrever:
\}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}\]
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:ou\:pH=p\mathit{K}_a+log\left(\dfrac{}{}\right)}\]
A última fórmula é a mesma de Henderson-Hasselbalch equação, que pode ser usado para descrever o equilíbrio de indicadores.,
Quando TEM o mesmo valor numérico que Ka, a razão de to é igual a 1, o que significa que 50% do indicador está presente na forma vermelha (HIn) e 50% está na forma iônica amarela (In−), e a solução parece laranja em cor. Quando a concentração do íon hidrônio aumenta para 8 × 10-4 M( um pH de 3.1), a solução fica vermelha. Nenhuma mudança na cor é visível para qualquer aumento adicional na concentração do íon hidrônio (diminuição no pH). A uma concentração de iões de hidrônio de 4 × 10-5 M (um pH de 4.,4), A maior parte do indicador está na forma iônica amarela, e uma maior diminuição na concentração do íon hidrônio (aumento no pH) não produz uma mudança de cor visível. O intervalo de pH entre 3,1 (vermelho) e 4,4 (amarelo) é o intervalo de mudança de cor do laranja-metilo; a mudança de cor pronunciada ocorre entre estes valores de pH.muitas substâncias diferentes podem ser utilizadas como indicadores, dependendo da reacção específica a monitorizar., Por exemplo, o sumo de repolho vermelho contém uma mistura de substâncias coloridas que mudam de vermelho profundo a baixo pH para azul claro a um pH intermediário para amarelo a alto pH (figura \(\PageIndex{1}\)). Em todos os casos, porém, um bom indicador deve ter as seguintes propriedades:
- a mudança de cor deve ser facilmente detectada.a mudança de cor deve ser rápida.a molécula indicadora não deve reagir com a substância a ser titulada.
- para minimizar os erros, o indicador deve ter uma pKin que esteja dentro de uma unidade de pH do pH esperado no ponto de equivalência da titulação.,

Figure \(\PageIndex{1}\): indicadores de pH naturais no Sumo de couve vermelha. Image curtesty of Wikipedia. couve suco contém uma mistura de substâncias cuja cor depende do pH. Cada tubo de ensaio contém uma solução de couve suco em água, mas o pH das soluções varia de pH = 2.0 (à esquerda) para pH = 11.0 (extrema direita). Em pH = 7.0, a solução é azul.,foram desenvolvidos indicadores sintéticos que satisfazem estes critérios e cobrem praticamente toda a gama de pH. A figura \(\PageIndex{2}\) mostra o intervalo de pH aproximado sobre o qual alguns indicadores comuns mudam de cor e a sua mudança de cor. Além disso, alguns indicadores (como o azul de timol) são ácidos polipróticos ou bases, que mudam de cor duas vezes em valores de pH amplamente separados.
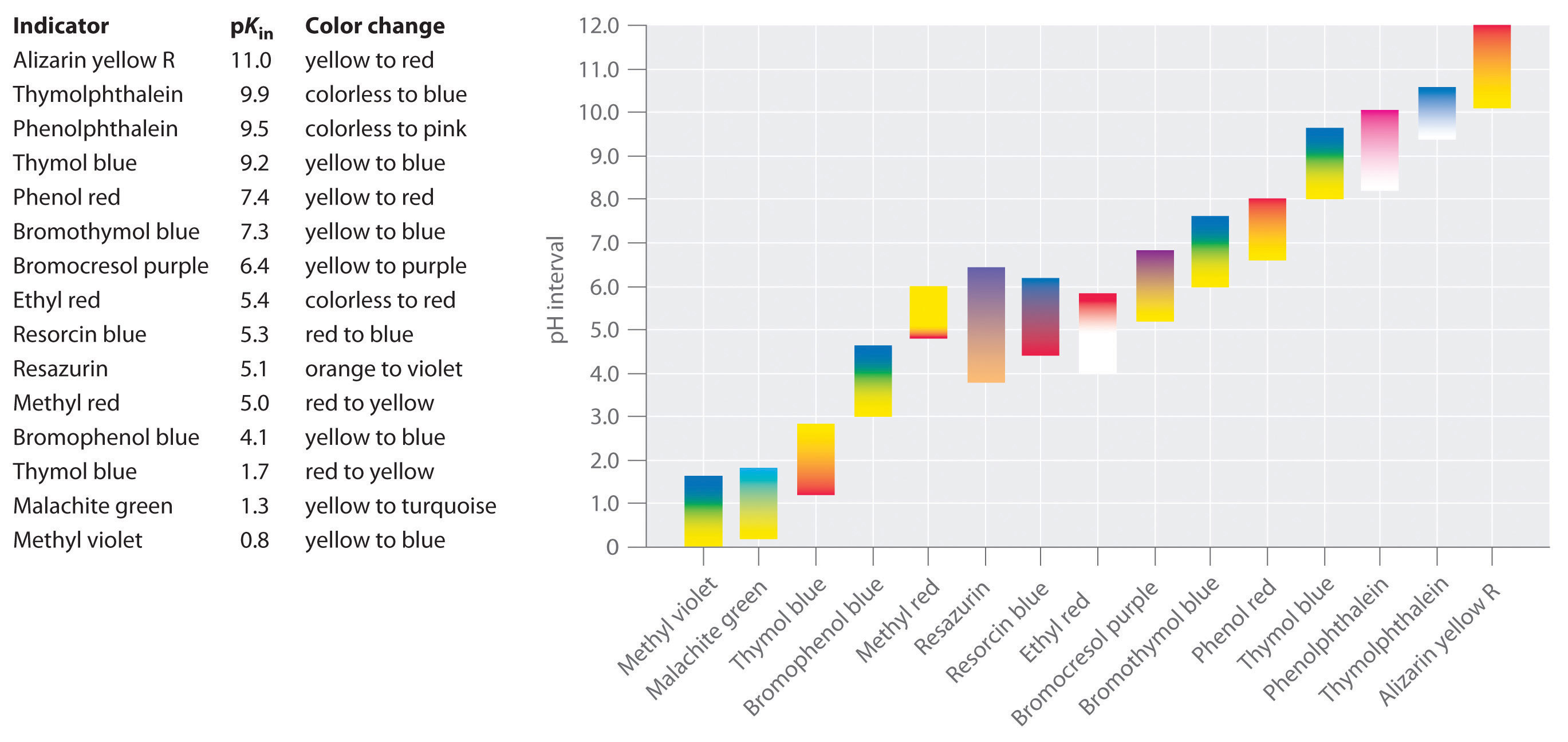
Figure \(\PageIndex{2}\): Some Common Acid–Base Indicators., Cores aproximadas são mostradas, juntamente com os valores de pKin e o intervalo de pH sobre o qual a cor muda. é importante estar ciente de que um indicador não muda abruptamente de cor a um determinado valor de pH; em vez disso, ele realmente sofre uma titulação de pH tal como qualquer outro ácido ou base. À medida que a concentração de HIn diminui e a concentração de In− aumenta, a cor da solução muda lentamente da cor característica de HIn para a de In−. Como veremos na seção 16, a relação / muda de 0.,1 a um pH de uma unidade abaixo de pKin a 10 a um pH de uma unidade acima de pKin. Assim, a maioria dos indicadores mudam de cor sobre uma gama de pH de cerca de duas unidades de pH.
afirmamos que um bom indicador deve ter um valor de pKin próximo ao pH esperado no ponto de equivalência. Para uma forte titulação de base ácido-forte, a escolha do indicador não é especialmente crítica devido à grande mudança de pH que ocorre em torno do ponto de equivalência., Em contraste, usar o indicador errado para uma titulação de um ácido fraco ou uma base fraca pode resultar em erros relativamente grandes, como ilustrado na figura \(\Paginindex{3}\). Esta figura mostra os gráficos de pH versus volume de base adicionado para a titulação de 50.0 mL de uma 0.100 M solução de um ácido forte (HCl) e um ácido fraco (ácido acético) com 0.100 M \(NaOH\). Os intervalos de pH sobre os quais dois indicadores comuns (vermelho de metilo, \(pK_{in} = 5.0\), e fenolftaleína, \(pK_{in} = 9.5\) também são mostrados., As barras horizontais indicam os intervalos de pH sobre os quais ambos os indicadores mudam de cor ao longo da curva de titulação de HCl, onde é quase vertical. Assim, ambos os indicadores mudam de cor quando é adicionado essencialmente o mesmo volume de \(NaOH\) (cerca de 50 mL), o que corresponde ao ponto de equivalência. Em contrapartida, a titulação do ácido acético dará resultados muito diferentes Consoante o vermelho de metilo ou a fenolftaleína sejam utilizadas como indicador., Embora o intervalo de pH sobre o qual a fenolftaleína muda de cor seja ligeiramente maior do que o pH no ponto de equivalência da forte titulação ácida, o erro será negligenciável devido ao declive desta porção da curva de titulação. Tal como com a titulação de HCl, o indicador de fenolftaleína ficará rosa quando forem adicionados à solução de ácido acético cerca de 50 mL de \(NaOH\). Em contraste, o vermelho de metila começa a mudar de vermelho para amarelo em torno de pH 5, que é perto do ponto médio da titulação do ácido acético, não o ponto de equivalência., Adicionar apenas cerca de 25-30 mL de \(NaOH\) irá, portanto, fazer com que o indicador vermelho de metilo mude de cor, resultando em um erro enorme.
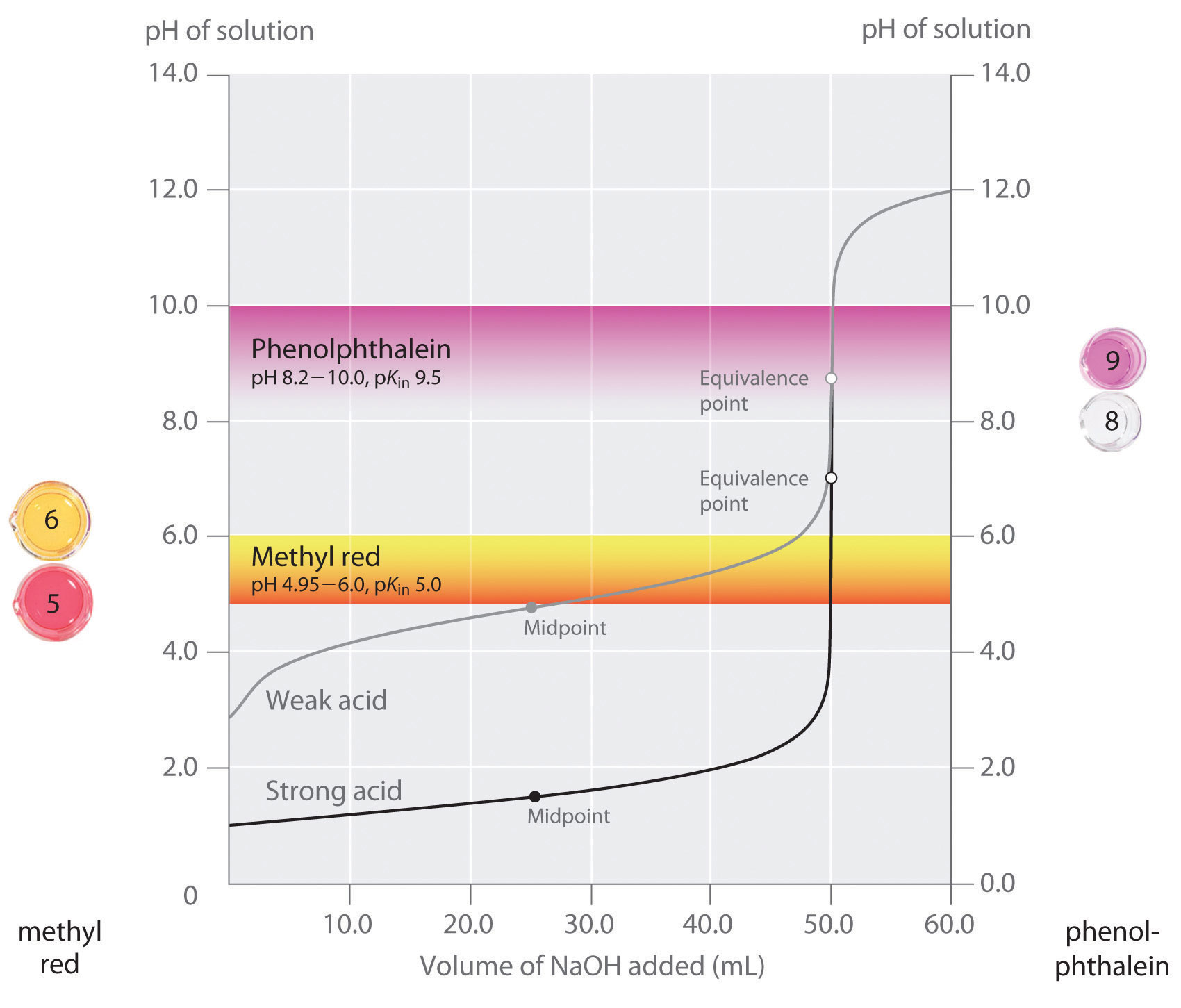
Figura \(\PageIndex{3}\): a Escolha Correta de Indicador Ácido–Base de Titulação O gráfico mostra os resultados obtidos através de dois indicadores (de metilo, vermelho e fenolftaleína) para a titulação de 0,100 M de soluções de um ácido forte (HCl) e um ácido fraco (ácido acético) com 0.100 M \(NaOH\)., Devido à inclinação da curva de titulação de um ácido forte em torno do ponto de equivalência, qualquer indicador mudará rapidamente de cor no ponto de equivalência para a titulação do ácido forte. Em contraste, o pKin para vermelho de metila (5.0) é muito próximo do pKa do ácido acético (4,76); o ponto médio da mudança de cor para vermelho de metila ocorre perto do ponto médio da titulação, ao invés do ponto de equivalência.
em geral, para titulações de ácidos fortes com bases fortes (e vice-versa), qualquer indicador com um pK entre 4.0 e 10.0 serve., No entanto, para a titulação de um ácido fraco, o pH no ponto de equivalência é superior a 7,0, pelo que deve ser utilizado um indicador como a fenolftaleína ou o azul de timol, com pKin > 7,0. Inversamente, para a titulação de uma base fraca, onde o pH no ponto de equivalência é inferior a 7.0, um indicador como vermelho de metilo ou azul de bromocresol, com pKin < 7.0, deve ser usado.
exemplo \(\PageIndex{1}\)
na titulação de um ácido fraco com uma base forte, que indicador seria a melhor escolha?,
- Metil Orange
- Bromocresol Verde
- Phenolphtalein
Solução
a resposta correta é A C. Na titulação de um ácido fraco com uma base forte, o conjugado da base de dados do ácido fraco vai fazer o pH no ponto de equivalência maior do que 7. Portanto, você iria querer um indicador para mudar nesse intervalo de pH. Tanto laranja-metilo quanto verde de bromocresol mudam de cor em uma gama de pH ácido, enquanto fenolftaleína muda em um pH básico.,
a existência de muitos indicadores diferentes com cores diferentes e valores de pKin também fornece uma maneira conveniente de estimar o pH de uma solução sem usar um medidor de pH eletrônico caro e um eletrodo de pH frágil. As tiras de papel ou plástico impregnadas com combinações de indicadores são usadas como “papel pH”, o que lhe permite estimar o pH de uma solução, simplesmente mergulhando um pedaço de papel pH nela e comparando a cor resultante com os padrões impressos no recipiente (figura \(\PageIndex{4}\)).,
Figure \(\PageIndex{4}\): pH Paper. pH paper contém um conjunto de indicadores que mudam de cor em diferentes valores de pH. O pH aproximado de uma solução pode ser determinado simplesmente mergulhando uma tira de papel na solução e comparando a cor com os padrões fornecidos. Summary
Acid–base indicators are compounds that change color at a particular pH., Eles são tipicamente ácidos fracos ou bases cujas mudanças de cor correspondem à desprotonação ou protonação do próprio indicador.
Colaboradores e Atribuições
-
Paulo Flores (Universidade da Carolina do Norte – Pembroke), Klaus Theopold (Universidade de Delaware (eua) e Richard Langley (Stephen F. Austin State University), com autores. Textbook content produced by OpenStax College is licensed under a Creative Commons Attribution License 4.0 license. Download gratuito em http://cnx.org/contents/85abf193-2bd…[email protected]).
- {Modelo.,Contribuboundless ()}}















