Fronteiras na ciência das plantas
introdução
a progressão correcta da maturação dos frutos é essencial para atingir a qualidade óptima dos frutos e o seu longo prazo de validade, características importantes que determinam os mercados de preços e os lucros finais. No entanto, o amadurecimento é um processo complexo onde muitos fatores estão envolvidos, incluindo o controle hormonal, que regula as alterações bioquímicas e fisiológicas que dão propriedades organolépticas e nutricionais finais dos frutos., Tradicionalmente, os frutos carnudos são classificados de acordo com o processo de maturação em frutos climatéricos e não climatéricos. Frutos climatéricos como tomates ou bananas exigem um aumento da taxa respiratória e da produção de etileno para desencadear o processo de maturação em resposta autocatalítica (Barry e Giovannoni, 2007; Liu et al., 2015)., Antagonisticamente, os frutos não-climatéricos, como os citrinos ou as uvas, não apresentam uma ruptura nem em etileno nem em respiração antes do início da maturação, e nestes frutos, a maturação é controlada principalmente pela acumulação progressiva do ácido abcísico fitohormona (ABA; Rodrigo et al., 2006; Castellarin et al., 2011). No entanto, novos estudos estão reforçando a ideia de que o processo de amadurecimento não é apenas regido pela produção de uma fitohormona, mas sim parecendo ser o resultado de um equilíbrio hormonal controlado (Symons et al., 2012; Teribia et al., 2016; Li et al., 2019).,auxinas, ácido salicílico (SA) e melatonina são fitohormonas envolvidas na sinalização e regulação de muitos processos cruciais em plantas. As auxinas têm sido amplamente descritas como reguladores de crescimento e desenvolvimento com múltiplas funções em plantas (ver Taylor-Teeples et al., 2016); SA desencadeia a resposta de defesa contra patógenos biotróficos e hemi-biotróficos (Loake e Grant, 2007), bem como ter um papel importante sob estresse abiótico (Dong et al., 2014; Wani et al., 2017), flowering and cell cycle control (Carswell et al., 1989; Eberhard et al.,, 1989, respectivamente); e a melatonina não só tem funções semelhantes às do auxin (Chen et al., 2009; Zuo et al., 2014; Wen et al., 2016) mas também tem sido sugerido agir como um potencial antioxidante em algumas plantas (Arnao e Hernández-Ruiz, 2015) e um regulador de respostas de plantas a patógenos (Chen et al., 2018). Curiosamente, estes três hormônios compartilham um precursor comum-corismato -, assim uma conversa metabólica cruzada ocorre entre eles, e um número de genes deve ser finamente regulado para desviar o metabolismo corismato para esses compostos., Nos últimos anos, várias análises abordaram a biossíntese e o papel do auxin (Paul et al., 2012), SA (Asghari e Aghdam, 2010) e melatonin (Feng et al., 2014; Arnao e Hernández-Ruiz, 2018) em frutas. No entanto, sua biossíntese e funções têm sido descritas separadamente. Aqui, discutiremos os aspectos comuns e diferenciais da biossíntese, metabolismo e função da auxina, SA e melatonina no crescimento e amadurecimento dos frutos climatéricos e não climatéricos., Será dada ênfase aos pontos-chave do desvio metabólico na sua biossíntese do corismato, ao papel regulador durante a maturação dos frutos climatéricos e não climatéricos e ao seu papel na modulação da biossíntese dos compostos bioactivos, que determina em grande medida a qualidade dos frutos.o Corismato é o produto final da Via do shikimato e desempenha um papel fundamental na biossíntese das fitohormonas (Figura 1)., Chorismate dá origem a aminoácidos aromáticos, incluindo o triptofano, e através de várias reações, incluindo a conversão de triptofano para indol-3-ácido pirúvico pela triptofano aminotransferase (TA); pode gerar a auxina indol-3-acético (IAA). A AT tem sido proposta como uma enzima chave universal para a biossíntese IAA não apenas em órgãos vegetativos (Enríquez-Valencia et al., 2018) mas também no desenvolvimento de órgãos reprodutivos (Reyes-Olalde et al., 2017), incluindo o crescimento e a maturação da fruta (Estrada-Johnson et al., 2017)., Em contraste, quando o isocorismato sintase (ICS) é ativado, o corismato pode ser convertido em isocorismato e este último pode ser transformado em SA. Apesar de esta via ter sido identificada pela primeira vez em bactérias, ela também está atualmente bem estabelecida em plantas (Wildermuth et al., 2001; Uppalapati et al., 2007; Catinot et al., 2008; Garcion et al., 2008; Abreu and Munné-Bosch, 2009). Finalmente, o triptofano pode transformar-se em triptamina pela enzima triptofano descarboxilase (TDC)., Embora esta seja outra das múltiplas vias de biossíntese do IAA (a triptamina transforma-se em indole-3-acetaldeído e mais tarde em IAA), TDC também foi proposta para ser a primeira enzima limitadora de taxa na Via da melatonina (Kang et al., 2007). O TDC foi identificado pela primeira vez na família Apocynaceae (De Luca et al., 1989) a ser posteriormente descrito em vários sistemas de plantas (Byeon et al., 2012, 2014; Zhao et al., 2013; Wei et al., 2018)., Após a descarboxilação, a triptamina é convertida em serotonina pela triptamina-5-hidroxilase, e depois a serotonina transforma-se em N-acetil-serotonina para finalmente produzir melatonina no citosol (Figura 1).
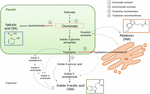
a Figura 1. Biossíntese do ácido indole-3-acético (IAA), do ácido salicílico (SA) e da melatonina (Mel) do corismato. Todos os três compostos compartilham um precursor final comum (corismato, quadrado em laranja) da Via do shikimato., Os principais pontos de desvio são indicados com setas vermelhas e as enzimas correspondentes são numeradas numa ordem de divergência descendente de shikimate. Setas a negrito indicam mais de um passo entre compostos. As setas finas indicam caminhos que ainda não estão bem definidos.foram recentemente identificadas em frutos carnudos (Figura 1) enzimas de desvio de chaves que conduzem à síntese das hormonas da via corismática. ICS, que a expressão tem demonstrado ser crucial para a tolerância ao stress biótico (Garcion et al.,, 2008; Zeng e He, 2010), foi identificado em tomates e maçãs. Zhu et al. (2016) reported the overexpression of ICS1 (isochorismate synthase 1) under cold storage conditions in tomato, while Zhang et al. (2017) found activation of a transcription factor involved in the pathogen-related SA signaling pathway inducing ICS expression in apples. Foi relatada uma maior actividade do TDC em frutos não maduros após infecção por agentes patogénicos-através do aumento da expressão TDC1 e TDC2 (Park et al., 2013) – e na fase de crescimento em frutos de amora (Wang et al., 2016)., Finalmente, a TA foi identificada na grapevine, tanto na pré-quanto na véraison (Böttcher et al., 2013; Gouthu e Deluc, 2015, respectivamente), bem como durante a maturação de morango (Estrada-Johnson et al., 2017). É digno de nota, no entanto, que os genes e enzimas descritas no climatério frutas (i.é., ICS) não foram identificados em a fruta não climatérica (i.é., PMS e TA) e vice-versa; portanto, mais estudos são indispensáveis para preencher essas lacunas de conhecimento e entender melhor como essas desvio pontos em comum regulado durante a fruta.,
o papel dos Fitohormones derivados do Corismato nos frutos climatéricos e não climatéricos
a desvendar os mecanismos de desenvolvimento de frutos tem sido um dos principais desafios da recente investigação Agronómica pelas suas implicações económicas. Neste contexto, as fitohormonas têm sido apontadas como motores responsáveis da maturação de frutas, especialmente etileno e ABA em frutos climatéricos e não climatéricos, respectivamente. No entanto, que estes fitohormones poderiam regular o desenvolvimento de frutas sozinho foi logo provado ser muito simples., Após uma extensa pesquisa e com a melhoria da Química Analítica e das técnicas moleculares, várias outras hormonas foram confirmadas como potenciais reguladores do desenvolvimento e amadurecimento da fruta, incluindo fitohormonas derivadas do corismato.as auxinas são um grupo de hormonas vegetais que desempenham um papel essencial no desenvolvimento da fruta, exercendo a sua própria influência e modulando a expressão de outras fitohormonas., Os teores endógenos de IAA são particularmente elevados no conjunto de frutos e nos estádios de desenvolvimento iniciais de crescimento, após o que as quantidades de IAA tendem a diminuir antes do início da maturação, tanto no climatérico (Zaharah et al., 2012) and non-climacteric fruits (Symons et al., 2012; Teribia et al., 2016), com algumas exceções, como peaches (Tatsuki et al., 2013) e algumas variedades de ameixa (El-Sharkawy et al., 2014; figura 2A). Foi demonstrado que o IAA está envolvido na iniciação de fruteiras em combinação com giberelinos (Mezzetti et al., 2004; Serrani et al., 2010; Bermejo et al., 2018; Hu et al.,, 2018). A deficiência de biossíntese ou sinalização do IAA geralmente leva a partenocarpy frutícola, embora também possa resultar em maturação anormal em alguns frutos (Wang et al., 2005; Liu J. et al., 2018; Reig et al., 2018). Os teores elevados de IAA nos estádios iniciais de desenvolvimento dos frutos promovem o crescimento dos frutos devido à implicação da auxina na divisão celular em associação com citoquininas e no controlo da expansão celular em associação com giberelinas (Liao et al., 2018)., Durante este período, A crosstalk hormonal entre as auxinas e as giberelinas permite adicionalmente a formação normal de fruta numa regulação ajustada mediada por factores de resposta auxina (ARFs; Liao et al., 2018; Liu S. et al., 2018).
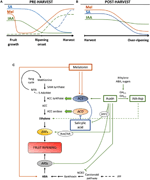
Figura 2. Papel do IAA, SA e Mel durante o desenvolvimento de frutos climatéricos e não climatéricos. Modelo que resume as interacções de IAA, SA e Mel durante a maturação de frutos climatéricos e não climatéricos durante A (a) pré e (B) pós-colheita., Linhas tracejadas indicam dinâmica alternativa do conteúdo de fitormona em alguns frutos (ver texto para discussão). C) panorâmica da interacção do IAA, SA e Mel com a biossíntese do etileno e do ácido abcísico (ABA) nos frutos climatéricos e não climatéricos. A auxina é um regulador positivo da biossíntese do etileno através da ativação dos genes da ACC sintase (ACS) e induzindo a expressão de fatores sensíveis ao etileno (ERFs). A Auxin também reprime a produção de ABA pela repressão da dioxigenase 9-cis-epoxicarotenóide (NCED) e inibe os genes de stress que respondem à ABA (ARS) pela proteína ARF2., O conteúdo endógeno de IAA pode ser reduzido pelas proteínas GH3, cuja síntese é promovida pelo etileno, ABA e açúcares. Linha descontínua indica o possível papel do IAA pelo IAA-Asp como um fator de maturação que aumenta o etileno em alguns frutos. A melatonina aumenta a produção de ABA e etileno, embora a ACS possa ser inibida dependendo do conteúdo da melatonina. A SA actua como um inibidor dos genes da ACO (etileno) que reprimem a ACO, embora possa promover a expressão da ACS., MTA, 50-methylthioadenosine; S-AdoMet, S-adenosyl-metionina; SAM sintase, S-adenosyl-metionina sintase; ACC, 1-aminocyclopropane-1-ácido carboxílico; IPP, isopentenyl difosfato.antes do início da maturação em vários frutos, foram notificadas reduções do conteúdo das IAA endógenas. Estas reduções têm sido relacionadas com a conjugação do IAA com ácido aspártico (IAA-Asp) pelas sintetases do IAA-amido, GH3-1 e GH3-2 (Figura 2C)., Com efeito, o GH3-1 e o GH3-2 apresentaram uma expressão mais elevada durante o desenvolvimento precoce dos frutos e, sobretudo, durante o início da maturação, tanto em frutos climatéricos, como tomates (Sravankumar et al., 2018) e maçãs (Onik et al., 2018), bem como em frutos não climatéricos, como bagas de uva (Böttcher et al., 2010, 2011) e framboesas (Bernales et al., 2019)., Curiosamente, os bagos de uva apresentaram uma expressão aumentada de GH3-1 após a aplicação ABA e etefão, o que poderia explicar o envolvimento do etileno no controlo do conteúdo do IAA após o início da maturação, mesmo em frutos não climatéricos (Böttcher et al., 2010). De facto, vários estudos realçam a estreita interacção entre as auxinas e o etileno na maturação dos frutos, com uma influência recíproca entre elas (Tadiello et al., 2016a; Busatto et al., 2017)., No caso dos frutos climatéricos, é necessário aumentar o conteúdo do IAA para activar a expressão dos genes ACC sintase (ACS), codificando a ACC synthase, o que, por sua vez, levará à produção de etileno a desencadear o processo de maturação (figura 2C; Tatsuki et al., 2013). Frutas como tomates (Li et al., 2016) ou bananas (Choudhury et al.,, 2008), que geralmente experiência de redução de IAA conteúdo antes do início da maturação, mostram um amadurecimento atraso quando IAA ou análogos são exógeno aplicada, enquanto que frutas como pêssegos, cujo IAA conteúdo aumentar progressivamente até totalmente amadurecer, show de maturação quando auxinas são aplicadas (Tadiello et al., 2016b). Portanto, uma regulação rígida, complexa e diferencial das interações auxin-etileno deve existir em vários frutos durante a maturação pré-colheita., Além disso, o conteúdo do IAA diminui antes do início do amadurecimento em alguns frutos não climatéricos para desimprimir a dioxigenase 9-cis-epoxicarotenóide (NCED) e iniciar a síntese ABA (figura 2C; Jia et al., 2016). Curiosamente, este processo também é mediado pela conjugação do IAA através da atividade potenciada do GH3-1 (Böttcher et al., 2010). No entanto, Estrada-Johnson et al. (2017) mostrou que, apesar de IAA conteúdo diminuição durante o morango amadurecimento, de expressão, de FaAux/IAA e FaARF famílias de genes são induzidos em vermelho recipientes, sugerindo o envolvimento de auxina sinalização totalmente no amadurecimento de frutos.,durante o período pós-colheita, os teores de auxina permanecem invariantes ou tendem a diminuir devido a processos oxidativos que podem dar origem a reduções pequenas, mas progressivas, do conteúdo endógeno de IAA (figura 2B). Tratamentos Auxin após a colheita atraso sobre-amadurecimento em alguns frutos (Chen et al., 2016; Moro et al., 2017) e aumentar o conteúdo de alguns ácidos orgânicos, mantendo a acidez dos frutos (Li et al., 2017), sugerindo assim que o auxin desempenha também um papel significativo no controlo da maturação de frutos durante o período pós-colheita.,
múltiplos papéis do ácido salicílico durante o desenvolvimento e a maturação dos frutos
o ácido salicílico é outro feritormona derivado do corismato que tem sido principalmente relacionado com o seu efeito protector sob stress biótico para controlar as perdas pré-colheita e pós-colheita derivadas da infecção patogénica dos frutos (Babalar et al., 2007; Cao et al., 2013). Em geral, os conteúdos endógenos da SA livre são mais elevados no início do desenvolvimento de fruta e, em seguida, diminuem progressivamente (Oikawa et al., 2015). Lu et al. (2015) relatou um aumento secundário na SA durante a segunda fase de crescimento da peach fruits., A aplicação exógena da SA nas bananas atrasou o processo de maturação, reduzindo a ruptura respiratória e a razão polpa / casca, bem como a actividade decrescente das enzimas relacionadas com a degradação da parede celular e o sistema antioxidante (Srivastava e Dwivedi, 2000). Além disso, o tratamento das Cerejeiras doces com ácido salicílico e acetilsalicílico (ASA) aumentou o peso, a firmeza e a cor das cerejas na fase comercial (Giménez et al., 2014). Aplicação exógena do salicilato de SA ou de metilo (MeSA) durante a pós-colheita, atraso na sobre-maturação em frutos como kiwis (Zhang et al.,, 2003), e cerejas doces (Valero et al., 2011). Além disso, os tratamentos com salicílico ou ácido acetilsalicílico aliviaram as lesões arrepiantes das romãs (Sayyari et al., 2011), tomatoes (Aghdam et al., 2014), e abacates (Glowacz et al., 2017). SA também interage com o etileno através da inibição da expressão da ACC oxidase (ACO) (Shi e Zhang, 2012). Surpreendentemente, verifica-se também um aumento do conteúdo da expressão ACS nas peras, após a aplicação da SA, de forma controlada pela dose (Shi et al., 2013; Shi e Zhang, 2014). Por conseguinte, a regulamentação da produção de etileno dependente da SA é finamente regulamentada (figura 2C).,
melatonina: um regulador emergente para o controlo do desenvolvimento de fruta
melatonina é também uma hormona vegetal da via derivada do corismato que ganhou muita atenção nos últimos anos (Hernández-Ruiz et al., 2005; Arnao and Hernández-Ruiz, 2018; Sharif et al., 2018). Recentemente, a melatonina tem sido apontada como um fator importante para o conjunto de frutas, de forma semelhante aos efeitos do IAA (figura 2A; Liu S. et al., 2018). Além disso, foi observada a produção circadiana desta fitormona (Kolář et al., 1997)., Durante o amadurecimento na árvore, as uvas tratadas com melatonina mostraram maior Sincronicidade e aumento de peso quando amadurecem completamente (Meng et al., 2015). Além disso, outro estudo recente de Xu et al. (2018) described that melatonin could promote grape berry ripening through its interaction with ABA and ethylene, as well as hydrogen peroxide. Foi demonstrado que a melatonina confere tolerância à refrigeração durante a armazenagem a frio da fruta, que parece estar principalmente relacionada com a sua actividade antioxidante (Cao et al., 2018; Aghdam et al., 2019)., Durante a pós-colheita, os tomates apresentaram um aumento da emissão de etileno após a aplicação da melatonina a 50 µM (Sun et al., 2015), Ao contrário das peras, onde a aplicação exógena da melatonina a 100 µM inibiu a produção de etileno (Zhai et al., 2018), ou frutos de bananeira, em que a melatonina de 50-200 µM inibiu a expressão de ACS e ACO (figura 2C; Hu et al., 2017). Embora os diferentes efeitos da aplicação de melatonina possam estar relacionados com um efeito de dosagem, é necessária mais investigação para compreender melhor o papel da melatonina no controlo do desenvolvimento de fruta.,demonstrou-se que, durante o desenvolvimento e a maturação dos frutos, se verifica uma conversa cruzada das fitohormonas derivadas do Corismato no controlo do desenvolvimento dos frutos. Breitel et al. (2016) concluiu que as auxinas podem interagir com a SA através da ARF2 (figura 2C) e que a sobreexpressão da ARF2 no tomate resultou em teores mais baixos de SA e num atraso significativo de maturação., Isto indica que as auxinas podem estar a limitar a produção de ácido acetilsalicílico durante o desenvolvimento de frutos, o que pode explicar um compromisso entre o crescimento de frutos (mediado pela auxina) e a activação de defesas bióticas (mediada pela SA). Além disso, a aplicação exógena da SA nos frutos de papaia resultou numa expressão alterada de vários genes IAA, alguns deles sendo regulados para baixo, enquanto outros para cima regulados (Liu et al., 2017)., Neste caso, os resultados foram inconclusivos do que realmente ocorre endogenamente na putativa conversa cruzada entre auxin e SA durante a maturação de frutas e mais pesquisas são necessárias neste e outros frutos climatéricos. Em qualquer caso, é evidente que o IAA e a SA estão estreitamente relacionados, não só metabolicamente, mas também funcionalmente. Finalmente, vários estudos relataram a influência da melatonina na biossíntese e/ou sinalização da IAA e SA (revisado em Arnao e Hernández-Ruiz, 2018), embora, ao nosso conhecimento, nenhum destes estudos foi realizado nem em frutos climatéricos nem em frutos não-climatéricos.,
Modulação de Compostos Bioativos Biossíntese pelo Chorismate Derivada de Fitohormônios
compostos Bioativos (incluindo compostos fenólicos, isoprenoids, e vitaminas antioxidantes) não só têm sido amplamente investigados como responsáveis por determinadas propriedades organolépticas dos alimentos, mas também para seus efeitos protetores em células humanas contra os processos oxidativos no desenvolvimento de neurodegenerativas e doenças cardiovasculares e certos tipos de câncer (Liu et al., 1999; Mueller et al., 2010; Sturgeon and Ronnenberg, 2010; Björkman et al., 2011)., Compostos fenólicos contribuem significativamente para a transmissão de sabores específicos, como taninos – responsáveis pela amargura ou sabor astral de certos frutos, e cores, como pigmentos antocianinos – responsáveis por cores de frutos vermelhos, azuis e roxos (Croteau et al., 2000). A relevância dos compostos fenólicos para o consumo humano tem sido associada a um efeito protector contra os processos oxidativos em relação à saúde cardiovascular e do sistema nervoso central, bem como a um risco reduzido de cancros do tracto gastrointestinal (Björkman et al., 2011)., Os carotenóides, tetraterpenos pertencentes aos isoprenóides, desempenham um papel na protecção contra os processos fotooxidantes e como pigmentos orgânicos; são responsáveis pela cor laranja-amarela dos frutos (Tapiero et al., 2004). Pensa-se que os carotenóides dietéticos proporcionam benefícios para a saúde na diminuição do risco de doença ocular e de certos tipos de cancros devido ao seu papel como antioxidantes (Johnson, 2002). As vitaminas C E E, incluindo o ácido ascórbico e os tocoferóis, respectivamente, são factores essenciais de qualidade nutricional nos frutos com muitas actividades biológicas nos seres humanos (Miret e Müller, 2017)., Considerando o papel relevante de todos esses compostos bioativos como compostos de promoção da saúde nos frutos, a modulação de sua acumulação é de importância primordial tanto em frutos climatéricos quanto não climatéricos (Vasconsuelo e Boland, 2007). A maioria destes compostos bioativos são acumulados em altos níveis durante o amadurecimento da fruta, quando os frutos verdes menos saborosos conversam em uma fruta nutritivamente Rica, colorida e saborosa (Daood et al., 1996; Ranalli et al., 1998; Dumas et al., 2003; Singh et al., 2011)., No entanto, uma vez iniciado, o amadurecimento não pode ser parado e geralmente leva a sobre-amadurecimento que afeta negativamente a qualidade dos frutos (Kumar et al., 2014). Portanto, a minimização da deterioração dos frutos após a colheita, ao mesmo tempo que se obtém um elevado teor de compostos bioativos, continua a ser um dos maiores desafios a resolver.a auxina foi identificada como um importante regulador da biossíntese carotenóide durante o amadurecimento dos frutos de tomate climatéricos. A maturação no tomate está associada à degradação da clorofila e à deslocação das xantofilas para carotenos (β-caroteno e licopeno) (Fraser et al., 1994)., IAA parece atraso de tomate amadurecimento e reprimindo etileno e vários montante carotenóide transcrições incluindo Psy, Ziso, Pds, Critiso bem como Chlases 1-3 e, por outro lado, promovendo o acúmulo de β-Lyc1 e Crtr-β1 transcrições, resultando em maior índice de xanthophylls e clorofila-a (Su et al., 2015). Além disso, em alguns frutos não climatéricos, como a cereja e as bagas de uva auxina, parece também modular a biossíntese da antocianina, controlando assim os processos de maturação dos frutos. Teribia et al., (2016) reported a negative correlation between IAA and anthocyanin contents indicating that anthocyanin accumulation starts when IAA contents decrease. Além disso, a aplicação de auxina sintética-como composto benzothiazole-2-oxyacetic ácido (BTOA) atrasou a regulação de genes que promovem enzimas da antocianina biossíntese como chalcone sintase e UDP-glicose:flavonoid 3-O-glucosyltransferase em bagas de uva (Davies et al., 1997).,foram notificados tratamentos pré e pós – colheita com salicilatos, incluindo SA e seus derivados ASA e MeSA, para regular a acumulação de compostos bioactivos, conduzindo a uma melhor actividade antioxidante em frutos climatéricos e não climatéricos. Sabe-se que vários frutos, como a ameixa, a cereja e os damascos, têm uma vida curta, com uma rápida deterioração da qualidade após a colheita. Portanto, há uma busca constante de tratamentos que melhoram e mantêm a qualidade da fruta, e especialmente o conteúdo de compostos bioativos com efeitos benéficos para a saúde., Os tratamentos de ameixas com SA, ASA e MeSA resultaram em teores significativamente mais elevados de ácido ascórbico, antocianinas e compostos fenólicos, tanto na colheita como após armazenamento prolongado a frio (40 dias a 4°C; Martínez-Esplá et al., 2017). Resultados semelhantes podem ser observados em tratamentos pré-colheita com SA, ASA e MeSA em cerejas doces (Giménez et al., 2014, 2015, 2017). Além disso, o tratamento pós-colheita com SA, ASA ou MeSA manteve o conteúdo fenólico total, bem como o conteúdo de antocianina durante a armazenagem a frio na romã (Sayyari et al., 2011), sweet cherry (Valero et al.,, 2011), cornelian cherry (Dokhanieh et al., 2013), e damasco (Wang et al., 2015). Estes resultados sugerem que os salicilatos podem estar envolvidos na ativação da fenilalanina amônia liase, que é a principal enzima envolvida na Via biossintética dos compostos fenólicos (Martínez-Esplá et al., 2017).recentemente, a melatonina demonstrou regular o amadurecimento dos frutos e modular os compostos bioactivos. Os tratamentos pós-colheita com melatonina em frutos de pêssego aumentaram a tolerância à refrigeração activando sistemas antioxidantes., A lesão por refrigeração ocorre em frutos de pêssego durante a armazenagem a baixa temperatura (entre 2 e 7,6°c) caracterizada por acastanhamento da polpa, maturação anormal e maior sensibilidade ao decaimento (Lurie e Crisosto, 2005). Cao et al. (2018) informou que os pêssegos tratados com melatonina apresentaram maior transcrição abundância de ácido ascórbico a biossíntese de genes PpGME, PpGPP, e PpGLDH em sétimo e PpGMPH no 21º e o 28º dia de armazenamento comparados ao grupo de controle, resultando em aumento de ácido ascórbico conteúdo., Além disso, a melatonina induziu aumentos nas atividades de G6PDH, SKDH e PAL, que são as enzimas essenciais para a biossíntese de compostos fenólicos. Os autores sugerem que o tratamento com melatonina protege até certo ponto os frutos de pêssego de lesões por refrigeração, activando especificamente a biossíntese dos compostos fenólicos (Gao et al., 2018). Além disso, uma análise diferencial Proteómica livre de rótulos revelou o efeito da melatonina na promoção da maturação de frutos e da acumulação de antocianina após a colheita em frutos de tomate (Sun et al., 2016)., Os autores relataram que a melatonina exógena aumento de oito enzimas relacionadas com a antocianina caminho, incluindo, inter alia, flavonol-3-hydroxylase, flavanone 3 beta-hydroxylase, anthocyanidin sintase/leucoanthocyanidin dioxygenase, e anthocyanidin 3-O-glucosyltransferase. Além disso, o tratamento pós-colheita com melatonina aumentou os fenóis totais e as antocianinas em frutos de morango (Aghdam e Fard, 2016) e atrasou a perda de fenóis totais, flavonóides e antocianinas em frutos de lichias (Zhang et al., 2018)., Os tratamentos com melatonina aumentaram o conteúdo de fenóis, antocianinas e flavonóides em bagas de uva (Xu et al., 2017). Adicionalmente, tem sido relatado que a melatonina aumenta a acumulação de licopeno e a produção de etileno em tomates, sugerindo que a melatonina pode aumentar o conteúdo de licopeno, impactando a biossíntese de etileno e sinalizando (Sun et al., 2015)., A participação do etileno na regulação induzida pela melatonina dos compostos bioactivos foi também observada em bagas de uva, onde o tratamento em duplo Bloco do etileno revelou efeitos reduzidos da melatonina no conteúdo de polifenol (Xu et al., 2017).
conclusão
conclui-se que as fitohormonas derivadas do corismato, incluindo a auxina, a SA e a melatonina, não só partilham um precursor comum como desempenham papéis essenciais na regulação do crescimento e maturação dos frutos., Uma conversa metabólica e funcional entre eles e com outras fitohormonas ocorre de uma maneira espaciotemporal para regulamentar finamente o desenvolvimento de frutos climatéricos e não-climatéricos. As diferenças nas dinâmicas dentro dos frutos climatéricos e não climatéricos evidenciam que a resposta dos hormônios derivados do corismato não é universal, mas sim fortemente específica da espécie. Além disso, fitohormonas derivadas do corismato também modulam a acumulação de compostos bioativos, influenciando assim a qualidade dos frutos., Mais pesquisa é, no entanto, necessária para compreender melhor como (i) de outros hormônios, tais como eteno e ABA, modulam a sua biossíntese de estudar chave metabólica de separação de pontos, (ii) eles interagem no funcional e molecular níveis, e (iii) que, conjuntamente, modulam a biossíntese de compostos bioativos e, consequentemente, influenciar não apenas fruto de crescimento e amadurecimento, mas também a qualidade do climatério e a fruta não climatérica.
contribuições do autor
SM-B concebeu e projetou a revisão com a ajuda de MP-L. MP-L, PM, MM, e SM-B escreveu o manuscrito., MP-L preparou figuras com a ajuda de PM. Todos os autores contribuíram para a discussão de ideias, revisaram e aprovaram o manuscrito final.
financiamento
Este trabalho foi financiado por um prêmio ICREA Academia dada a SM-B pelo governo catalão.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Böttcher, C., Boss, P. K., and Davies, C. (2011)., As preferências do substrato de acil de uma IAA-amido sintetase explicam as variações na maturação de bagas de Vitis vinifera L. causadas por diferentes compostos auxínicos, indicando a importância da conjugação de auxina no desenvolvimento das plantas. J. Exp. ROBO. 62, 4267–4280. doi: 10.1093/jxb/err134
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Glowacz, M., projeto de lei, M., Tinyane, P. P., e Sivakumar, D. (2017)., Manter a qualidade pós-colheita dos abacates “Hass” armazenados a frio, alterando o teor de ácidos gordos e a composição com a utilização de compostos voláteis naturais – jasmonato de metilo e salicilato de metilo. J. Sci. Alimento. Agric. 97, 5186–5193. doi: 10.1002/jsfa.8400
PubMed Abstract | CrossRef Full Text | Google Scholar
Zeng, W., and He, S. Y. (2010). A prominent role of the flagellin receptor FLAGELLIN-SENSING2 in mediating stomatal response to Pseudomonas syringae pv tomato DC3000 in Arabidopsis. Plant Physiol. 153, 1188–1198. doi: 10.1104 / pp. 110.,157016
PubMed Abstract | CrossRef Full Text | Google Scholar















