química para não-majores (Português)
objectivos de aprendizagem
- descrevem moléculas cujas formas são influenciadas pela teoria de VSEPR.Define par solitário.
- descreve como pares de elétrons isolados influenciam a geometria molecular.como funciona um electroscópio?
um electroscópio é um dispositivo usado para estudar carga. Quando um objeto carregado positivamente (a haste) se aproxima do poste superior, os elétrons fluem para o topo do jarro deixando as duas folhas de ouro carregadas postivley., As folhas repelem-se uma à outra, já que ambas são posturas, como cargas. A teoria VSEPR diz que os pares de elétrons, também um conjunto de cargas semelhantes, se repelirão de tal forma que a forma da molécula se ajustará de modo que os pares de elétrons de Valência fiquem tão distantes um do outro quanto possível.

Átomo Central com Nenhum Solitário Pares
para que possa facilmente entender os tipos de moléculas possível, usaremos um sistema simples para identificar as partes de qualquer molécula.,
a = átomo central numa molécula
b = átomos que circundam o átomo central
ubscritos depois de O B indicar o número de átomos B que estão ligados ao átomo central A. Por exemplo, AB 4 é uma molécula com um átomo central rodeado por quatro átomos covalentemente ligados. Mais uma vez, não importa se essas ligações são simples, duplas ou triplas.
AB2: hidreto de berílio (BeH2)
hidreto de berílio consiste num átomo central de berílio com duas ligações únicas aos átomos de hidrogénio. Lembre-se que viola a regra dos octetos.,
H-Be-H
de acordo com a exigência de que os pares de elétrons maximizem a sua distância um do outro, os dois pares de ligações nas moléculas BeH 2 irão se organizar em lados opostos do átomo Be central. A geometria resultante é uma molécula linear, mostrada na Figura 1 em um modelo de “bola e vara”.

a Figura 1. Modelo de hidreto de berílio.
o ângulo de ligação de H-Be-H é 180° devido à sua geometria linear.,o dióxido de carbono é outro exemplo de uma molécula que se insere na categoria AB 2. Sua estrutura de Lewis consiste de ligações duplas entre o carbono central e os átomos de oxigênio (ver Figura 2).

Figura 2. Ligação de dióxido de carbono.
a repulsão entre os dois grupos de quatro electrões (dois pares) não é diferente da repulsão dos dois grupos de dois electrões (um par) na molécula de BeH 2. O dióxido de carbono é também linear (ver Figura 3).,

a Figura 3. Dioxido.
AB3: Trifluoreto de boro (BF3)
trifluoreto de boro consiste num átomo de boro central com três ligações únicas aos átomos de flúor (ver Figura 4). O átomo de boro também tem um octeto incompleto.
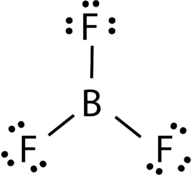
Figura 4. Ligação de trifluoreto de boro.
a geometria da molécula BF 3 é chamada de plano trigonal (ver Figura 5). Os átomos de flúor são posicionados nos vértices de um triângulo equilátero., O ângulo F-B-F é de 120° e todos os quatro átomos estão no mesmo plano.

Figura 5. Modelo de trifluoreto de boro.
AB4: metano (CH4)
metano é um composto orgânico que é o principal componente do gás natural. A sua estrutura consiste num átomo de carbono central com quatro ligações únicas aos átomos de hidrogénio (ver Figura 6). A fim de maximizar a sua distância um do outro, os quatro grupos de elétrons de ligação não se encontram no mesmo plano., Em vez disso, cada um dos átomos de hidrogênio está nos cantos de uma forma geométrica chamada tetraedro. O átomo de carbono está no centro do tetraedro. Cada face de um tetraedro é um triângulo equilátero.

Figura 6. Estrutura tetraédrica do metano.
a geometria molecular da molécula de metano é tetraédrica (ver Figura 7). Os ângulos de ligação H-C-H são 109,5°, que é maior do que os 90° que seriam se a molécula fosse planar., Ao desenhar uma fórmula estrutural para uma molécula como o metano, é vantajoso ser capaz de indicar o caráter tridimensional de sua forma. A fórmula estrutural abaixo é chamada de desenho de perspectiva. A ligação de linha pontilhada deve ser visualizada como recuando para a página, enquanto a ligação de triângulo sólido deve ser visualizada como saindo da página.

a Figura 7. Modelo de perspectiva do metano.como é que todas estas roupas se encaixam num espaço tão pequeno?,
quando viajamos, muitas vezes levamos muito mais coisas do que precisamos. Tentar encaixar tudo numa mala pode ser um verdadeiro desafio. Podemos ter de voltar a empacotar ou apertar tudo. Átomos muitas vezes têm que reorganizar onde os elétrons estão, a fim de criar uma estrutura mais estável.

Átomo Central com Um ou Mais Solitário Pares
As geometrias moleculares de moléculas de mudar quando o átomo central tem um ou mais solitário pares de elétrons., O número total de pares de elétrons, ambos pares de ligações e pares solitários, leva ao que é chamado de geometria do domínio dos elétrons. Quando um ou mais pares de ligações de elétrons são substituídos por um par solitário, a geometria molecular (forma real) da molécula é alterada. De acordo com os símbolos A E B estabelecidos na seção anterior, usaremos E para representar um par solitário no átomo central (A). Um subscrito será usado quando houver mais de um par solitário. Pares solitários nos átomos circundantes (B) não afectam a geometria.,
AB3E: amoníaco, NH3
a molécula de amoníaco contém três ligações únicas e um par solitário no átomo central de azoto (ver Figura 8).

Figura 8. Pares solitários de electrões em amónia.
a geometria do domínio para uma molécula com quatro pares de elétrons é tetraédrica, como foi visto com CH 4 . Na molécula de amônia, um dos pares de elétrons é um par solitário ao invés de um par de ligação. A geometria molecular de NH 3 é chamada de piramidal trigonal (ver Figura 9).,

Figura 9. Molécula de amoníaco.
recordar que o ângulo de ligação na molécula tetraédrica CH 4 é 109,5°. Novamente, a substituição de um dos pares de elétrons ligados por um par solitário comprime o ângulo ligeiramente. O ângulo H-N-H é de aproximadamente 107°.
AB2E2: água, H2O
uma molécula de água consiste em dois pares de ligações e dois pares isolados (ver Figura 10).

Figura 10. Pares solitários de electrões na água.,
como para metano e amônia, a geometria do domínio para uma molécula com quatro pares de elétrons é tetraédrica. Na molécula de água, dois dos pares de elétrons são pares solitários ao invés de pares de ligações. A geometria molecular da molécula de água é dobrada. O ângulo de ligação H-O-H é de 104,5°, menor que o ângulo de ligação em NH3 (ver Figura 11).

Figura 11. Molécula de água.,
AB4E: Tetrafluoreto de enxofre, SF4
a estrutura de Lewis para SF 4 contém quatro ligações únicas e um par único no átomo de enxofre (ver Figura 12).

Figura 12. Pares solitários de electrões no SF4.
o átomo de enxofre tem cinco grupos electrões à sua volta, o que corresponde à geometria do domínio bipiramidal trigonal, como no PCl 5 (ver Figura 13). Lembre-se que a geometria bipiramidal trigonal tem três átomos equatoriais e dois átomos axiais ligados ao átomo central., Por causa da maior repulsão de um par solitário, é um dos átomos equatoriais que são substituídos por um par solitário. A geometria da molécula é chamada de tetraedro distorcido ou seesaw.

Figura 13. Modelo de bola e vara para SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,a presença de elétrons de par solitário influencia a forma tridimensional da molécula.
prática
átomo Central sem pares solitários
Use a ligação abaixo para responder às seguintes perguntas:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Qual é a forma de PF 5 ?que ângulos de C-H de C-H para o metano se a molécula fosse planar?que molécula tem a configuração de um octaedro?,
átomo Central com um ou mais pares solitários
Use a ligação abaixo para responder às seguintes questões:
- Qual é o princípio geral para lidar com moléculas que contêm mais de quatro pares de electrões?
- na imagem com cinco pares de elétrons em torno do átomo central, por que o arranjo à direita é preferido?
- na imagem com seis pares de elétrons, por que a configuração com os pares solitários a 180 ° é mais estável um para o outro?,
revisão
átomo Central sem pares solitários
- Quais são os ângulos de ligação no dióxido de carbono?que molécula tem ângulos de ligação de 109,5 ° ?
- Qual é a geometria da molécula BF 3?
átomo Central com um ou mais pares solitários
- Porque é que a água tem uma geometria curvada?porque é que o amoníaco não é uma molécula planar?como escreveríamos a configuração do tetrafluoreto de xenônio usando o sistema ABE?















