17.3: Acid-Base indikatorer
lärandemål
- förklara funktionen och färgförändringarna av Acid-base indikatorer
- visa hur man väljer rätt indikator för ett titreringsexperiment
- Bestäm de sura dissociationskonstanterna Ka eller Kai av indikatorer.
vissa organiska ämnen ändrar färg i utspädd lösning när hydroniumjonkoncentrationen når ett visst värde., Till exempel är fenolftalein en färglös substans i någon vattenlösning med en hydroniumjonkoncentration större än 5,0 × 10-9 m (pH < 8,3). I mer grundläggande lösningar där hydroniumjonkoncentrationen är mindre än 5,0 × 10-9 m (pH > 8,3) är den röd eller rosa. Ämnen som fenolftalein, som kan användas för att bestämma lösningens pH, kallas syrabasindikatorer. Syrabasindikatorer är antingen svaga organiska syror eller svaga organiska baser.,
jämvikten i en lösning av syrabasindikatorn metylorange, en svag syra, kan representeras av en ekvation där vi använder HIn som en enkel representation för den komplexa metylorangemolekylen:
\
\}{}}=4.0×10^{-4}\]
anionen av metylorange, In−, är gul, och den noniserade formen, HIn, är röd. När vi tillsätter syra till en lösning av metylorange skiftar den ökade hydroniumjonkoncentrationen jämvikten mot den noniserade röda formen, i enlighet med Le Chateliers princip. Om vi lägger till bas skiftar vi jämvikten mot den gula formen., Detta beteende är helt analogt med buffertens verkan.
en indikators färg är det synliga resultatet av förhållandet mellan koncentrationerna av de två arterna i− och HIn. Om det mesta av indikatorn (typiskt ca 60-90% eller mer) är närvarande som i−, så ser vi In− jonens färg, som skulle vara gul för metylorange. Om de flesta är närvarande som HIn ser vi HIn-molekylens Färg: Röd för metylorange., För metylorange kan vi omorganisera ekvationen för Ka och skriva:
\}{}=\dfrac{}{}=\dfrac{\mathit{k}_a} {}\]
\} {\mathit{k} _a}=\dfrac {} {}}\]
\} {\mathit{k} _a}\right)=logga\vänster(\dfrac {} {}\right)}\]
\)-log(\mathit{k} _a)=-log\left(\dfrac {} {}\right)}\]
\} {}\right)}\]
\} {}\right)\:eller\:Ph=p\mathit{k} _a+log\left(\dfrac {} {}\right)}\]
den sista formeln är densamma som Henderson-Hasselbalch ekvation, som kan användas för att beskriva jämvikten av indikatorer.,
När har samma numeriska värde som Ka, är förhållandet mellan till lika med 1, vilket innebär att 50% av indikatorn är närvarande i den röda formen (HIn) och 50% är i den gula jonformen (i−), och lösningen visas orange i färg. När hydroniumjonkoncentrationen ökar till 8 × 10-4 m (ett pH av 3.1) blir lösningen röd. Ingen färgförändring är synlig för någon ytterligare ökning av hydroniumjonkoncentrationen (minskning av pH). Vid en hydroniumjonkoncentration av 4 × 10-5 m (ett pH av 4.,4), det mesta av indikatorn är i den gula jonformen, och en ytterligare minskning av hydroniumjonkoncentrationen (ökning av pH) ger inte en synlig färgförändring. PH-intervallet mellan 3.1 (röd) och 4.4 (gul) är färgbytesintervallet för metylorange; den uttalade färgförändringen sker mellan dessa pH-värden.
många olika ämnen kan användas som indikatorer, beroende på vilken reaktion som ska övervakas., Till exempel innehåller rödkål juice en blandning av färgade ämnen som ändras från djupröd vid lågt pH till ljusblå vid mellanliggande pH till gult vid högt pH (figur \(\PageIndex{1}\)). I alla fall måste dock en bra indikator ha följande egenskaper:
- färgförändringen måste lätt upptäckas.
- färgförändringen måste vara snabb.
- indikatormolekylen får inte reagera när ämnet titreras.
- för att minimera fel bör indikatorn ha en pKin som ligger inom en pH-enhet av det förväntade pH-värdet vid titreringens ekvivalenspunkt.,

rödkål juice innehåller en blandning av ämnen vars färg beror på pH. varje provrör innehåller en lösning av rödkål juice i vatten, men pH av lösningarna varierar från pH = 2,0 (längst till vänster) till pH = 11,0 (längst till höger). Vid pH = 7.0 är lösningen blå.,
syntetiska indikatorer har utvecklats som uppfyller dessa kriterier och täcker praktiskt taget hela pH-intervallet. Figur \(\PageIndex{2}\) visar det ungefärliga pH-intervallet över vilket vissa vanliga indikatorer ändrar färg och deras färgförändring. Dessutom är vissa indikatorer (såsom tymol blå) polyprotiska syror eller baser, som ändrar färg två gånger vid brett separerade pH-värden.
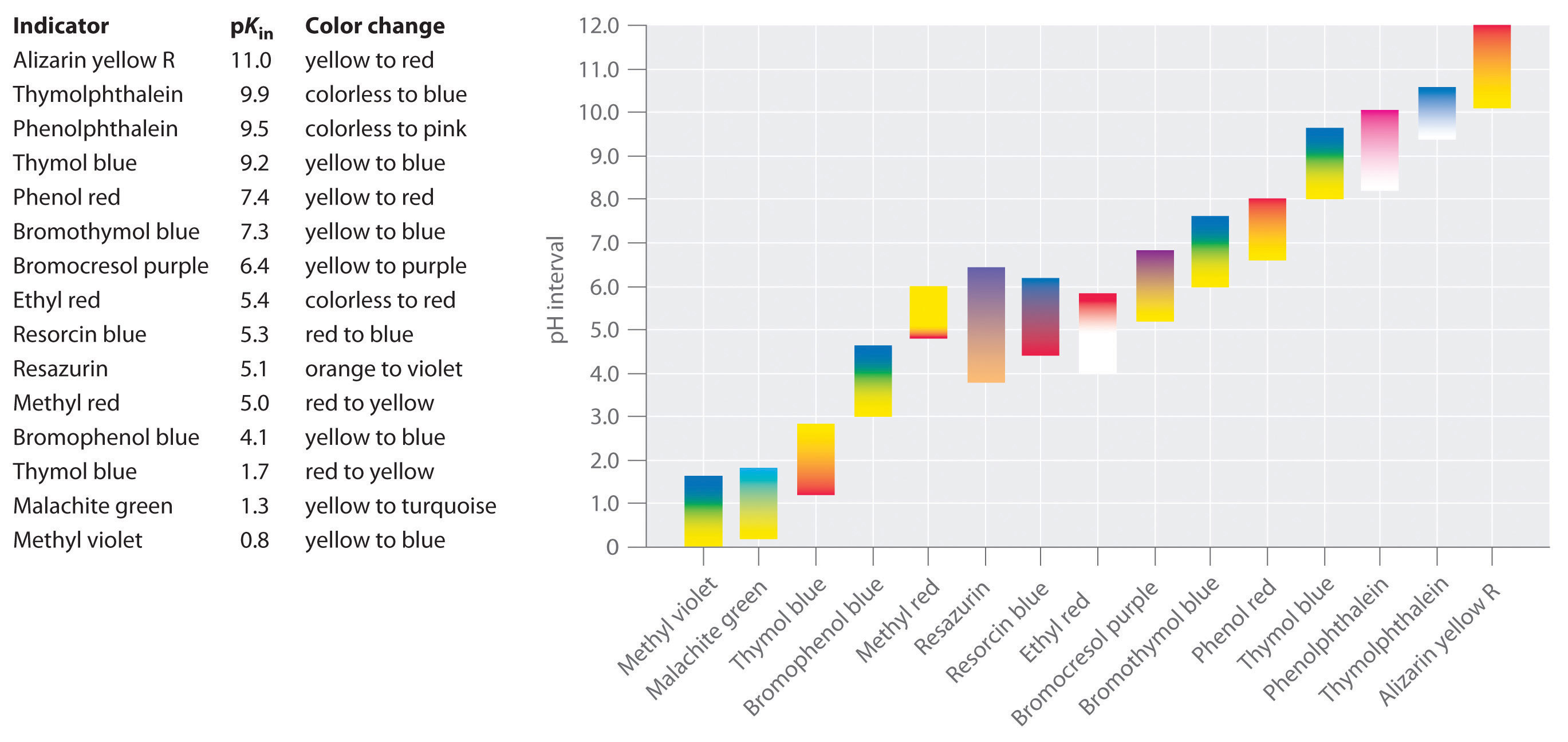
det är viktigt att vara medveten om att en indikator inte ändrar färg plötsligt vid ett visst pH-värde; istället genomgår den faktiskt en pH-titrering precis som någon annan syra eller bas. När koncentrationen av HIn minskar och koncentrationen av In− ökar, förändras lösningens färg långsamt från Hins karakteristiska färg till In−. Som vi kommer att se i avsnitt 16 ändras förhållandet från 0.,1 vid ett pH en enhet under pKin till 10 vid ett pH en enhet ovanför pKin. Således ändrar de flesta indikatorer färg över ett pH-intervall på cirka två pH-enheter.
Vi har sagt att en bra indikator ska ha ett pKin-värde som ligger nära det förväntade pH-värdet vid ekvivalenspunkten. För en stark syra–stark bastitrering är valet av indikatorn inte särskilt kritiskt på grund av den mycket stora förändringen i pH som uppstår runt ekvivalenspunkten., Däremot kan felindikatorn för en titrering av en svag syra eller en svag bas resultera i relativt stora fel, vilket illustreras i Figur \(\PageIndex{3}\). Denna siffra visar tomter av pH kontra volym bas tillsätts för titrering av 50,0 mL av en 0,100 M lösning av en stark syra (HCl) och en svag syra (ättiksyra) med 0,100 m \(NaOH\). PH varierar över vilka två vanliga indikatorer(metylröd, \(pK_{in} = 5.0\) och fenolftalein, \(pK_{in} = 9.5\)) ändra färg visas också., De horisontella staplarna anger pH-intervallen över vilka båda indikatorerna ändrar färg över HCL-titreringskurvan, där den är nästan vertikal. Därför ändrar båda indikatorerna färg när väsentligen samma volym av \(NaOH\) har tillsatts (ca 50 mL), vilket motsvarar ekvivalenspunkten. Däremot kommer titreringen av ättiksyra att ge mycket olika resultat beroende på om metylröd eller fenolftalein används som indikator., Även om pH-intervallet över vilket fenolftalein ändrar färg är något större än pH vid ekvivalenspunkten för den starka syratitreringen, kommer felet att vara försumbar på grund av lutningen på denna del av titreringskurvan. Precis som med HCl-titreringen blir fenolftaleinindikatorn rosa när ca 50 mL \(NaOH\) har tillsatts ättiksyralösningen. Däremot börjar metylrött att förändras från rött till gult runt pH 5, vilket ligger nära mittpunkten för ättiksyratitreringen, inte ekvivalenspunkten., Att lägga till endast ca 25-30 mL \(NaOH\) kommer därför att orsaka att den metylröda indikatorn ändrar färg, vilket resulterar i ett stort fel.
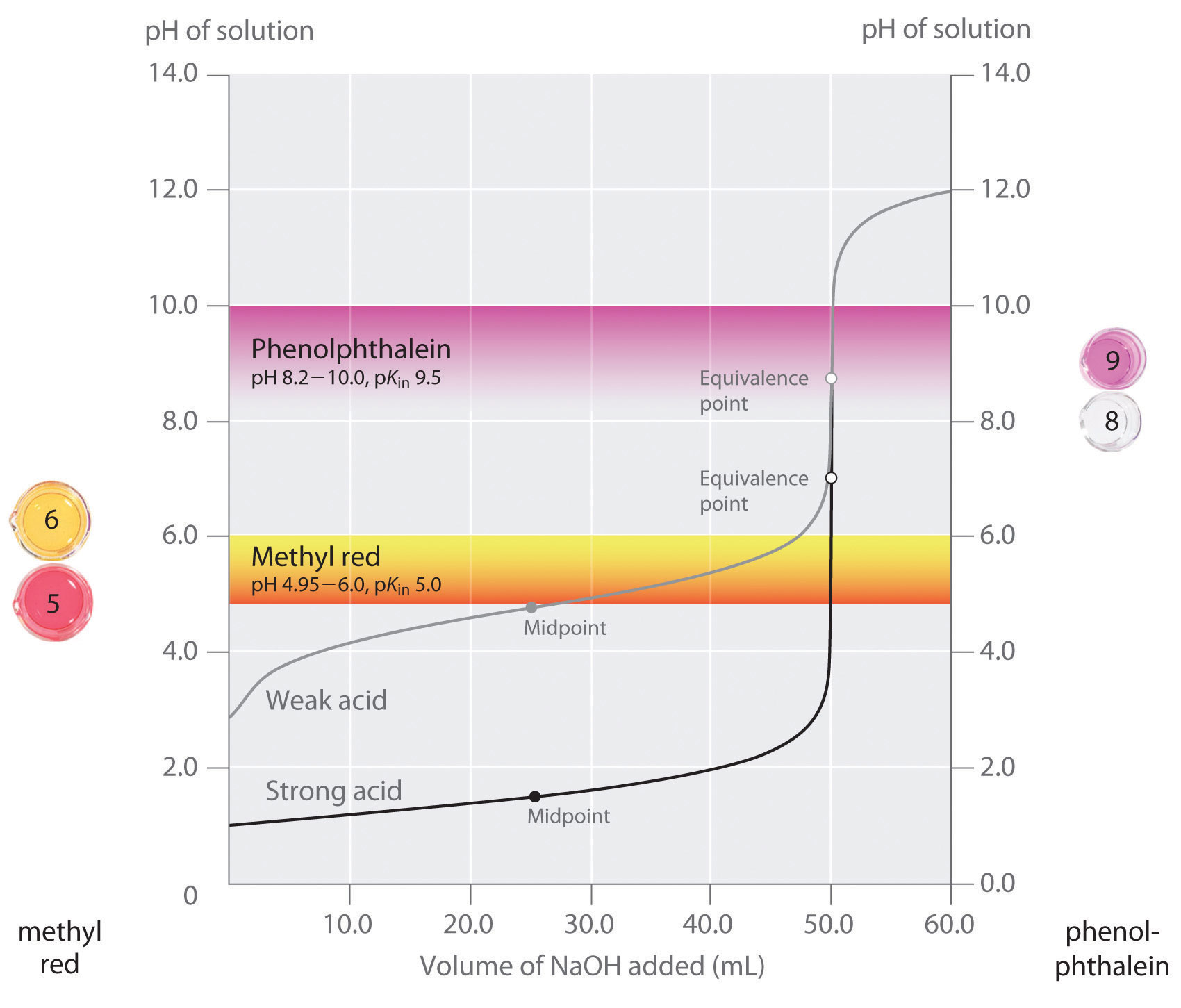
diagrammet visar de resultat som erhållits med hjälp av två indikatorer (metylrött och fenolftalein) för titrering av 0,100 m lösningar av en stark syra (HCl) och en svag syra (ättiksyra) med 0,100 m \(NaOH\)., På grund av brantheten hos titreringskurvan för en stark syra runt ekvivalenspunkten, kommer endera indikatorn snabbt att ändra färg vid ekvivalenspunkten för titreringen av den starka syran. Däremot är pKin för metylrött (5,0) mycket nära PKA av ättiksyra (4,76); mittpunkten för färgförändringen för metylrött sker nära mitten av titreringen, snarare än vid ekvivalenspunkten.
i allmänhet, för titreringar av starka syror med starka baser (och vice versa), kommer någon indikator med en pK mellan ca 4.0 och 10.0 att göra., För titrering av en svag syra är emellertid pH vid ekvivalenspunkten större än 7.0, så en indikator som fenolftalein eller tymolblå, med pKin > 7.0, bör användas. Omvänt, för titrering av en svag bas, där pH vid ekvivalenspunkten är mindre än 7,0, bör en indikator som metylröd eller bromkresolblå, med pKin < 7,0, användas.
exempel \(\Pageindex{1}\)
i titreringen av en svag syra med en stark bas, vilken indikator skulle vara det bästa valet?,
- metylorange
- Bromkresolgrön
- fenolftalein
lösning
det rätta svaret är C. Vid titrering av en svag syra med en stark bas kommer den konjugerade basen av den svaga syran att göra pH vid ekvivalenspunkten större än 7. Därför vill du ha en indikator för att ändra i det pH-området. Både metylorange och bromkresolgrön ändrar färg i ett surt pH-intervall, medan fenolftalein förändras i ett grundläggande pH.,
förekomsten av många olika indikatorer med olika färger och pKin-värden ger också ett bekvämt sätt att uppskatta pH hos en lösning utan att använda en dyr elektronisk pH-mätare och en ömtålig pH-elektrod. Papper eller plastremsor impregnerade med kombinationer av indikatorer används som ”pH-papper”, vilket gör att du kan uppskatta pH-värdet för en lösning genom att helt enkelt doppa en bit pH-papper i den och jämföra den resulterande färgen med standarderna som skrivs ut på behållaren (figur \(\PageIndex{4}\)).,
sammanfattning
Syrabasindikatorer är föreningar som ändrar färg vid ett visst pH., De är typiskt svaga syror eller baser vars färgförändringar motsvarar deprotonation eller protonation av indikatorn själv.
bidragsgivare och Attributioner
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) och Richard Langley (Stephen F. Austin State University) med bidragande författare. Läroboksinnehåll som produceras av OpenStax College är licensierat under en Creative Commons Attribution License 4.0-licens. Ladda ner gratis på http://cnx.org/contents/85abf193-2bd…[email protected]).
- {Mall.,ContribBoundless()}}















