kemi för icke-majorer
inlärningsmål
- beskriver molekyler vars former påverkas av VSEPR-teorin.
- definiera lone pair.
- Beskriv hur lone pair elektroner påverkar molekylär geometri.
hur fungerar ett elektroskop?
ett elektroskop är en enhet som används för att studera laddning. När ett positivt laddat objekt (stången) närmar sig övre stolpen, strömmar elektroner till toppen av burken och lämnar de två guldbladen postivley laddade., Bladen stöter bort varandra eftersom båda håller postive, som avgifter. VSEPR-teorin säger att elektronpar, även en uppsättning liknande laddningar, kommer att avvisa varandra så att molekylens form kommer att justera så att valenselektronparen stannar så långt ifrån varandra som möjligt.

Central Atom utan ensamma par
för att enkelt förstå vilka typer av molekyler som är möjliga använder vi ett enkelt system för att identifiera delarna av en molekyl.,
a = central atom i en molekyl
b = atomer som omger den centrala atomen
Subscripts efter B kommer att beteckna antalet B-atomer som är bundna till den centrala a-atomen. Till exempel är AB 4 en molekyl med en central atom omgiven av fyra kovalent bundna atomer. Återigen spelar det ingen roll om dessa obligationer är enkel -, dubbel-eller trippelobligationer.
AB2: Berylliumhydrid (BeH2)
Berylliumhydrid består av en central berylliumatom med två enkelbindningar till väteatomer. Minns att det bryter mot oktettregeln.,
H-Be-h
enligt kravet att elektronpar maximerar sitt avstånd från varandra, kommer de två bindningsparen i BeH 2-molekylerna att ordna sig på direkt motsatta sidor av central be atom. Den resulterande geometrin är en linjär molekyl, som visas i Figur 1 i en ”boll och pinne” – modell.

Figur 1. Beryllium hydrid modell.
bindningsvinkeln från H-Be-h är 180° på grund av dess linjära geometri.,
koldioxid är ett annat exempel på en molekyl som tillhör kategorin AB 2. Dess Lewis struktur består av dubbelbindningar mellan det centrala kolet och syreatomerna (se Figur 2).

Figur 2. Koldioxidbindning.
repulsionen mellan de två grupperna av fyra elektroner (två par) är inte annorlunda än repulsionen av de två grupperna av två elektroner (ett par) i BeH 2-molekylen. Koldioxid är också linjär (se Figur 3).,

Figur 3. Koldioxid.
AB3: Bortrifluorid (BF3)
Bortrifluorid består av en central boratom med tre enkelbindningar till fluoratomer (se Figur 4). Boratomen har också en ofullständig oktett.
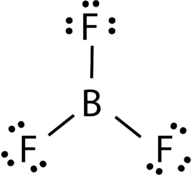
Figur 4. Bortrifluoridbindning.
geometrin för BF 3-molekylen kallas trigonal plana (se Figur 5). Fluoratomerna är placerade vid hörnen av en liksidig triangel., F-b-f-vinkeln är 120 ° och alla fyra atomerna ligger i samma plan.

Figur 5. Bor trifluoridmodell.
AB4: metan (CH4)
metan är en organisk förening som är den primära komponenten i naturgas. Dess struktur består av en central kolatom med fyra enkelbindningar till väteatomer (se Figur 6). För att maximera deras avstånd från varandra ligger de fyra grupperna av bindningselektroner inte i samma plan., I stället ligger var och en av väteatomerna i hörnen av en geometrisk form som kallas en tetraeder. Kolatomen ligger i mitten av tetraedern. Varje ansikte av en tetraeder är en liksidig triangel.

Figur 6. Tetrahedral struktur av metan.
metanmolekylens molekylära geometri är tetraedrisk (se Figur 7). H-c-h-bindningsvinklarna är 109,5°, vilket är större än 90° som de skulle vara om molekylen var plan., Vid ritning av en strukturell formel för en molekyl som metan är det fördelaktigt att kunna indikera den tredimensionella karaktären hos dess form. Den strukturella formeln nedan kallas en perspektivritning. Den prickade linjebindningen ska visualiseras som vikande in på sidan, medan den fasta triangelbindningen ska visualiseras som att komma ut ur sidan.

Figur 7. Metan perspektiv modell.
Hur kan alla dessa kläder passa in i ett så litet utrymme?,
När vi reser tar vi ofta mycket mer saker än vi behöver. Att försöka passa allt i en resväska kan vara en riktig utmaning. Vi kan behöva packa eller bara pressa in allt. Atomer måste ofta omorganisera där elektronerna är för att skapa en mer stabil struktur.

Central Atom med ett eller flera ensamma par
molekylernas molekylära geometrier förändras när den centrala atomen har ett eller flera ensamma par elektroner., Det totala antalet elektron par, både bindning Par och ensamstående par, leder till vad som kallas elektron domän geometri. När ett eller flera av kopplingspar av elektroner ersätts med ett ensamstående par ändras molekylens molekylära geometri (faktiska form). I enlighet med A-och B-symbolerna som fastställdes i föregående avsnitt kommer vi att använda E för att representera ett ensam par på den centrala atomen (A). En prenumeration kommer att användas när det finns mer än ett ensamstående par. Lone par på de omgivande atomerna (B) påverkar inte geometrin.,
AB3E: ammoniak, NH3
ammoniakmolekylen innehåller tre enkelbindningar och ett ensamstående par på den centrala kväveatomen (se figur 8).

figur 8. Lone pair elektroner i ammoniak.
domängeometrin för en molekyl med fyra elektronpar är tetraedrisk, vilket sågs med CH 4 . I ammoniakmolekylen är ett av elektronparen ett ensam par snarare än ett bindningspar. Den molekylära geometrin hos NH 3 kallas trigonal pyramidal (se Figur 9).,

Figur 9. Ammoniakmolekyl.
minns att bindningsvinkeln i tetrahedral CH 4-molekylen är 109,5°. Återigen komprimerar ersättningen av ett av de bundna elektronparen med ett lone par vinkeln något. H-N-h-vinkeln är ungefär 107°.
AB2E2: vatten, H2o
en vattenmolekyl består av två bindningspar och två ensamma par (se Figur 10).

Figur 10. Lone pair elektroner på vatten.,
När det gäller metan och ammoniak är domängeometrin för en molekyl med fyra elektronpar tetraedriska. I vattenmolekylen är två av elektronparen ensamma par snarare än bindningspar. Vattenmolekylens molekylära geometri är böjd. H-O-h-bindningsvinkeln är 104,5°, vilket är mindre än bindningsvinkeln i NH3 (se Figur 11).

Figur 11. Vattenmolekyl.,
AB4E: Svaveltetrafluorid, SF4
Lewis-strukturen för SF 4 innehåller fyra enkelbindningar och ett ensampar på svavelatomen (se Figur 12).

Figur 12. Lone par elektroner i SF4.
svavelatomen har fem elektrongrupper runt den, vilket motsvarar trigonal bipyramiddomän geometri, som i PCl 5 (Se figur 13). Minns att den trigonala bipyramidala geometrin har tre ekvatorialatomer och två axialatomer kopplade till den centrala atomen., På grund av den större repulsionen av ett ensamstående par är det en av ekvatorialatomerna som ersätts av ett ensamstående par. Molekylens geometri kallas en förvrängd tetraeder eller gungbräda.

figur 13. Boll och stick modell för SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- närvaron av lone pair elektroner påverkar molekylens tredimensionella form.
öva
central Atom utan ensamma par
använd länken nedan för att svara på följande frågor:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- vad är formen på PF 5 ?
- vilka c-h bod-vinklar skulle vi förutsäga för metan om molekylen var plan?
- vilken molekyl har konfigurationen av en oktaedron?,
central Atom med ett eller flera ensamma par
använd länken nedan för att svara på följande frågor:
- vad är den allmänna principen för att hantera molekyler som innehåller mer än fyra elektronpar?
- i bilden med fem elektronpar runt den centrala atomen, varför är arrangemanget till höger föredraget?
- i bilden med sex elektronpar, varför är konfigurationen med de ensamma paren vid 180o till varandra stabilare?,
granska
Central Atom utan ensamma par
- vilka är bindningsvinklarna i koldioxid?
- vilken molekyl har bindningsvinklar på 109,5 ° ?
- vad är geometrin för BF 3-molekylen?
central Atom med ett eller flera ensamma par
- Varför har vatten en böjd geometri?
- Varför är ammoniak inte en plan molekyl?
- hur skulle vi skriva konfigurationen för xenontetrafluorid med ABE-systemet?















