17.3: Syre-Base Indikatorer (Norsk)
Mål
- Forklare funksjon og farge endringer av syre-base-indikatorer
- Demonstrere hvordan å velge riktig indikator for en titrering eksperiment
- Bestemme sure dissosiasjon konstanter Ka eller Kai av indikatorer.
Visse organiske stoffer, endre farge i fortynn løsningen når hydronium ion konsentrasjon når en bestemt verdi., For eksempel, phenolphthalein er en fargeløs stoff i alle vandig løsning med en hydronium ion konsentrasjon større enn 5,0 × 10-9 M (pH < 8.3). I mer grunnleggende løsninger der hydronium ion-konsentrasjon er mindre enn 5,0 × 10-9 M (pH > 8.3), det er rød eller rosa. Stoffer som phenolphthalein, som kan brukes til å bestemme pH i en løsning, som er kalt syre-base-indikatorer. Syre-base-indikatorer er enten svake organiske syrer eller svake organiske baser.,
likevekt i en løsning av syre-base-indikatoren methyl oransje, en svak syre, kan være representert ved en ligning som vi bruker HIn som en enkel representasjon for komplekse methyl oransje molekyl:
\
\}{}}=4.0×10^{-4}\]
anion av methyl orange, I−, gul, og nonionized form, HIn, er rød. Når vi legger til syre til en løsning av methyl oransje, økt hydronium ion konsentrasjon forskyver likevekten mot nonionized røde form, i samsvar med Le Chatelier ‘ s prinsipp. Hvis vi legger til base, kan vi forskyve likevekten mot den gule form., Dette er helt analogt til handling av buffere.
En indikator fargen er synlig resultat av forholdet mellom konsentrasjonene av de to artene I− og HIn. Hvis de fleste av indikatoren (vanligvis ca 60-90% eller mer) er til stede I, så får vi se fargen på I− ion, som ville bli gul for methyl oransje. Hvis de fleste er til stede som HIn, så får vi se fargen på HIn molekyl: rødt for methyl oransje., For methyl oransje, vi kan endre ligningen for Ka og skrive:
\}{}=\dfrac{}{}=\dfrac{\mathit{K}_a}{}}\]
\}{\mathit{K}_a}=\dfrac{}{}}\]
\}{\mathit{K}_a}\right)=logg\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}_a)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\eller\:pH=p\mathit{K}_a+log\left(\dfrac{}{}\right)}\]
Den siste formelen er den samme som i Henderson-Hasselbalch ligningen, som kan brukes til å beskrive likevekt av indikatorer.,
Når du har samme tallverdi som Ka, forholdet til er lik 1, noe som betyr at 50% av indikatoren er til stede i den røde form (HIn) og 50% er i den gule ionisk form (I−), og løsningen vises oransje i fargen. Når hydronium ion-konsentrasjonen øker til 8 × 10-4 M (en pH-verdi på 3.1), løsningen blir rød. Ingen endring i farge er synlig for ytterligere økning i hydronium ion-konsentrasjon (reduksjon i pH). På en hydronium ion-konsentrasjon på 4 × 10-5 M (en pH-verdi på 4.,4), de fleste av indikatoren er i den gule ionisk form, og en ytterligere nedgang i hydronium ion-konsentrasjon (økning i pH) ikke produserer en synlig farge endring. PH varierer mellom 3.1 (rød) og 4.4 (gul) er farge-endre intervallet av methyl orange; uttales farge endring finner sted mellom disse pH-verdier.
Mange forskjellige stoffer som kan brukes som indikatorer, avhengig av den enkelte reaksjon skal overvåkes., For eksempel, rød kål juice inneholder en blanding av fargede stoffer som endrer seg fra dyp rød til lave pH til lys blå ved middels pH til gul på høy pH (Figur \(\PageIndex{1}\)). I alle tilfeller, men en god indikator må ha følgende egenskaper:
- farge endringen må være lett oppdaget.
- farge endringen må være rask.
- indikatoren molekyl må ikke reagere med stoffet blir titrated.
- for Å minimere feil, indikatoren bør ha en pKin som er innenfor en pH-enhet forventet pH ved ekvivalens poenget med titrering.,

rødkål juice inneholder en blanding av stoffer som farge avhengig av pH. Hver test tube inneholder en løsning av rødkål juice i vann, men pH i løsningene varierer fra pH = 2.0 (helt til venstre) til pH = 11.0 (lengst til høyre). Ved pH = 7.0, løsningen er blå.,
Syntetiske indikatorer har blitt utviklet som oppfyller disse kriteriene og dekker praktisk talt hele pH-område. Figur \(\PageIndex{2}\) viser omtrentlig pH-område som over noen felles indikatorer endre farge og deres endring i farge. I tillegg, noen indikatorer (for eksempel thymol blå) er polyprotic syrer eller baser, som endrer farge to ganger på mye atskilt pH-verdier.
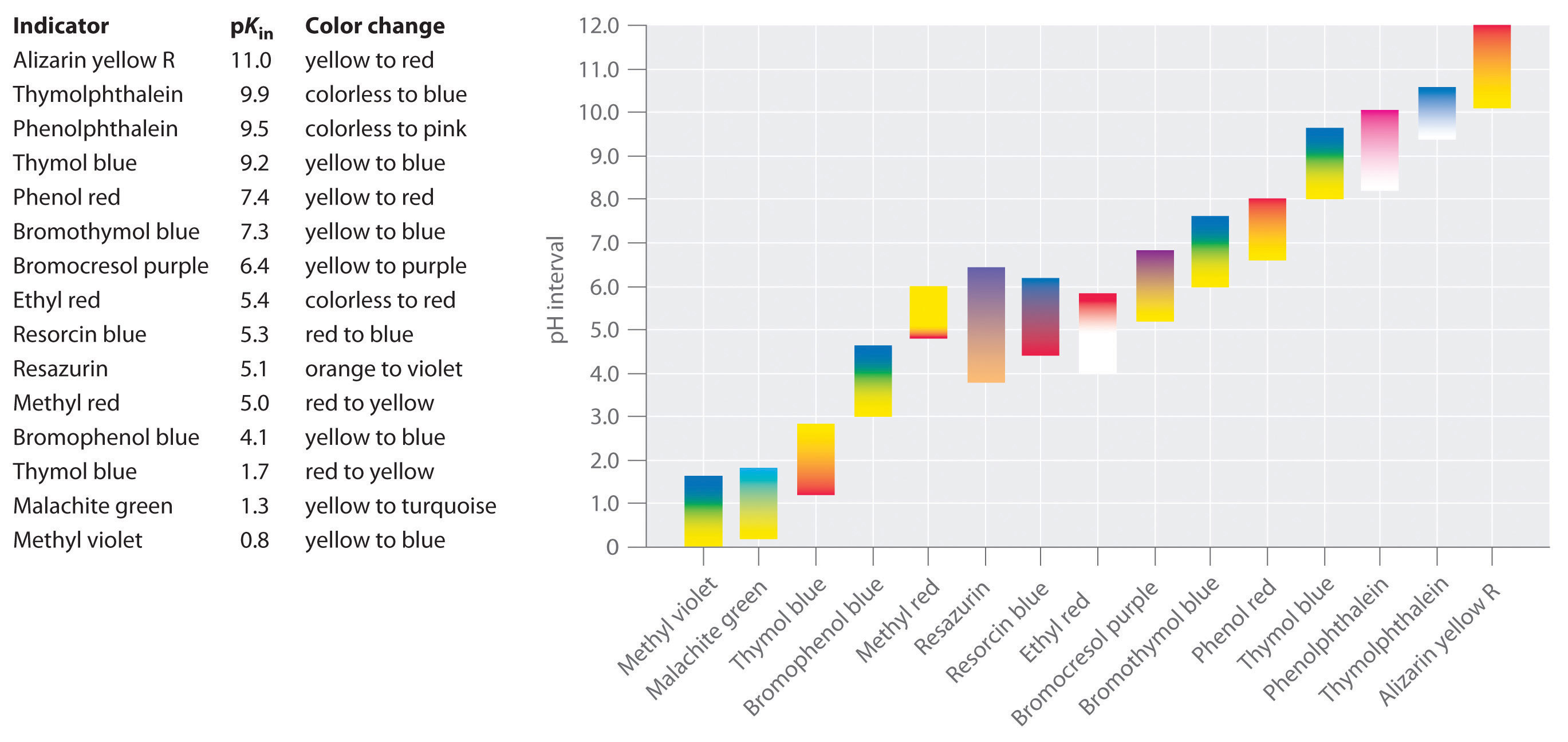
Det er viktig å være oppmerksom på at en indikator endrer ikke farge brått på en bestemt pH-verdi; i stedet, er det faktisk gjennomgår en pH-titrering akkurat som alle andre syre eller base. Som konsentrasjonen av HIn reduseres, og konsentrasjonen av I− øker, fargen av løsningen sakte endringer fra den karakteristiske fargen på HIn til at av I−. Som vi vil se i Kapittel 16, / forholdet endringer fra 0.,1 ved en pH-én enhet under pKin til 10 på en pH på én enhet over pKin. Dermed mest indikatorer endre farge over en pH-område på ca to pH-enheter.
Vi har nevnt som en god indikator bør ha en pKin verdi som er nær det forventede pH ved ekvivalens-punkt. For en sterk syre og sterk base titrering, valg av indikator er ikke spesielt kritisk på grunn av den svært store endringer i pH som oppstår rundt ekvivalens punkt., I kontrast, ved hjelp av feil-indikatoren for en titrering av en svak syre eller en svak base kan resultere i relativt store feil, som illustrert i Figur \(\PageIndex{3}\). Denne figuren viser plott av pH kontra volumet av base lagt for titrering av for 50,0 mL av en 0.100 M løsning av en sterk saltsyre (HCl) og en svak syre (eddiksyre) med 0.100 M \(NaOH\). PH varierer over som to vanlige indikatorer (methyl rød, \(pK_{i} = 5.0\), og phenolphthalein, \(pK_{i} = 9.5\)) endre fargen er også vist., De horisontale linjene viser pH varierer over som begge indikatorene endre farge krysse HCl titrering kurve, hvor det er nesten loddrett. Derfor begge indikatorene vil endre farge når hovedsak det samme volum av \(NaOH\) har blitt lagt til (ca 50 mL), noe som tilsvarer ekvivalens punkt. I kontrast, den titrering av eddiksyre vil gi svært ulike resultater avhengig av om methyl rød eller phenolphthalein er brukt som indikator., Selv om pH-område som phenolphthalein endringer fargen er litt større enn pH på likeverd poeng av sterk syre titrering, feilen vil være ubetydelig på grunn av skråningen av denne delen av titrering kurve. Akkurat som med HCl titrering, den phenolphthalein indikatoren vil slå rosa når ca 50 mL av \(NaOH\) har blitt lagt til eddiksyre løsning. I kontrast, metyl-rød begynner å skifte fra rødt til gult rundt pH 5, som er nær midtpunktet av eddiksyre titrering, ikke ekvivalens punkt., Legge til bare ca 25-30 mL av \(NaOH\) vil derfor føre til at methyl rød indikator for å endre farge, noe som resulterer i en stor feil.
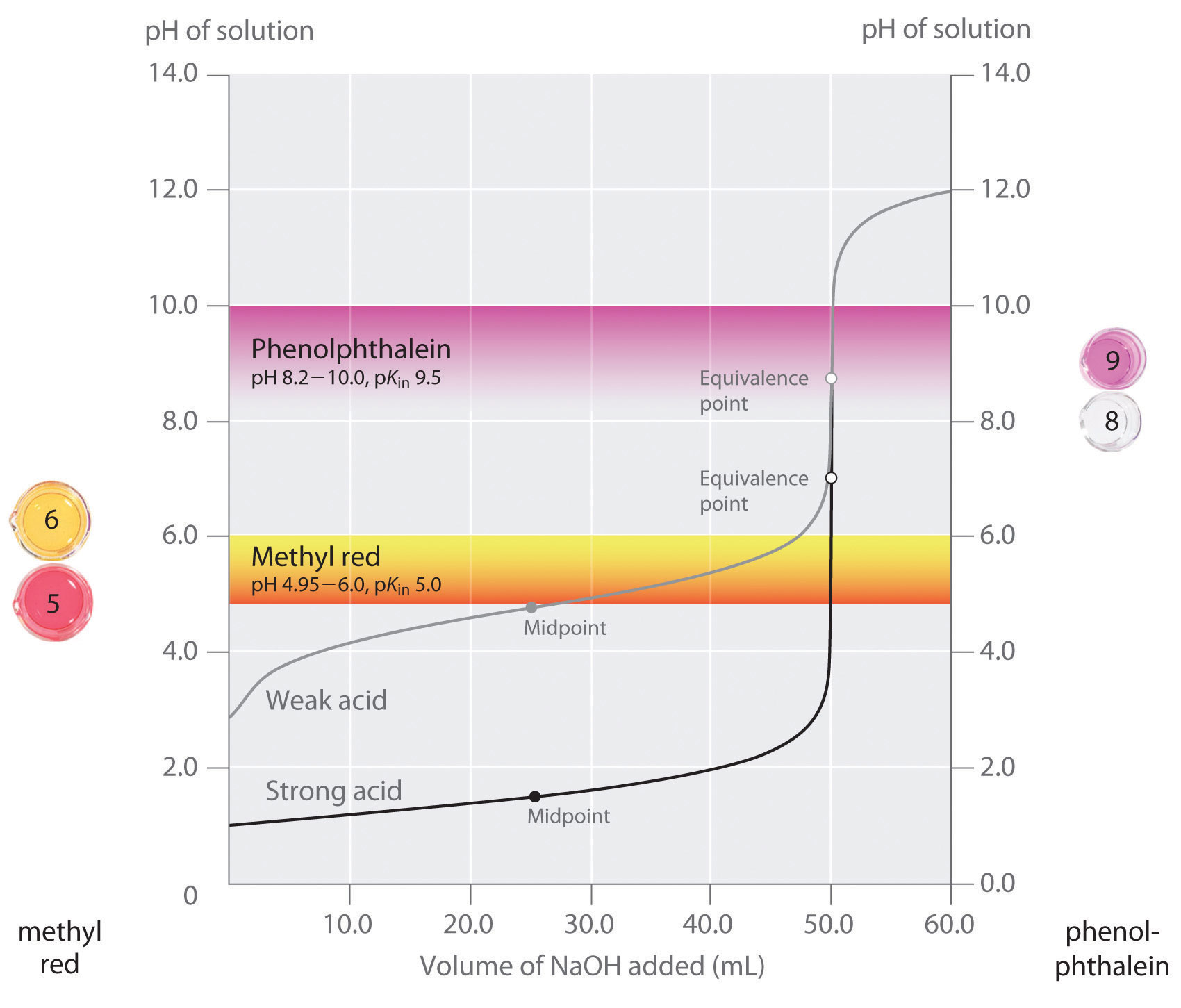
grafen viser de resultatene som er oppnådd ved hjelp av to indikatorer (methyl røde og phenolphthalein) for titrering av 0.100 M løsninger for en sterk syre (HCl) og en svak syre (eddiksyre) med 0.100 M \(NaOH\)., På grunn av den steepness av titrering kurve av en sterk syre rundt ekvivalens punkt, enten indikatoren vil raskt endre farge på likeverd punkt for titrering av sterk syre. I kontrast, den pKin for methyl rød (5.0) er svært nær pKa av eddiksyre (deles 4,76); midtpunktet av fargeendring for methyl røde oppstår nær midtpunktet av titrering, snarere enn ved ekvivalens-punkt.
generelt, for titrations av sterke syrer sterke baser (og vice versa), en indikator med en pK i mellom om 4.0 og 10.0 vil gjøre., For titrering av en svak syre, men pH-verdien i ekvivalens punkt er større enn 7.0, så en indikator som phenolphthalein eller thymol blå, med pKin > 7.0, bør brukes. Omvendt, for titrering av en svak base, hvor pH i ekvivalens punktet er mindre enn 7.0, en indikator som methyl rød eller bromocresol blå, med pKin < 7.0, bør brukes.
Eksempel \(\PageIndex{1}\)
I titrering av en svak syre med en sterk base, som indikator ville være det beste valget?,
- Methyl-Orange
- Bromocresol Grønn
- Phenolphtalein
Løsningen
Det riktige svaret er C. I titrering av en svak syre med en sterk base, konjugat base av svak syre vil gjøre pH ved ekvivalens punkt som er større enn 7. Derfor, ønsker du en indikator for endring i at pH-område. Både methyl oransje og bromocresol grønn endre farge i sure pH-område, mens phenolphtalein endringer i en grunnleggende pH.,
eksistensen av mange ulike indikatorer med ulike farger og pKin verdier gir også en praktisk måte å beregne pH i en løsning uten bruk av dyre elektroniske pH-meter og en skjør pH-elektroden. Papir eller plast strimler, impregnert med kombinasjoner av indikatorer er brukt som «pH-papir, som tillater deg å beregne pH i en løsning ved bare å dyppe en del av pH-papir inn i det og sammenligne den fargen med de standarder som er trykt på emballasjen (Figur \(\PageIndex{4}\)).,
Oppsummering
Syre–base indikatorer er forbindelser som kan endre fargen på en bestemt pH-verdi., De er vanligvis svake syrer eller baser som endringer i farge tilsvarer deprotonation eller protonation av indikatoren i seg selv.
Bidragsytere og Attribusjoner
-
Paul Blomster (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) og Richard Langley (Stephen F. Austin State University (universitet) med bidragsytere. Lærebok innhold produsert av OpenStax College er lisensiert under en Creative Commons Attribution License 4.0 lisens. Last ned gratis på http://cnx.org/contents/85abf193-2bd…[email protected]).
- {mal.,ContribBoundless()}}















