Anatomi av en Polymerase – Hvordan Funksjon og Struktur er i Slekt
Nøyaktige genom replikering er avgjørende for gjennomførbarheten av en organisme. Det generelle konseptet for kopiering av DNA var tydelig på klarlegging av DNA ‘ s double spiralformet struktur og identifisering av base par supplement (1): en strand av nucleobases kan tjene som mal for syntese av en ny strand. Innen et tiår av disse funnene, en agent ble renset fra E. coli, som catalyzed DNA-strand duplisering (2). Denne agenten ble kalt en «polymerase». E., coli DNA Polymerase I, den første DNA-polymerase oppdaget, var ikke den primære replicative polymerase, men i stedet en som er involvert i lagging strand Okazaki fragment oppløsning og DNA-reparasjon. Dette bebudet fremtidige funn av mange DNA-polymerase familier, hver servering spesifikke mobil krav for DNA replikasjon og reparasjon.
DNA Polymerases tjene som grunnleggende enzymer i life sciences for den samme grunnen til at de er kritiske i naturen: de kopiere DNA. – Polymerase-applikasjoner omfatter DNA-merking, sekvensering og amplifikasjon., En spesifikk amplifikasjon-protokollen, polymerase chain reaction (PCR) er en mye brukt teknikk som benytter thermophilic polymerases å eksponentielt forsterke bestemte DNA-segmenter (3), og muliggjør en rekke programmer fra menneskelige og patogen diagnostikk for å molekylær kloning i biologi laboratorier rundt om i verden.
– Polymerase Nøyaktighet
PCR setter de samme grunnleggende krav til en polymerase som en celle setter på sin replikasjon system. I hovedsak,det polymerase bør være pålitelig, nøyaktig og rask., – Polymerase nøyaktigheten eller «fidelity» viser til sannsynligheten for å innlemme riktig nukleotid som er angitt av malen strand. Standard PCR-enzymer er, ikke overraskende, ganske nøyaktig. Selv Thermus aquaticus (Taq) DNA-polymerase, anses som en lav fidelity PCR-polymerase, bare gjør en feil en gang i ca nukleotid innsettinger (12)., – Polymerase discovery og engineering innsats har produsert hifi polymerases, som sjelden gjør base, substitusjon feil, krever DNA-sekvensering metoder for å lese millioner av syntetisert baser for å oppdage eventuelle feil ved polymerase Fremskritt i å måle gjengivelse av enkelt-molekyl-sekvensering har identifisert 5® High-Fidelity DNA Polymerase som å ha troskap 280 X større thanTaq DNA-polymerase (12).,
Fidelity sjekkpunkter: geometriske utvalget på det aktive nettstedet og utover
DNA polymerases sikre nøyaktige replikering ved hjelp av en rekke molekylære sjekkpunkter, ved siden av nukleotid inkorporering og utover (1). I løpet av nukleotid tillegg, riktig innkommende nukleotid er posisjonert for en produktiv justering av katalytisk grupper, sikre effektiv inkorporering. Denne justeringen for katalyse er følsomme for forstyrrelser i posisjon på grunn av feil Watson-Crick base sammenkobling, slik at for kinetisk steiling på feil eller ikke-cognate base-par.,
Korrekturlesing av DNA Polymerases
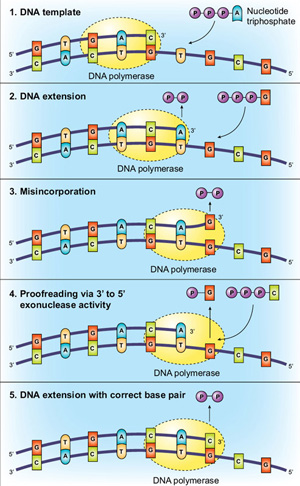
en Annen metode for å øke troskap for polymerase å ha 3→5 exonuclease aktivitet, kalt «korrektur». Ved hjelp av base-sammenkobling og aktive nettstedet molekylær sjekkpunkter som er beskrevet ovenfor, Taq DNA-polymerase er utrolig nøyaktig, men korrekturlesing enzymer kan ha enda høyere kvalitet. Denne ekstra nøyaktighet er formidlet via korrekturlesing, med polymerase «sjekke» om riktig nukleotid har blitt satt inn i malen., Hvis en feil er oppdaget DNA overføres fra polymerisering domene til en N-terminal 3→5 exonuclease domenet av polymerase. De feil som er innlemmet nukleotid er excised,DNA flytter tilbake til polymerisering domene, og kopiering kan fortsette (Figur 2).
Bacteriophage T4 viste seg å være et nyttig eksperimentelt system for å evaluere betydningen av 3→5 exonuclease aktivitet for nøyaktig DNA-replikasjon (6). Mutasjoner i T4-genet 43 (som koder DNA-polymerase) ble identifisert som enten redusert eller økt kvalitet. Ved å definere en exonuclease/polymerase (N/P) aktivitet ratio for en mutant enzym det ble funnet at polymerases med lavt N/P-forholdstall var mer feil utsatt enn de med høye N/P-forhold., En forklaring for denne observasjonen er at ved inkorporering av en avvikende base det er mer sannsynlig at exonuclease vil fjerne nukleotid før polymerase aktiviteten strekker seg at det i enzymer med høyere N/P-forhold. Interessant, korrekturlesing effektiviteten av en polymerase kan vise sekvensiell avhengighet. For eksempel, PÅ rik sekvenser er mer effektivt korrekturlese enn GC regioner. Dette avviket er tenkt å være på grunn av lavere stabilitet PÅ områder som forenkler strand smelte og derfor, korrektur aktivitet.,
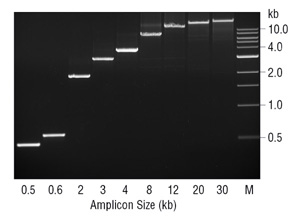
fravær av 3→5 exonuclease aktivitet kan få konsekvenser for andre enn troskap i PCR. Mangel på korrektur aktivitet i Taq DNA-Polymerase har blitt foreslått å begrense amplikon størrelse mulig med dette enzymet (7). Generelt, Taq utfører best når amplifisering av DNA-fragmenter < 2 kb, og kan arbeide med fragmenter opp til 3-4 kb. Da holdt til dette amplikon størrelse, Taq er en robust, lett optimalisert enzym. Imidlertid, over ~3 kb det raskt fall i effektiviteten., I løpet av PCR, Taq vil misincorporate nukleotider og produsere samsvarer ikke, hvor det er utsatt for drøying av tid og er mer sannsynlig å distansere før strekker seg i forhold til riktig base sammenkoblede 3 ender. Derfor, i en viss amplikon størrelse og polymerase feil pris nok ikke samsvarer 3 ender kan samle seg for å effektivt hemme PCR-prosessen. Disse feilaktige 3 endene er spesielt problematisk for Taq fordi den mangler 3→5 exonuclease aktivitet for å fjerne dem., Ved å legge til i en liten mengde korrekturlesing enzym som Dyp Vent®DNA-Polymerase, forsterkning av fragmenter ≥ 20 kb kan oppnås (Figur 3). Siden det store flertallet av enzymet i blanding er Taq DNA-Polymerase det er sannsynligvis gjøre mesteparten av primer extension, med korrekturlesing Dyp Vent polymerase fjerne hemmende 3 samsvarer ikke generert av Taq.,
– Polymerase Processivity
viktigheten av å korrekturlese aktivitet PCR har blitt viden kjent for nesten to tiår, men en annen eiendom, processivity, har fått økt oppmerksomhet., «Processivity» er et begrep som refererer til antall nukleotider inngår ved en polymerase i en enkelt bindende hendelse (før dissosiasjon). Taq DNA-polymerase legger til ca 50 nukleotider per bindende hendelse (8). Hvorfor er dette viktig? En lav-processivity eller «rettferdig fordeling» polymerase strekker en befolkning på maler i en vesentlig annen måte enn en processive polymerase. En svært rettferdig fordeling polymerase binder seg til en mal, og legger til et par av nukleotider, og distanserer, slik at en befolkning på maler som kan utvides likt med tid., En svært processive polymerase binder seg en mal og strekker seg med lenger bindende hendelser.
Det ville følge det som er gitt nok tid utfallet av enten en processive eller distributive polymerase reaksjon ville bli en befolkning på kopiert maler. Men i visse tilfeller er det mulig at processive polymerase har en overlegen ytelse. E. coli-polymerase III α subunit, en del av de viktigste replicative polymerase har en processivity av < 10 base-par og en hastighet på < 20 nukleotider/sekund (nt/s)., Imidlertid, når subunit assosierer med andre replisome underenhetene, spesielt skyve klemme, effektiv processivity og replikering økt hastighet til > 50 kb og 1000 nt/s, henholdsvis (9). Begrepet «effektiv processivity» er brukt fordi det er data som indikerer polymerase subunit kan utveksle i replisome, men replisome, opprettholder du rask, processive DNA-replikasjon (10).
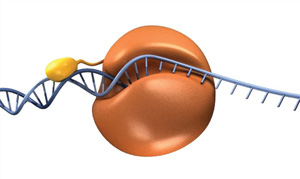
for Å dra nytte av processivity i PCR, forskere har smeltet et DNA-bindende domene til en archaeal polymerase (11)., Dette chimeric enzymet har flere forbedrede egenskaper, men særlig den er i stand til å amplifisere DNA med kortere extension ganger og produsere lenger DNA produkter mer effektivt, og dermed forkorte samlet thermocycling ganger. Dette fusion ideen er grunnlaget for Sp5 High-Fidelity DNA-Polymerase og Phusion® High-Fidelity DNA-Polymerase, to polymerases tilgjengelig fra NEB (Figur 4).
Fremtid Retninger
Mange egenskaper påvirke effekten og nytten av en PCR-polymerase. – Polymerase aktive området arkitektur og korrektur aktivitet påvirker nøyaktigheten av det endelige produktet. – Polymerase blander og fusion til et DNA-bindende protein gir overlegen PCR ytelse for amplikon lengde og, i tilfelle av chimera, reaksjon hastighet., Andre viktige fremskritt i PCR, slik som hot-start polymerases å øke reaksjon spesifisitet, multiplex PCR (Figur 5) og qPCR har også revolusjonert miljø-og biovitenskap.
Som demonstrert ved konstruert blander og chimeras, egenskaper av polymerase i seg selv kan være naturlig å forbedre PCR-ytelse. I fremtiden er det sannsynlig at polymerase egenskaper vil i økende grad være skreddersydd til spesifikke PCR-programmer, og som sådan er dette et viktig område for forskning på NEB.,

Vis NEB DNA-Polymerase Utvalget Chart















