Frontiers i Endokrinologi
Innledning
tumor suppressor gen TP53 har vært den mest trafikkerte studert menneskelige gen siden det ble funnet nesten 40 år siden (1). Den viktigste grunnen til at bak denne statusen, er det avgjørende rolle p53 spiller i å forebygge kreft utvikling, og det er ansett som «vakt til den genom.,»For noen tid har det vært allment antatt at p53 rolle i svulsten undertrykkelse er i kraft av sin evne til å indusere apoptosis, celle syklus arrest, og senescence av pre-cancerous celler (2). Det er imidlertid nå i økende grad klart at p53 regulerer mange andre veier i cellen, og at disse andre baner også spille roller i p53 evne til å fungere som en tumor suppressor (3). I særdeleshet, p53 rolle i reguleringen av gener som er involvert i metabolisme og ferroptosis har vært innblandet i sin evne til å undertrykke tumor utvikling., Ferroptosis er en roman celledød pathway først preget i 2012, og kan best beskrives som en jern-avhengige, caspase-uavhengig form for celledød drevet av dannelsen av lipid peroxidation (4). Spesielt, to mus modeller som inneholder konstruert mutasjoner i p53 at eliminere muligheten av p53 å indusere apoptosis og senescence både beholde evnen til å undertrykke spontan tumor utvikling; begge disse mutanter beholde evnen til å transactivate gener i metabolisme og ferroptosis (5, 6)., En oppsummering av de data som trekker p53 i regulering av metabolisme og ferroptosis er beskrevet nedenfor.
Wild-Type (WT) p53 Positivt Regulerer Oksidativt Phosphorylation og Undertrykker Glukose Metabolisme
Wild-type p53 regulerer metabolske allsidighet av cellene ved å favorisere mitokondrie åndedrett over glykolysen, delvis via transactivation av SCO2 (cytokrom c oksidase montering), som spiller en direkte rolle i oksidativt phosphorylation (7)., p53 også direkte regulerer transactivation av GLS2 (Glutaminase 2); dette enzymet gjør glutamin bruk som energikilde for mitokondrier (8). I tillegg, WT p53 negativt regulerer glykolysen av transcriptionally repressing glukose transportører GLUT1 og GLUT4, og ved transactivating RRAD og TIGAR; begge er hemmere av glykolysen (9-11). Til slutt, p53 også direkte binder og hemmer enzymet glukose-6-fosfat dehydrogenase, og dermed undertrykke glukose metabolisme (12)., Det er klart fra disse og andre studier at i normal, trykksvake organismer, p53 direkte regulerer den metabolske tilstand i en celle (Figur 1). Ikke overraskende, er dette genet, og mange av dens regulatorer er innblandet i metabolske sykdommer, inkludert fedme og diabetes (13).
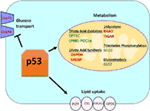
Figur 1. Rollen som wild-type (WT) p53 i metabolismen. Gener positivt regulert av p53 er vist i grønt, og gener som er negativt regulert av p53 er vist i rødt., p53 hemmer glukose transport, glykolysen, og fettsyrer syntese mens det fremmer lipid opptak, fettsyrer oksidasjon, oksidativt phosphorylation, og glutaminolysis.
Mutant p53 Positivt Regulerer Warburg Metabolisme (Aerob Glykolysen)
I motsetning til den funksjonen av WT p53, mutant p53 i tumor celler favoriserer aerobic glykolysen, delvis ved å øke handel av glukose transporter GLUT1 til plasma membran, og dermed øke glukose import (14, 15)., Følgende mutasjon av p53, redusert nivåene av SCO2 og GLS2 og økte nivåer av GLUT1 og GLUT4 favør aerobic glykolysen over oksidativt phosphorylation. På denne måten, mutant p53 er antatt å bidra til å tilbøyelighet til kreftceller til å utnytte aerobic glykolysen i favør av oksidativt phosphorylation, eller såkalte Warburg metabolisme (15). Ett av kjennetegnene til kreft er frigitt metabolisme, generelt vist ved denne bryteren fra aerobic glykolysen til oksidativt phosphorylation., Om dette resulterer i en lavere og mindre effektiv ATP avkastning, er det antatt at kreftceller fordel ved å avlede glycolytic mellomprodukter til biosynthetic trasé som er nødvendig for rask celledeling (16). Denne metabolske bytte fører også til redusert mitokondrier-mediert apoptosis og mer effektiv signalering gjennom tilgjengelig metabolitter i kreftceller (17).
En Felles Genetisk Variant i TP53 Påvirker dens Funksjon i Metabolismen
Det er en felles koding for regionen polymorphism av p53 på codon 72, – koding for enten proline (P72) eller arginin (R72)., Denne aminosyren variasjon kan påvirke p53 funksjon med hensyn til celle skjebne etter stress. I respons til DNA skade, P72 variant av p53 hovedsakelig utløser celle syklus arrest, mens R72 variant hovedsakelig induserer celledød, eller apoptosis (18, 19). Til tross for disse forskjellene i funksjon, codon 72 variasjon har ikke vært konsekvent forbundet med kreft mottakelighet (20). I kontrast, i studier på mennesker denne polymorphism er signifikant assosiert med økt body mass index og risiko for diabetes (21, 22)., Dette premisset er støttet av studier i mus, hvor en mus modell for disse codon 72 varianter viser økt høy-fett diett-indusert diabetes hos mus med R72 variant, i forhold til P72. I disse studier, p53 mål gener TNFa og NPC1L1 ble identifisert som kritiske regulatorer i økningen i kosthold-indusert fedme i R72 mus (23). Interessant, R72 varianten har også vist seg å gi økt overlevelse av celler som respons på næringsstoffer deprivasjon (24)., Disse funnene har ført til hypotesen om at R72 variant av p53 oppsto og ble valgt for bestander som migrert nordover, hvor kaldt vær vil kreve økt fett opphopning, men hvor overlevelse i respons til næringsstoff deprivasjon vil også være under utvalg (24).
p53 Regulerer Lipid Metabolisme
selv Om p53 er godt kjent for regulering av glykolysen og sitronsyre syklus, p53 har også vist seg å spille en rolle i regulering av lipid metabolisme (25)., Det antas at WT p53 forbedrer fettsyrer oksidasjon samtidig som begrenser fettsyrer syntese, og dermed fungerer som en negativ regulator av lipid-syntese (25). Det er flere p53 mål gener med roller i lipidmetabolismen. Sanchez-Macedo og kolleger viste at carnitine palmitoyltransferase 1C (CPT1C) er transcriptionally regulert av p53; dette enzymet aids i transport av aktivert fettsyrer til mitokondrier., Til støtte for en rolle for denne p53-regulerte gen i kreft, denne gruppen viste at Cpt1c-mangelfull mus vise forsinket tumor utvikling og høyere overlevelse (26). Lipin 1 (LPIN1) er en annen p53 mål gen; LPIN1 er nødvendig for riktig adipocyte utvikling og er indusert under lavt næringsinnhold forhold (27). Finck og kolleger viste at LPIN1 samhandler med PGC-1α, en annen kjent p53 mål gen med en rolle i stoffskiftet, og at dette samspillet aktiverer uttrykket av gener som er involvert i å fremme fettsyrer oksidasjon (28).,
I tillegg til direkte regulering av transkripsjon av gener som er involvert i lipidmetabolismen, p53 kan også regulere lipid metabolisme på en måte som involverer direkte protein–protein samhandling. For eksempel, glukose-6-fosfat dehydrogenase, som er pris-begrense enzym i pentose fosfat vei, binder seg til og er direkte hemmet av p53, noe som resulterer i redusert NADPH produksjon og dermed redusert fettsyrer syntese (12)., Den sterol regulatory element-bindende proteiner (SREBP) familie av transkripsjonfaktorer forandre uttrykket av gener som er involvert i kolesterol, fettsyrer, triacylglycerol, og fosfolipid syntese (29-31). WT p53 undertrykker SREBP-funksjonen (32), mens mutante former av p53 binder seg direkte til SREBP og forbedre deres transcriptional funksjon, som fører til økt SREBP aktivitet i humane svulster (33, 34). Følgelig, mutant p53 er korrelert med høyere uttrykk av sterol biosyntese gener i det menneskelige brystkreft svulster (34, 35)., Til slutt, AMP-aktivert protein kinase (AMPK) er et enzym som er aktivert under lavt næringsinnhold eller energi stress og er kjent for å hemme fettsyrer syntese av samspill med acetyl-CoA-carboxylase og SREBP-1 (36, 37). Zhou og medarbeidere vist at mutant p53 fortrinnsvis binder seg til og hemmer AMPK, noe som fører til økt fettsyrer syntese. Som et resultat, mutant p53 proteiner føre til økt AMPK signalering, bidra til invasiv celle vekst av tumor celler (33). En mindre utforsket området er rollen som p53 i lipid transport., Det har vist seg at p53 transcriptionally regulerer apolipoprotein B (apoB) og apoB redigering enzym komplekse 1, som indikerer rollen som p53 i regulering atherogenic lipoproteiner (38). Microarray analyse av menneskelige leveren-celler avledet identifisert fosfolipid overføre protein, ATP-bindende kassett A12, og carboxyl ester lipase som tre p53 mål gener som spiller en rolle i lipid transport (39, 40)., Totalt sett, selv om det er klart at p53 spiller en viktig rolle i formidling lipid syntese og metabolisme, bidrag av denne veien, og disse p53 mål gener, til å svulst undertrykkelse av p53 er fortsatt skal fastsettes (Figur 1).
Ferroptosis er en Roman celledød Vei Drevet av Lipid Peroxidation
I 2012, Dixon og kolleger oppdaget en ny form for regulert celledød kalt ferroptosis. Ferroptosis er en jern-avhengige, caspase-uavhengig form av cellen død som følge av akkumulering av oksidert lipider (4, 41)., Denne prosessen er drevet av inaktivering av glutathione peroxidase 4 (GPX4), et enzym som er ansvarlig for konvertering av dødelige lipid hydroperoxides til ikke-giftig lipid alkoholer, som krever glutation for å fungere (41). Det antas at peroxidation av flerumettede fettsyrer (PUFAs) er den drivande krafta for celledød ved ferroptosis. PUFAs inneholder bis-allylic protoner som lett kan abstraheres og produsere radikaler som vil reagere med oksygen, og skape flere radikaler og som resulterer i en kjede reaksjon av lipid reaktive oksygen arter (42)., Den eksakte mekanismen for celledød ved ferroptosis er fortsatt ukjent, men en hypotese er at lipid skade fører til ødeleggelse av plasma membran (43). Det har vært spekulert i at ferroptosis kunne være en mekanisme for svulst undertrykkelse som fungerer ved å eliminere celler som er næringsrikt fratatt eller har vært utsatt for en miljømessig stress eller infeksjon.,
Farmakologiske Regulering av Ferroptosis
Ferroptosis kan være fremkalt ved bruk av hemmere av systemet xc− for eksempel erastin, eller analogs for eksempel glutamat og sorafenib, som hindrer import av cystine, noe som resulterer i redusert glutation og påfølgende inaktivering av GPX4. Alternativt, ferroptosis kan være forårsaket av (1S,3R)-RSL3 (heretter referert til som RSL3), som direkte binder seg til og hemmer GPX4 (4, 5, 42). Buthione sulfoximine, FIN56, FINO2, CCl4, og cisplatin er andre stoffer som har vist å indusere ferroptosis i cellene., Død ved ferroptosis kan forebygges ved å undertrykke lipid peroxidation, noe som kan oppnås ved hjelp av lipofile antioksidanter, slik som ferrostatin-1, liproxstatin-1, eller vitamin E. Strykejern chelators som deferoxamine eller cicloprox er et annet verktøy som brukes til å undertrykke ferroptosis ved å redusere nivåene av jern. Tappe PUFAs eller legge til enumettede fettsyrer til celle kultur media kan også redde celler fra ferroptosis (42, 44).,
Ferroptosis er Innblandet i p53-Mediert Svulst Undertrykkelse
I 2012, Gu og kolleger utviklet en mus som modell i som normalt tre acetylated lysin rester i DNA-bindende domene av p53 var mutert til å arginin, og derfor ikke kunne være acetylated; denne musen er referert til som 3KR mus. Spesielt, celler fra 3KR musen ikke er i stand til å gjennomgå p53-avhengige apoptosis, celle syklus arrest, eller senescence, og faktisk 3KR mutant av p53 ikke klarer å transactivate flertallet av p53 mål gener., Det er interessant at denne musen modell ikke spontant utvikler kreft, noe som tyder på at p53 kan undertrykke tumor utvikling uavhengig av senescence eller apoptosis (45). Denne gruppen fant at mutant 3KR protein beholder evnen til å gjennomgå ferroptosis og regulere cystine metabolismen ved å regulere uttrykk for cystine importør SLC7A11; dette foreslo at ferroptosis kan være en vei som ligger til grunn for p53-mediert svulst undertrykkelse., Når wild-type og 3KR MEFs ble behandlet med ferroptosis induser Erastin, nesten 50% celledød ble observert mens p53 null MEFs utstilt 20% celledød; dette indikerer at p53 sensitizes celler til ferroptosis, og også for at andre sentrale myndigheter også spille en rolle i ferroptosis (5). Senere, Gu og kolleger identifisert en ekstra acetylation område på lysin 98 av p53, og de genererte en mus modell der alle fire acetylation steder ble mutert til å arginin (4KR)., Interessant, 4KR mutant var ikke i stand til å regulere gener som er involvert i ferroptosis som SLC7A11, og i motsetning til de 3KR mutant var ikke i stand til å undertrykke tumor utvikling (46). Men i dag correlative, disse data impliserte rollen som p53 i ferroptosis i sin evne til å undertrykke tumor utvikling.
I Ikke-Transformerte Celler, p53 Positivt Regulerer Ferroptosis
I tillegg til SLC7A11, flere andre direkte p53 mål gener har blitt oppdaget å spille en rolle i ferroptosis. Disse inkluderer GLS2, PTGS2, og SAT1., Studier fra to separate grupper som støtter rollen av GLS2 i ferroptosis, som er kjent for å redusere glutation og øke cellefornyelsen ROS nivåer. Jiang og kolleger brukte ferroptosis hemmere kombinert med glutaminolysis hemmere å hemme Erastin-indusert ferroptosis, og dermed demonstrerer at ferroptosis krever glutaminolysis og GLS2 (47). Murphy og medarbeidere viste at en polymorf variant av p53 var i stand til å indusere vekst arrest og senescence i både menneskelige og murin celler, men klarte ikke å undertrykke SLC7A11 eller transactivate GLS2., Denne varianten ble markert svekket på inducing ferroptosis og undertrykke tumor utvikling, og dermed igjen trekker rollen som p53 i ferroptosis-mediert svulst undertrykkelse (48). En annen p53 mål gen med en rolle i ferroptosis er PTGS2, et gen koding enzymet cyklooksygenase-2. Stockwell og kolleger første viste at induksjon av ferroptosis ved hjelp av Erastin og RSL3 førte til upregulation av PTGS2 (41). Spesielt, PTGS2 var ikke oppregulert ved ferroptosis indusere i p53-null-celler, noe som tyder på at denne forordning er p53 avhengige (5)., I dag, upregulation av PTGS2 er mye brukt som en ferroptosis markør (5, 41).
En fersk undersøkelse utført av Gu-gruppen viste at p53 mål genet SAT1 regulerer ferroptosis (49). Forfatterne identifisert SAT1 som et direkte mål av p53 og viste at stanse av SAT1 redusert celledød forårsaket av reaktive oksygenforbindelser i celler med WT p53, men hadde ingen effekt i p53-null-celler. Mechanistically denne gruppen viste at SAT1 øker nivået og aktivitet av arachidonate 15-lipoxygenase, en jern-bindende enzym som oxidizes PUFAs og øker lipid peroxidation., Spesielt er denne studien viste at verken p53 heller SAT1 alene synes å være tilstrekkelig til å indusere ferroptosis. I stedet kombinerte data er mer i samsvar med den forutsetningen at p53, i kraft av å regulere gener som bidrar til ferroptosis, regulerer følsomhet av celler til denne veien, heller enn direkte induserer ferroptosis. Om p53 regulerer andre gener som er involvert i ferroptosis fortsatt skal fastsettes (Figur 2).
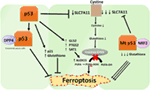
Figur 2. De ulike rollene til p53 i ferroptosis., Hemming av glutathione peroxidase 4 (GPX4), er det viktig enzym som catalyzes konvertering av flerumettede fettsyrer (PUFAs) inneholder peroksider til alkohol, er det viktig driver av ferroptosis. Avhengig av sammenhengen, p53 kan undertrykke ferroptosis (for eksempel i kolorektal kreft celler) eller fremme ferroptosis. Mutant p53 sensitizes celler til ferroptosis enda mer enn vill-type p53.,
I Noen Celler, p53 Negativt Regulerer Ferroptosis
En studie nylig utgitt av Tarangelo og kolleger viser at p53 negativt regulerer ferroptosis i kreftceller (50). Denne gruppen fant at pre-behandling av celler med Nutlin-3, et stoff som stabiliserer p53 forsinkelser utbruddet av ferroptosis i flere celletyper. Den forsinkede starten av ferroptosis ble funnet å stole på CDKN1A (koding p21), en kritisk p53 transcriptional mål., Den mekanisme som p21 forsinkelser ferroptosis har ennå å bli belyst, men det antas at bevaring av intracellulære glutation kan være en medvirkende faktor for redusert ferroptosis følsomhet. Forfatterne konkluderer med at p53–p21 aksen gjør at kreftceller til å overleve under forhold med metabolsk stress, for eksempel cystine nød, ved å undertrykke utbruddet av ferroptosis (50). En nylig studie viste at p53 hemmer ferroptosis i kolorektal kreft cellene ved å binde seg til enzymet dipeptidyl-peptidase-4 (DPP4), som er en modulator av ferroptosis og lipidmetabolismen., Mechanistically, denne studien viste at p53 antagonizes ferroptosis av sequestering DPP4 i en kjernefysisk enzymatisk inaktive basseng. I fravær av p53, DPP4 er gratis å samhandle med og danner et kompleks med NOX1, og dette fører til økt lipid peroxidation og ferroptosis. Hemming av DPP4 undertrykker ferroptosis betydelig, mens overexpression av DPP4 utløser Erastin følsomhet, spesielt i p53-tomme celler (51). Den toveis kontroll av ferroptosis av p53 gjennom transkripsjon-avhengige og transkripsjon-uavhengige mekanismer kan være en sammenheng eller celle-type avhengige (Figur 2).,
P47S Polymorphism av TP53 Påvirker Ferroptosis og Tumor Undertrykkelse
I tillegg til missense mutasjoner, det er flere funksjonelt betydelig enkelt-nukleotid polymorfismer (SNPs) i TP53-genet og andre proteiner, som er kjent for å regulere denne veien (for eksempel MDM2 og MDM4). Den Pro47Ser variant (heretter S47) er den nest mest vanlige SNP funnet i p53-koding regionen (etter Pro72Arg) som endrer aminosyresekvens av protein., For å bedre belyse virkningen av denne varianten på p53 funksjon og risiko for lungekreft, Murphy gruppe generert en humanisert p53 knock-i mus modell, der exons 4-9 av murin p53 ble erstattet av menneskelige p53 exons inneholder enten wild-type eller S47 variant (52-55). De fleste av S47 mus som spontant utviklet svulster av ulike histologic typer, spesielt leverkreft, mellom 12 og 18 måneders alder, i motsetning til WT p53 mus (48)., I mus embryonale fibroblaster og menneskelige lymphoblastoid celle linjer, S47 variant viste nedsatt programmert celledød i respons til cisplatin og andre gentoksisk påkjenninger. Mechanistically, den S47 variant er defekt for transactivation av gener som er involvert i stoffskiftet, slik som Gls2 (glutaminase 2) og Sco2 (48). I tråd med rollen som Gls2 i ferroptosis denne gruppen fant at S47 celler ble markert motstandsdyktig mot ferroptosis-induserende agenter Erastin og RSL3 (47, 48). Denne defekten kan bidra til svulsten utsatt for fenotypen observert i S47 mus.,
Mutant p53 Sensitizes Tumor Celler til Ferroptosis
Wild-type p53 negativt regulerer uttrykk av cystine importør SLC7A11, som hemmer følsomhet for ferroptosis (5). Selv om denne reguleringen skjer i normale celler i tumor celler, andre mediatorer av SLC7A11 synes å dominere i reguleringen av dette genet. For eksempel, master antioksidant transkripsjonsfaktor NRF2 kan også regulere uttrykk for SLC7A11 på transcriptional nivå, og NRF2 har vært innblandet som en sentral aktør i å beskytte kreft celler mot ferroptosis., For eksempel, hemming av NRF2 i hepatocellulær cancer celler øker anti-kreft aktivitet av Erastin og Sorafenib in vivo (56). Mutante former av p53 kan hemme NRF2 funksjon ved direkte interaksjon, og en gruppe fant at svulster med mutant p53 inneholder svært lave nivåer av SLC7A11, og dermed vise økt følsomhet for ferroptosis. Spesielt, overexpression av SLC7A11 i mutant p53-modeller førte til resistens, noe som tyder på at nivåene av SLC7A11 uttrykk må vurderes når du målretter mutant p53 drevet kreft med ferroptosis-induserende forbindelser (57)., Til støtte for dette premisset, nyere arbeid i kolorektal (CRC) kreft, hvor mutasjon eller sletting av p53 er en hyppig tilfelle, viste at menneskelig CRC celle linjer husing mutant p53 var langt mer følsomme for Erastin-mediert celledød i forhold til CRC celler med WT p53. For å bekrefte disse funnene, de viste at banke i en p53-sone mutasjon i begge HCT116 og SW48 celler restaurert følsomhet for Erastin (51). Disse data markere en roman mekanismen som kreft drevet av mutant p53 kan utnyttes ved hjelp av målrettet behandling.,
Konklusjon
The role of p53 i stoffskiftet er ganske klar og muligens også intuitivt opplagt: WT p53 grenser glukose metabolisme og lipid syntese, mens mutant p53 ser ut til å gjøre det motsatte. Bidraget av dens metabolsk rolle å svulst undertrykkelse av p53, og muligheten av mutant p53 å drive tumor progresjon, gjenstår å være utvetydig dokumentert. Rollen som p53 i reguleringen av ferroptosis, og bidraget av denne funksjonen, for å svulst undertrykkelse er enda mindre klar., Mens overbevisende data fra mus modeller støtter premisset om at p53 regulerer følsomhet av celler å ferroptosis, kan dette være begrenset til muligheten av basal p53 å undertrykke spontan tumor utvikling, og i onkogenet-stresset mus modeller, det er klart at senescence og apoptosis spille en dominerende rolle. På samme måte, p53 kan regulere ferroptosis følsomhet i en celle type-spesifikke måte. Flere studier i dyremodeller, med hensyn til ferroptosis i ulike vev, må gjøres for å en mer fullstendig forståelse av den rollen p53 i ferroptosis og ferroptosis i svulsten undertrykkelse., I tillegg, en klarere idé om hva p53-målet gener spiller en rolle i følsomhet for ferroptosis behov for å være oppnådd. Oppløsning av disse spørsmålene bør gi for mye nødvendig roman veier for å bekjempe svulster med mutant p53.
Forfatter Bidrag
KG, SB, TB, AB-K, C-PK, og MM hver skrev en til to avsnitt av denne artikkelen. KG og SB gjorde figuren. KG og MM som er skissert i kapitlet.,
interessekonflikt Uttalelse
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller finansielle forhold som kan oppfattes som en potensiell interessekonflikt.
anmelderen OAF og håndtering Redaktør erklærte deres felles tilhørighet.
Erkjennelsene
Forskning rapportert i denne publikasjonen ble støttet av National Institutes of Health under Award Tall CA102184 (MM), CA201430 (MM), TL1TR002344 (C-PK), og T32 CA009171 (TB)., Innholdet er selv ansvarlig for forfatterne, og representerer ikke nødvendigvis de offisielle synspunkter av National Institutes of Health.
3. Humpton TJ, Vousden KH. Regulering av cellulær metabolisme og hypoksi av p53. Kalde Våren Harb Perspect Med (2016) 6(7):211-30. doi:10.1101/cshperspect.a026146
CrossRef Full Tekst | Google Scholar
10. Zhang C, Liu J, Wu R, Liang Y, Lin M, Liu J, et al., Tumor suppressor p53 negativt regulerer glykolysen stimulert av hypoxia gjennom sitt mål RRAD. Oncotarget (2014) 5(14):5535-46. doi:10.18632/oncotarget.2137
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
17. Lee M, Yoon JH. Metabolske samspillet mellom glykolysen og mitokondrie oksidasjon: omvendt Warburg effekt og dens terapeutiske implikasjoner. Verden J Biol Kem (2015) 6(3):148-61. doi:10.4331/wjbc.v6.i3.,148
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dumont P, Leu JI, Della Pietra AC III, George DL, Murphy M. The codon 72 polymorphic variants of p53 have markedly different apoptotic potential. Nat Genet (2003) 33(3):357–65. doi:10.1038/ng1093
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Kung CP, Khaku S, Jennis M, Zhou Y, Murphy ME., Identification of TRIML2, a novel p53 target, that enhances p53 SUMOylation and regulates the transactivation of proapoptotic genes. Mol Cancer Res (2015) 13(2):250–62. doi:10.1158/1541-7786.MCR-14-0385
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Bitti ML, Saccucci P, Capasso F, Piccinini S, Angelini F, Rapini N, et al. Genotypes of p53 codon 72 correlate with age at onset of type 1 diabetes in a sex-specific manner. J Pediatr Endocrinol Metab (2011) 24(7–8):437–9. doi:10.1515/jpem.,2011.058
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Kung CP, Liu Q, Murphy ME. The codon 72 polymorphism of p53 influences cell fate following nutrient deprivation. Cancer Biol Ther (2017) 18(7):484–91. doi:10.1080/15384047.2017.1323595
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sanchez-Macedo N, Feng J, Faubert B, Chang N, Elia A, Rushing EJ, et al., Nedbryting av romanen p53-målet genet carnitine palmitoyltransferase 1C forsinkelser tumor vekst i nevrofibromatose type i tumor-modellen. Celledød Forskjellige (2013) 20(4):659-68. doi:10.1038/cdd.2012.168
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
30. Ettinger SL, Sobel R, Whitmore TG, Akbari M, Bradley DR, Gleave MEG, et al. Dysregulation av sterol svar element-bindende proteiner og nedstrøms effektorer i prostata kreft i løpet av progresjon til androgen uavhengighet., Cancer Res (2004) 64(6):2212–21. doi:10.1158/0008-5472.CAN-2148-2
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Clendening JW, Pandyra A, Boutros PC, El Ghamrasni S, Khosravi F, Trentin GA, et al. Dysregulation of the mevalonate pathway promotes transformation. Proc Natl Acad Sci U S A (2010) 107(34):15051–6. doi:10.1073/pnas.,0910258107
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Yang WS, Kim KJ, Gaschler MM, Patel M, Shchepinov MS, Stockwell BR. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis. Proc Natl Acad Sci U S A (2016) 113(34):E4966–75. doi:10.1073/pnas.1603244113
PubMed Abstract | CrossRef Full Text | Google Scholar
54., Luo JL, Yang Q, Tong WM, Hergenhahn M, Wang ZQ, Hollstein M. Knock-i-mus med en chimeric human/murin p53-genet utvikle seg normalt og viser wild-type p53 svar på DNA-skadelige stoffer: en ny biomedisinsk forskning verktøyet. – Onkogenet (2001) 20(3):320-8. doi:10.1038/sj.onc.1204080
PubMed Abstrakt | CrossRef Full Tekst | Google Scholar
57. Liu DS, Duong CP, Haupt S, Montgomery KG, Hus CM, Azar WJ, et al. Å hemme system xC-/glutathione-aksen selektivt mål kreft med mutant-p53 akkumulering., Nat Commun (2017) 8:14844. doi:10.1038/ncomms14844
PubMed Abstract | CrossRef Full Text | Google Scholar















