Kjemi for Ikke-Majors (Norsk)
Mål
- Beskrive molekyler hvis figurer er påvirket av VSEPR-teorien.
- Definere enslig par.
- Beskrive hvordan enslig par elektroner innflytelse molekylær geometri.
Hvordan gjør en electroscope arbeid?
En electroscope er en enhet som brukes til å studere kostnad. Når en positivt ladet objekt (stang) nærmer seg den øvre post, elektronene flyter til toppen av glasset og forlater de to gull blader postivley belastet., Bladene frastøte hverandre, siden begge holder postive, som kostnader. Den VSEPR-teorien sier at electron par, også et sett av like ladninger, vil frastøte hverandre, slik at formen av molekylet vil justere slik at valence elektron-par bo så langt fra hverandre som mulig.

Sentral-Atom med Ingen Enslig Par
for å enkelt forstå typer molekyler som mulig, vil vi bruke en enkel system for å identifisere deler av alle molekyl.,
A = sentral atom i molekylet
B = atomer rundt sentrale atom
senket skrift etter B vil betegne antall B atomer som er bundet til den sentrale Et atom. For eksempel, AB 4 er et molekyl med en sentral atom omgitt av fire covalently limt atomer. Igjen, det spiller ingen rolle om disse obligasjoner er enkel, dobbel eller trippel obligasjoner.
AB2: Beryllium hydrid (BeH2)
Beryllium hydrid består av en sentral beryllium atom med to enkeltsenger obligasjoner til hydrogen atomer. Husker at det bryter octet-regelen.,
H-Være-H
i Henhold til kravet om at elektron par maksimere deres avstand fra hverandre, de to bonding par i den BeH 2 molekyler vil ordne seg på direkte motsatt side av den sentrale Bli atom. Den resulterende geometri er et lineært molekyl, som vist i Figur 1 i en «ball og pinne» – modell.

Figur 1. Beryllium hydrid-modellen.
The bond vinkel fra H-Være-H er 180° på grunn av sin lineær geometri.,
karbondioksid er en annen eksempel av et molekyl som faller inn under AB 2 kategori. Dens Lewis-strukturen består av dobbeltbindinger mellom det sentrale karbon og oksygen-atomer (se Figur 2).

Figur 2. Karbondioksid bonding.
frastøting mellom de to gruppene av fire elektroner (to par) er noe annerledes enn de frastøting av to grupper med to elektroner (et par) i den BeH 2-molekylet. Karbondioksid er også lineær (se Figur 3).,

Figur 3. Karbondioksid.
AB3: Boron Trifluoride (BF3)
Boron trifluoride består av en sentral boron atom med tre single obligasjoner til fluor atomer (se Figur 4). De boron atom har også en ufullstendig oktett.
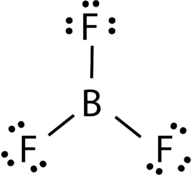
Figur 4. Boron trifluoride bonding.
geometri BF 3 molekyl kalles trigonal plan (se Figur 5). Den fluor atomene er plassert i hjørnene i en likesidet trekant., F-B-F vinkel 120° og alle de fire atomene ligger i samme plan.

Figur 5. Boron trifluoride modell.
AB4: Metan (CH4)
Metan er et organisk stoff som er den viktigste komponenten i naturgass. Strukturen består av en sentral karbonatom med fire enkle obligasjoner til hydrogen atomer (se Figur 6). For å maksimere sine avstand fra hverandre, de fire gruppene av bonding elektroner ikke ligge i samme plan., I stedet, kan hver av hydrogen atomer ligger i hjørnene av en geometrisk form som kalles en tetrahedrons. Karbon atom i sentrum av tetrahedrons. Hvert ansikt av en tetrahedrons er en likesidet trekant.

Figur 6. Tetrahedral struktur av metan.
Den molekylære geometri av metan molekylene tetrahedral (se Figur 7). H-C-H bond vinkler er 109.5°, som er større enn 90°, at de ville være hvis molekylet var plan., Når du tegner en strukturell formel for et molekyl som for eksempel metan, er det en fordel å være i stand til å indikere de tre-dimensjonale karakter av formen. Den strukturell formel nedenfor er kalt et perspektiv tegning. Den stiplede linjen bond er å bli visualisert som viker til side, mens solid trekant bond er å bli visualisert som kommer ut på siden.

Figur 7. Metan perspektiv modell.
Hvordan kan alle disse klærne passer inn på så liten plass?,
Når vi reiser, vi ofte tar mange flere ting enn vi trenger. Prøver å passe alt i en koffert kan være en reell utfordring. Vi kan ha å pakke eller bare klem alt. Atomer ofte nødt til å omorganisere der elektronene er i orden for å skape en mer stabil struktur.

Sentral-Atom med En eller Flere Enslig Par
Den molekylære geometrier av molekyler endring når det sentrale atomet har en eller flere enslig par av elektroner., Det totale antall av elektron par, både bonding par og enslige par, fører til det som kalles electron domene geometri. Når ett eller flere av bonding par av elektroner er erstattet med en enslig par, molekylær geometri (faktiske formen) av molekylet er endret. I tråd med A-og B-symboler etablert i forrige avsnitt, vil vi bruk E for å representere en enslig par på det sentrale atomet (En). En senket skrift skal brukes når det er mer enn én enslig par. Lone par på rundt atomer (B) ikke påvirker geometri.,
AB3E: Ammoniakk, NH3
ammoniakk molekyl inneholder tre enkle obligasjoner og en enslig par på den sentrale nitrogen atom (se Figur 8).

Figur 8. Lone par elektroner i ammoniakk.
domenet geometri for et molekyl med fire electron par er tetrahedral, som ble sett på med CH-4 . I ammoniakk molekyl, ett av elektronet parene er en enslig par snarere enn en bonding par. Den molekylære geometri av NH 3 heter trigonal pyramidal (se Figur 9).,

Figur 9. Ammoniakk-molekylet.
Husker at bond vinkel i tetrahedral CH 4 molekylet er 109.5°. Igjen, utskifting av en av bundne elektron par med en enslig par komprimerer vinkelen litt. H-N-H vinkel er ca 107°.
AB2E2: Vann, H2O
Et vann molekylet består av to bonding par og to ensomme par (se Figur 10).

Figur 10. Lone par elektroner på vann.,
Som for metan og ammoniakk, domene-geometri for et molekyl med fire electron par er tetrahedral. I vann molekylet, to av elektronet par er enslig par snarere enn bonding par. Den molekylære geometri av vann molekylet er bøyd. H-O-H bond vinkel er 104.5°, som er mindre enn bond vinkel i NH3 (se Figur 11).

Figur 11. Vann molekylet.,
AB4E: Svovel Tetrafluoride, SF4
Lewis-struktur for SF 4 inneholder fire enkle obligasjoner og en enslig par på svovel atom (se Figur 12).

Figur 12. Lone par elektroner i SF4.
svovel atom har fem electron grupper rundt det, noe som tilsvarer trigonal bipyramidal domene geometri, som i PCl 5 (se Figur 13). Husker at trigonal bipyramidal geometri har tre ekvatorial-atomer og to aksial atomer knyttet til den sentrale atom., På grunn av større frastøting av en enslig par, det er en av de ekvatorial-atomer som er erstattet av en enslig par. Geometrien av molekylet, kalles et forvrengt tetrahedrons eller vippen.

Figur 13. Ball og pinne modell for SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- tilstedeværelsen av lone par elektroner påvirker tre-dimensjonal form av molekylet.
Praksis
Sentral-Atom med Ingen Enslig Par
Bruk linken nedenfor til å besvare følgende spørsmål:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Hva er form av PF 5 ?
- Hva C-H bod vinkler ville vi spår for metan hvis molekylet var plan?
- Hva molekyl har konfigurasjonen av et oktahedron?,
Sentral-Atom med En eller Flere Enslig Par
Bruk linken nedenfor til å besvare følgende spørsmål:
- Hva er det generelle prinsippet i arbeidet med molekyler som inneholder mer enn fire electron par?
- I bildet med fem electron par rundt den sentrale atom, hvorfor er ordningen på høyre foretrukket?
- I bildet med seks electron par, hvorfor er det konfigurasjon med enslig par på 180o til hverandre mer stabil?,
Omtale
Sentral-Atom med Ingen Enslig Par
- Hva er bond vinkler i karbondioksid?
- Hva molekyl har bond vinkler av 109.5 ° ?
- Hva er geometrien av BF 3 molekyl?
Sentral-Atom med En eller Flere Enslig Par
- Hvorfor vannet har en bøyd geometri?
- Hvorfor er ammoniakk ikke en plan molekylet?
- Hvordan ville vi skriver konfigurasjon for xenon tetrafluoride ved hjelp av ABE system?















