17.3: Acid-Bază de Indicatori
Obiectivele de Învățare
- Explicați funcția și modificări de culoare de acid-bază de indicatori
- a Demonstra cum de a selecta corespunzătoare indicator pentru titrarea experiment
- Determinarea acide constantele de disociere Ka sau Kai de indicatori.anumite substanțe organice își schimbă culoarea în soluția diluată atunci când concentrația ionilor de hidroniu atinge o anumită valoare., De exemplu, fenolftaleina este incoloră și substanță în orice soluție apoasă cu o hydronium ion concentrație mai mare de 5,0 × 10-9 M (pH < 8.3). În mai multe soluții de bază în care concentrația ionilor de hidroniu este mai mică de 5,0 × 10-9 m (pH > 8,3), este roșu sau roz. Substanțele cum ar fi fenolftaleina, care pot fi utilizate pentru a determina pH-ul unei soluții, se numesc indicatori acido-bazici. Indicatorii acido-bazici sunt fie acizi organici slabi, fie baze organice slabe.,echilibrul într-o soluție a indicatorului acido-bazic metil orange, un acid slab, poate fi reprezentat printr-o ecuație în care folosim HIn ca o reprezentare simplă pentru molecula complexă de metil orange:
\
\}{}}=4.0×10^{-4}\]anionul de metil portocaliu, In -, este galben, iar forma neionizată, HIn, este roșie. Când adăugăm acid la o soluție de metil portocaliu, concentrația crescută de ioni de hidroniu schimbă echilibrul spre forma roșie neionizată, în conformitate cu principiul lui Le Chatelier. Dacă adăugăm baza, schimbăm echilibrul spre forma galbenă., Acest comportament este complet analog cu acțiunea tampoanelor.
culoarea unui indicator este rezultatul vizibil al raportului dintre concentrațiile celor două specii în− și HIn. Dacă cea mai mare parte a indicatorului (de obicei aproximativ 60-90% sau mai mult) este prezentă ca în−, atunci vedem culoarea In− ion, care ar fi galben pentru portocaliu metil. Dacă majoritatea este prezentă ca HIn, atunci vedem culoarea moleculei HIn: roșu pentru portocaliu metil., Pentru metil orange, putem rearanja ecuația pentru Ka și scrie:
\}{}=\dfrac{}{}=\dfrac{\mathit{K}e un}{}}\]
\}{\mathit{K}e un}=\dfrac{}{}}\]
\}{\mathit{K}e un}\right)=log\left(\dfrac{}{}\right)}\]
\)-log(\mathit{K}e un)=-log\left(\dfrac{}{}\right)}\]
\}{}\right)}\]
\}{}\right)\:sau\:pH=p\mathit{K}E un+log\left(\dfrac{}{}\right)}\]
ultima formula este aceeași ca Henderson-Hasselbalch ecuație, care poate fi folosit pentru a descrie echilibrul de indicatori.,când are aceeași valoare numerică ca Ka, raportul to este egal cu 1, ceea ce înseamnă că 50% din indicator este prezent în forma roșie (HIn) și 50% este în forma ionică galbenă (In−), iar soluția apare de culoare portocalie. Când concentrația ionilor de hidroniu crește la 8 × 10-4 m (un pH de 3,1), soluția devine roșie. Nu este vizibilă nicio modificare a culorii pentru nicio creștere suplimentară a concentrației ionilor de hidroniu (scăderea pH-ului). La o concentrație de ioni de hidroniu de 4 × 10-5 m (un pH de 4.,4), cea mai mare parte a indicatorului este în formă ionică galbenă, iar o scădere suplimentară a concentrației de ioni de hidroniu (creșterea pH-ului) nu produce o schimbare vizibilă a culorii. Intervalul de pH cuprins între 3,1 (roșu) și 4,4 (galben) este intervalul de schimbare a culorii portocalei metil; schimbarea pronunțată a culorii are loc între aceste valori ale pH-ului.multe substanțe diferite pot fi utilizate ca indicatori, în funcție de reacția particulară care trebuie monitorizată., De exemplu, sucul de varză roșie conține un amestec de substanțe colorate care se schimbă de la roșu profund la pH scăzut la albastru deschis la pH intermediar la galben la pH ridicat (figura \(\PageIndex{1}\)). În toate cazurile, însă, un indicator bun trebuie să aibă următoarele proprietăți:
- schimbarea culorii trebuie detectată cu ușurință.
- schimbarea culorii trebuie să fie rapidă.
- molecula indicatoare nu trebuie să reacționeze cu substanța titrată.
- pentru a minimiza erorile, indicatorul trebuie să aibă un pKin care se află într-o unitate de pH a pH-ului așteptat la punctul de echivalență al titrării.,

Figura \(\PageIndex{1}\): Apar în mod Natural pH Indicatori în Suc de Varza Rosie. Imagine curtesty de Wikipedia. suc de varza Rosie contine un amestec de substanțe a căror culoare depinde de pH-ul. Fiecare tub de testare conține o soluție de suc de varză roșie în apă, dar pH-ul soluțiilor variază de la pH = 2.0 (extrema stângă), la pH = 11.0 (extrema dreapta). La pH = 7,0, soluția este albastră.,au fost dezvoltați indicatori sintetici care îndeplinesc aceste criterii și acoperă practic întregul interval de pH. Figura \(\PageIndex{2}\) arată intervalul aproximativ de pH peste care unii indicatori comuni își schimbă culoarea și își schimbă culoarea. În plus, unii indicatori (cum ar fi timolul albastru) sunt acizi sau baze poliprotice, care își schimbă culoarea de două ori la valori ale pH-ului larg separate.
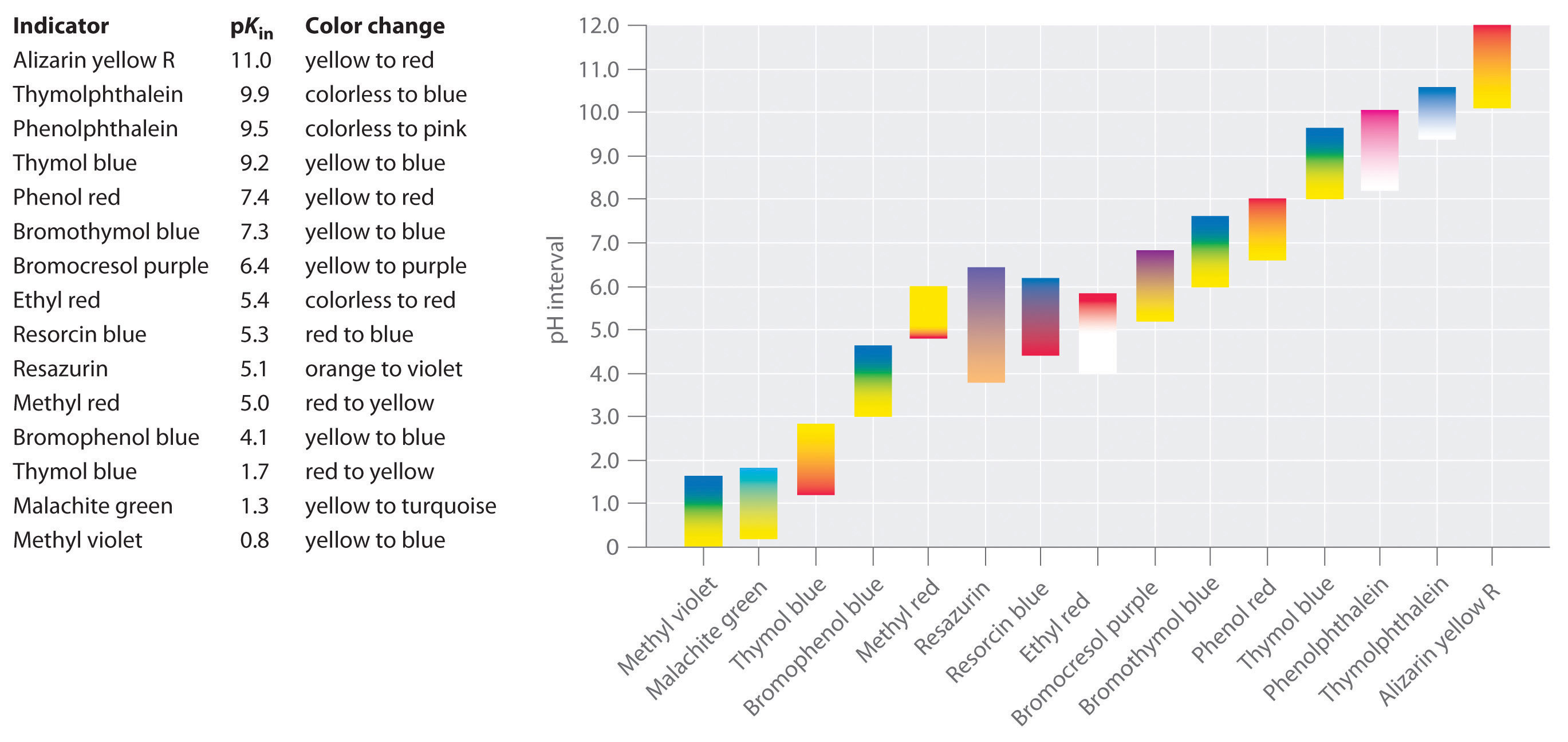
Figura \(\PageIndex{2}\): Unele Comune Acid–Bază de Indicatori., Sunt prezentate culori aproximative, împreună cu valorile pKin și intervalul de pH peste care se schimbă culoarea. este important să fie conștienți de faptul că un indicator nu se schimba culoarea brusc la o anumită valoare a pH-ului; în schimb, că de fapt suferă un pH de titrare la fel ca orice alt acid sau de bază. Pe măsură ce concentrația de HIn scade și concentrația de In− crește, culoarea soluției se schimbă încet de la culoarea caracteristică a HIn la cea A In−. După cum vom vedea în secțiunea 16, raportul / se schimbă de la 0.,1 la un pH o unitate sub pKin la 10 la un pH o unitate deasupra pKin. Astfel, majoritatea indicatorilor își schimbă culoarea într-un interval de pH de aproximativ două unități de pH.
am afirmat că un indicator bun ar trebui să aibă o valoare pKin apropiată de pH-ul așteptat la punctul de echivalență. Pentru o titrare puternică a bazei acide–puternice, alegerea indicatorului nu este deosebit de critică datorită modificării foarte mari a pH-ului care are loc în jurul punctului de echivalență., În schimb, utilizarea indicatorului greșit pentru titrarea unui acid slab sau a unei baze slabe poate duce la erori relativ mari, așa cum este ilustrat în figura \(\PageIndex{3}\). Această figură prezintă parcele de pH față de volumul de bază adăugat pentru titrarea a 50,0 mL dintr-o soluție de 0,100 m dintr-un acid puternic (HCl) și un acid slab (acid acetic) cu 0,100 m \(NaOH\). PH-ul variază peste care doi indicatori comuni (roșu de metil, \(pK_{in} = 5.0\) și fenolftaleină, \(pK_{in} = 9.5\)) își schimbă culoarea., Barele orizontale indică intervalele de pH peste care ambii indicatori își schimbă culoarea traversează curba de titrare a HCl, unde este aproape verticală. Prin urmare, ambii indicatori își schimbă culoarea atunci când, în esență, a fost adăugat același volum de \(NaOH\) (aproximativ 50 mL), ceea ce corespunde punctului de echivalență. În schimb, titrarea acidului acetic va da rezultate foarte diferite, în funcție de utilizarea roșului de metil sau a fenolftaleinei ca indicator., Deși intervalul de pH peste care fenolftaleina își schimbă culoarea este puțin mai mare decât pH-ul la punctul de echivalență al titrării acidului puternic, eroarea va fi neglijabilă datorită pantei acestei porțiuni a curbei de titrare. La fel ca și în cazul titrării HCl, indicatorul de fenolftaleină va deveni roz atunci când aproximativ 50 mL de \(NaOH\) a fost adăugat la soluția de acid acetic. În schimb, roșul de metil începe să se schimbe de la roșu la galben în jurul pH-ului 5, care este aproape de punctul de mijloc al titrării acidului acetic, nu de punctul de echivalență., Prin urmare, adăugarea a aproximativ 25-30 mL de \(NaOH\) va determina schimbarea culorii indicatorului roșu de metil, rezultând o eroare uriașă.
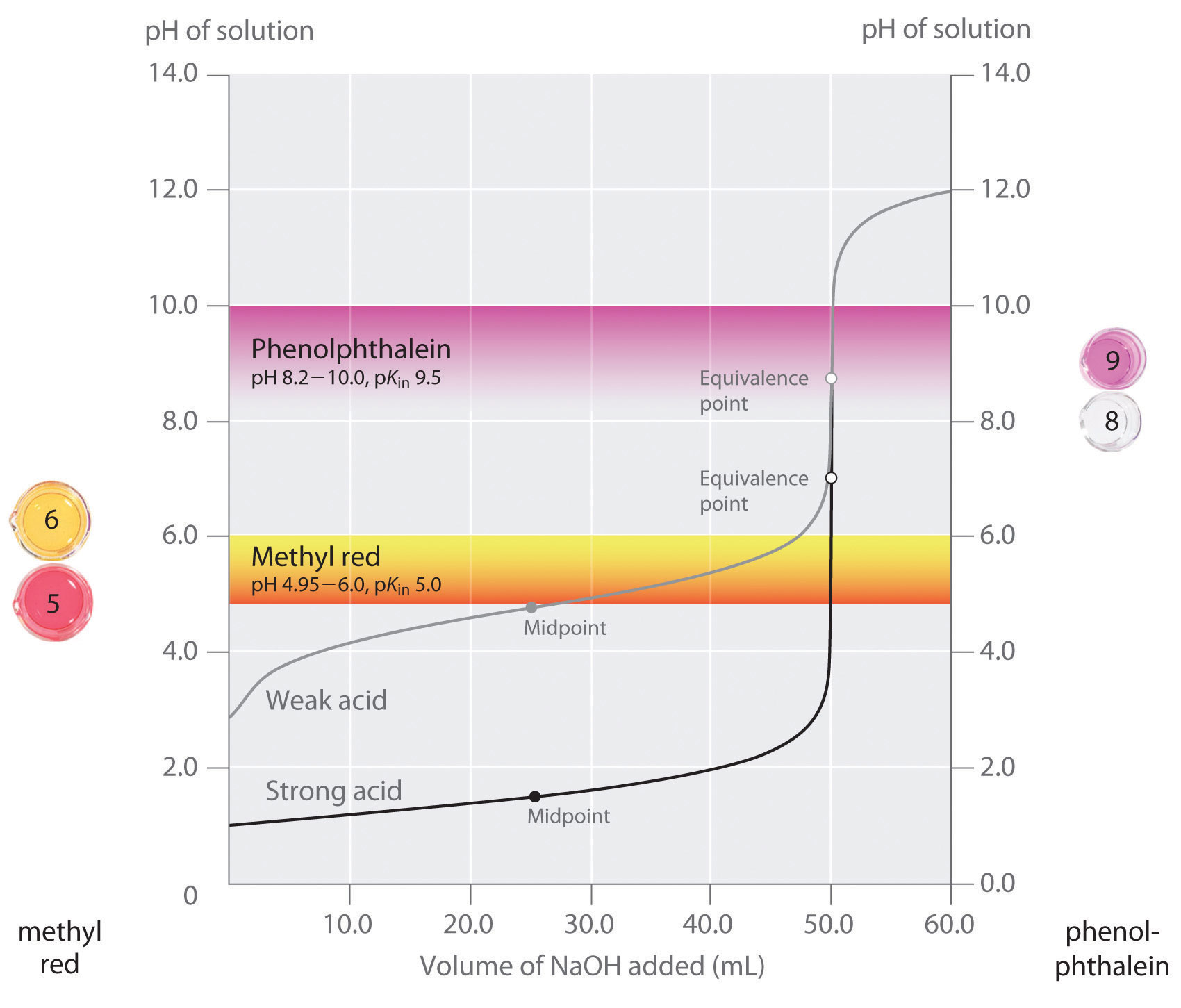
Figura \(\PageIndex{3}\): Alegerea Corectă Indicator pentru Titrarea Acido–bazică graficul prezinta rezultatele obținute folosind doi indicatori (roșu de metil și fenolftaleină) pentru titrarea de 0,100 M soluții de acid tare (HCl) și un acid slab (acid acetic) cu 0.100 M \(NaOH\)., Datorită abruptului curbei de titrare a unui acid puternic în jurul punctului de echivalență, oricare indicator va schimba rapid culoarea la punctul de echivalență pentru titrarea acidului puternic. În schimb, pKin de roșu de metil (5.0) este foarte aproape de valoarea pKa a acidului acetic (4.76); mijloc de schimbare de culoare de roșu de metil are loc în apropiere de mijloc de titrare, mai degrabă decât la punctul de echivalență.în general, pentru titrările acizilor puternici cu baze puternice (și invers), orice indicator cu un pK între aproximativ 4,0 și 10,0 va face., Pentru titrarea unui acid slab, cu toate acestea, pH-ul la punctul de echivalență este mai mare decât 7.0, deci un indicator, cum ar fi fenolftaleină sau timol albastru, cu pKin > 7.0, ar trebui să fie utilizate. În schimb, pentru titrarea de o bază slabă, în cazul în care pH-ul la punctul de echivalență este mai mică decât 7.0, un indicator, cum ar fi roșu de metil sau bromocrezol albastru, cu pKin < 7.0, ar trebui să fie utilizate.
exemplu \(\PageIndex{1}\)
în titrarea unui acid slab cu o bază puternică, care indicator ar fi cea mai bună alegere?,
- Metil Orange
- de Verde de Bromocrezol
- Fenolftaleina
Soluție
raspunsul corect este C. În titrarea unui acid slab cu o bază tare, conjugat bază de acid slab va face ca pH-ul la punctul de echivalență este mai mare decât 7. Prin urmare, ați dori ca un indicator să se schimbe în intervalul de pH. Atât metil portocaliu, cât și bromocrezol verde își schimbă culoarea într-un interval de pH acid, în timp ce fenolftaleina se schimbă într-un pH de bază.,existența multor indicatori diferiți cu culori diferite și valori pKin oferă, de asemenea, o modalitate convenabilă de a estima pH-ul unei soluții fără a utiliza un pH-metru electronic scump și un electrod pH fragil. De hârtie sau de plastic, benzi impregnate cu combinații de indicatori sunt folosite ca „pH hârtie”, care vă permite de a estima pH-ul unei soluții prin simpla scufundare o bucată de pH hârtie în ea și se compară culoarea rezultată cu standardele tipărite pe recipient (Figura \(\PageIndex{4}\)).,
Figura \(\PageIndex{4}\): pH-ul Hârtiei. hârtia pH conține un set de indicatori care schimbă culoarea la diferite valori ale pH-ului. PH-ul aproximativ al unei soluții poate fi determinat prin simpla scufundare a unei benzi de hârtie în soluție și compararea culorii cu standardele furnizate. Sumar
Acid–bază de indicatori sunt compuși care schimba culoarea la un anumit pH., Ele sunt de obicei acizi sau baze slabe ale căror modificări de culoare corespund deprotonării sau protonării indicatorului în sine.
Contribuabili și Atribuții
-
Paul Flori (Universitatea din Carolina de Nord – Pembroke), Klaus Theopold (Universitatea din Delaware) și Richard Langley (Stephen F. Austin Universitatea de Stat), cu contribuția autorilor. Conținutul manualului produs de OpenStax College este licențiat sub licența Creative Commons Attribution License 4.0. Descărcați gratuit la http://cnx.org/contents/85abf193-2bd…[email protected]).
- {șablon.,ContribBoundless()}}















