chimie pentru non-Majors (Română)
obiective de învățare
- descrie molecule ale căror forme sunt influențate de teoria VSEPR.
- definiți perechea singuratică.
- descrieți modul în care electronii perechii singure influențează geometria moleculară.
cum funcționează un electroscop?
un electroscop este un dispozitiv folosit pentru a studia încărcarea. Când un obiect încărcat pozitiv (tija) se apropie de stâlpul superior, electronii curg spre partea superioară a borcanului lăsând cele două frunze de aur încărcate postivley., Frunzele se resping reciproc, deoarece ambele dețin postive, cum ar fi taxele. Teoria VSEPR spune că perechile de electroni, de asemenea, un set de sarcini similare, se vor respinge reciproc, astfel încât forma moleculei se va ajusta astfel încât perechile de electroni de valență să rămână cât mai departe unul de celălalt.

Atom Central fără perechi singulare
pentru a înțelege cu ușurință tipurile de molecule posibile, vom folosi un sistem simplu pentru a identifica părțile oricărei molecule.,
A = atomul central într-o moleculă
b = atomii care înconjoară atomul central
indiciile după B vor indica numărul de atomi B care sunt legați de atomul central A. De exemplu, AB 4 este o moleculă cu un atom central înconjurat de patru atomi legați covalent. Din nou, nu contează dacă aceste obligațiuni sunt obligațiuni simple, duble sau triple.
AB2: hidrura de beriliu (BeH2)
hidrura de beriliu constă dintr-un atom central de beriliu cu două legături unice la atomii de hidrogen. Reamintim că încalcă regula octet.,Conform cerinței ca perechile de electroni să-și maximizeze distanța una de cealaltă, cele două perechi de legare din moleculele BeH 2 se vor aranja pe laturile direct opuse ale atomului central Be. Geometria rezultată este o moleculă liniară, prezentată în Figura 1 într-un model „minge și băț”.

Figura 1. Modelul hidrură de beriliu.unghiul de legătură de la H-Be-H este de 180° datorită geometriei sale liniare.,dioxidul de Carbon este un alt exemplu de moleculă care se încadrează în categoria AB 2. Structura sa Lewis constă în legături duble între carbonul central și atomii de oxigen (vezi Figura 2).

Figura 2. Lipirea dioxidului de Carbon.repulsia dintre cele două grupuri de patru electroni (două perechi) nu este diferită de repulsia celor două grupuri de doi electroni (o pereche) din molecula BeH 2. Dioxidul de Carbon este, de asemenea, liniar (vezi Figura 3).,

Figura 3. Dioxid de Carbon.
AB3: Trifluorură de Bor (BF3)
trifluorură de Bor este format dintr-o centrală bor atom cu trei single obligațiuni cu atomi de fluor (a se vedea Figura 4). Atomul de bor are, de asemenea, un octet incomplet.
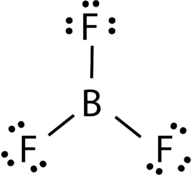
Figura 4. Lipirea trifluorurii de bor.
geometria moleculei BF 3 se numește trigonal planar (vezi Figura 5). Atomii de fluor sunt poziționați la vârfurile unui triunghi echilateral., Unghiul F-B-F este de 120° și toți cei patru atomi se află în același plan.

Figura 5. Modelul trifluorurii de bor.
AB4: Metan (CH4)
metanul este un compus organic care este componenta primară a gazului natural. Structura sa constă dintr-un atom de carbon central cu patru legături unice la atomii de hidrogen (vezi Figura 6). Pentru a maximiza distanța dintre ele, cele patru grupuri de electroni de legătură nu se află în același plan., În schimb, fiecare dintre atomii de hidrogen se află la colțurile unei forme geometrice numite tetraedru. Atomul de carbon se află în centrul tetraedrului. Fiecare față a unui tetraedru este un triunghi echilateral.

Figura 6. Structura tetraedrică a metanului.geometria moleculară a moleculei de metan este tetraedrică (vezi Figura 7). Unghiurile de legătură H-C-H sunt de 109,5°, care este mai mare decât 90° care ar fi dacă molecula ar fi plană., Atunci când se desenează o formulă structurală pentru o moleculă, cum ar fi metanul, este avantajos să se poată indica caracterul tridimensional al formei sale. Formula structurală de mai jos se numește desen în perspectivă. Legătura de linie punctată trebuie vizualizată ca retrăgându-se în pagină, în timp ce legătura triunghiulară solidă trebuie vizualizată ca ieșind din pagină.

Figura 7. Model de perspectivă metan.
cum se pot potrivi toate aceste haine într-un spațiu atât de mic?,
când călătorim, luăm adesea mult mai multe lucruri decât avem nevoie. Încercarea de a potrivi totul într-o valiză poate fi o adevărată provocare. S-ar putea să trebuiască să împachetăm sau să strângem totul. Atomii trebuie adesea să rearanjeze unde sunt electronii pentru a crea o structură mai stabilă.

atomul Central cu una sau mai multe perechi singuratice
geometriile moleculare ale moleculelor se schimbă atunci când atomul central are una sau mai multe perechi singuratice de electroni., Numărul total de perechi de electroni, atât perechi de legare cât și perechi singuratice, duce la ceea ce se numește geometria domeniului de electroni. Când una sau mai multe perechi de electroni de legătură sunt înlocuite cu o pereche singură, geometria moleculară (forma reală) a moleculei este modificată. În conformitate cu simbolurile A și B stabilite în secțiunea anterioară, vom folosi E pentru a reprezenta o pereche singură pe atomul central (A). Un indice va fi utilizat atunci când există mai mult de o pereche singuratic. Perechile Lone pe atomii din jur (B) nu afectează geometria.,
AB3E: amoniac, NH3
molecula de amoniac conține trei legături unice și o singură pereche pe atomul central de azot (vezi Figura 8).

Figura 8. Electroni singuratici în amoniac.
geometria domeniului pentru o moleculă cu patru perechi de electroni este tetraedrică, așa cum s-a văzut cu CH 4 . În molecula de amoniac, una dintre perechile de electroni este o pereche singură, mai degrabă decât o pereche de lipire. Geometria moleculară a NH 3 se numește piramidală trigonală (vezi Figura 9).,

Figura 9. Moleculă de amoniac.reamintim că unghiul de legătură în molecula tetraedrică CH 4 este de 109,5°. Din nou, înlocuirea uneia dintre perechile de electroni legați cu o pereche singură comprimă ușor unghiul. Unghiul H-N-H este de aproximativ 107°.
AB2E2: apă, H2O
o moleculă de apă constă din două perechi de legare și două perechi singulare (vezi Figura 10).

Figura 10. Electroni singuri pe apă.,în ceea ce privește metanul și amoniacul, geometria domeniului pentru o moleculă cu patru perechi de electroni este tetraedrică. În molecula de apă, două dintre perechile de electroni sunt perechi singuratice, mai degrabă decât perechi de legare. Geometria moleculară a moleculei de apă este îndoită. Unghiul de legătură H-O-H este de 104,5°, care este mai mic decât unghiul de legătură din NH3 (vezi Figura 11).

Figura 11. Moleculă de apă.,
AB4E: Sulf Tetrafluoride, SF4
structura Lewis pentru SF 4 conține patru single obligațiuni și o singură pereche pe atomul de sulf (vezi Figura 12).

Figura 12. Electroni pereche singuratic în SF4.atomul de sulf are cinci grupuri de electroni în jurul său, ceea ce corespunde geometriei domeniului bipiramidal trigonal, ca în PCl 5 (vezi Figura 13). Reamintim că geometria bipiramidală trigonală are trei atomi ecuatoriali și doi atomi axiali atașați la atomul central., Din cauza repulsiei mai mari a unei perechi singuratice, este unul dintre atomii ecuatoriali care sunt înlocuiți de o pereche singuratică. Geometria moleculei se numește tetraedru distorsionat sau balansoar.

Figura 13. Ball și stick model pentru SF4 .,>SF4
Summary
- Electron pairs repel each other and influence bond angles and molecular shape.,
- prezența electronilor perechii singure influențează forma tridimensională a moleculei.
Practica
Atom Central cu Nr Singuratic Perechi
Folositi link-ul de mai jos pentru a răspunde la următoarele întrebări:
http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/vsepr.html
- Ce este forma de PF 5 ?
- ce unghiuri C-H bod am prezice pentru metan dacă molecula ar fi plană?
- ce moleculă are configurația unui octaedru?,
Atom Central cu una sau mai multe perechi singulare
utilizați linkul de mai jos pentru a răspunde la următoarele întrebări:
- care este principiul general în tratarea moleculelor care conțin mai mult de patru perechi de electroni?
- în imagine cu cinci perechi de electroni în jurul atomului central, de ce este preferat aranjamentul din dreapta?
- în imagine cu șase perechi de electroni, de ce configurația cu perechile singure la 180o între ele este mai stabilă?,
recenzie
Atom Central fără perechi singuratice
- care sunt unghiurile de legătură în dioxidul de carbon?
- ce moleculă are unghiuri de legătură de 109,5 ° ?
- care este geometria moleculei BF 3?
Atom Central cu una sau mai multe perechi singuratice
- De ce apa are o geometrie îndoită?
- De ce amoniacul nu este o moleculă plană?
- cum am scrie configurația pentru tetrafluorura de xenon folosind sistemul ABE?















