Frontiere în Endocrinologie
Introducere
gene supresoare tumorale TP53 a fost cel mai intens studiat de gene umane de la descoperirea sa de aproape 40 de ani (1). Principalul motiv din spatele acestui statut este rolul critic pe care p53 îl joacă în prevenirea dezvoltării cancerului și este considerat pe scară largă drept „gardianul genomului.,”De ceva timp s-a crezut, în general, că rolul p53 în suprimarea tumorii este în virtutea capacității sale de a induce apoptoza, stoparea ciclului celular și senescența celulelor precanceroase (2). Cu toate acestea, acum este din ce în ce mai clar că p53 reglează multe alte căi din celulă și că aceste alte căi joacă, de asemenea, roluri în capacitatea p53 de a funcționa ca supresor tumoral (3). În special, rolul p53 în reglarea genelor implicate în metabolism și ferroptoză a fost implicat în capacitatea sa de a suprima dezvoltarea tumorii., Ferroptoza este o nouă cale de moarte celulară caracterizată pentru prima dată în 2012 și poate fi descrisă cel mai bine ca o formă de moarte celulară dependentă de fier, independentă de caspază, determinată de formarea peroxidării lipidelor (4). În mod special, două modele de mouse-uri care conțin proiectat mutații ale p53, care elimina posibilitatea de p53 induce apoptoza și senescența ambele păstrează capacitatea de a suprima spontană dezvoltarea tumorii; ambele aceste mutanți și păstreze capacitatea de a transactivate gene în metabolismul și ferroptosis (5, 6)., Un rezumat al datelor care implică p53 în reglarea metabolismului și a ferroptozei este detaliat mai jos.
de Tip Sălbatic (WT) p53 Pozitiv Reglementează Fosforilării Oxidative și Suprima Metabolismul Glucozei
tip Sălbatic p53 reglementează metabolice versatilitatea de celule, prin favorizarea respirației mitocondriale peste glicoliză, în parte prin intermediul transactivation de SCO2 (citocrom c oxidaza asamblare), care joacă un rol direct în fosforilării oxidative (7)., p53 reglează, de asemenea, direct transactivarea GLS2 (Glutaminaza 2); această enzimă permite utilizarea glutaminei ca sursă de energie pentru mitocondrii (8). În plus, WT p53 negativ reglementează glicoliza de transcriptionally reprimarea glucoza transportatorii GLUT1 și GLUT4, și de transactivating RRAD și TIGAR; ambele sunt inhibitori de glicoliza (9-11). În cele din urmă, p53 se leagă direct și inhibă enzima glucoză-6-fosfat dehidrogenază, suprimând astfel metabolismul glucozei (12)., Este clar din aceste și alte studii că, în organismele normale, netensionate, p53 reglează direct starea metabolică într-o celulă (Figura 1). Nu este surprinzător că această genă și mulți dintre regulatorii săi sunt implicați în boli metabolice, inclusiv obezitate și diabet (13).
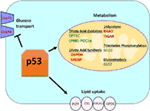
Figura 1. Rolul tipului sălbatic (WT) p53 în metabolism. Genele reglate pozitiv de p53 sunt arătate în verde, iar genele reglate negativ de p53 sunt arătate în roșu., p53 inhibă transportul glucozei, glicoliza și sinteza acizilor grași, în timp ce promovează absorbția lipidelor, oxidarea acizilor grași, fosforilarea oxidativă și glutaminoliza.mutantul p53 reglează pozitiv metabolismul Warburg (glicoliza aerobă)
spre deosebire de funcția WT p53, mutantul p53 din celulele tumorale favorizează glicoliza aerobă, în parte prin intensificarea traficului transportorului de glucoză GLUT1 către membrana plasmatică, crescând astfel importul de glucoză (14, 15)., În urma mutația p53, nivelurile reduse de SCO2 și GLS2 și nivelurile crescute de GLUT1 și GLUT4 favorizează glicoliza aerobă peste fosforilării oxidative. În acest mod, se crede că mutantul p53 contribuie la tendința celulelor tumorale de a utiliza glicoliza aerobă în favoarea fosforilării oxidative sau a așa-numitului metabolism Warburg (15). Unul dintre semnele distinctive ale cancerului este metabolismul dereglat, demonstrat în general prin această trecere de la glicoliza aerobă la fosforilarea oxidativă., Deși acest lucru are ca rezultat un randament ATP mai mic și mai puțin eficient, se crede că celulele canceroase beneficiază prin devierea intermediarilor glicolitici către căile biosintetice necesare diviziunii celulare rapide (16). Acest comutator metabolic duce, de asemenea, la scăderea apoptozei mediate de mitocondrii și la o semnalizare mai eficientă prin metaboliții disponibili în celulele canceroase (17).
o variantă genetică comună în TP53 influențează funcția sa în Metabolism
există un polimorfism comun al regiunii de codificare a p53 la codonul 72, care codifică fie prolină (P72), fie arginină (R72)., Această variație de aminoacizi poate afecta funcția p53 în ceea ce privește soarta celulelor după stres. Ca răspuns la deteriorarea ADN-ului, varianta P72 a p53 declanșează predominant oprirea ciclului celular, în timp ce varianta R72 induce predominant moartea celulară sau apoptoza (18, 19). În ciuda acestor diferențe funcționale, variația codonului 72 nu a fost asociată în mod constant cu susceptibilitatea la cancer (20). În schimb, în studiile umane, acest polimorfism este semnificativ asociat cu creșterea indicelui de masă corporală și a riscului de diabet (21, 22)., Această premisă este susținută de studii la șoareci, unde un model de șoarece pentru aceste variante codon 72 arată creșterea diabetului indus de dietă bogată în grăsimi la șoareci cu varianta R72, comparativ cu P72. În aceste studii, genele țintă p53 TNFa și NPC1L1 au fost identificate ca regulatori critici în creșterea obezității induse de dietă la șoarecii R72 (23). Interesant, varianta R72 sa dovedit, de asemenea, că conferă o supraviețuire crescută a celulelor ca răspuns la privarea de nutrienți (24)., Aceste constatări au condus la ipoteza că varianta R72 a p53 a apărut și a fost selectată pentru populațiile migrate spre nord, unde vremea rece ar necesita o acumulare crescută de grăsimi, dar unde supraviețuirea ca răspuns la privarea de nutrienți ar fi, de asemenea, în curs de selecție (24).deși p53 este bine cunoscut pentru reglarea glicolizei și a ciclului acidului citric, p53 sa dovedit, de asemenea, că joacă un rol în reglarea metabolismului lipidic (25)., Se crede că WT p53 îmbunătățește oxidarea acizilor grași în timp ce inhibă sinteza acizilor grași, acționând astfel ca un regulator negativ al sintezei lipidelor (25). Există mai multe gene țintă p53 cu roluri în metabolismul lipidic. Sanchez-Macedo și colegii săi au demonstrat că carnitina palmitoyltransferase 1C (CPT1C) este transcriptionally reglementate de p53; această enzimă ajută la transportul de activat acizi grasi la mitocondrii., În sprijinul unui rol pentru această genă reglementată de p53 în cancer, acest grup a arătat că șoarecii cu deficit de cpt1c prezintă o dezvoltare întârziată a tumorii și rate de supraviețuire mai mari (26). Lipina 1 (LPIN1) este o altă genă țintă p53; LPIN1 este necesară pentru dezvoltarea adecvată a adipocitelor și este indusă în condiții nutritive scăzute (27). Finck și colegii săi au arătat că LPIN1 interacționează cu PGC-1α, un alt cunoscut p53 gena țintă cu rol în metabolism, și că această interacțiune activează expresia genelor implicate în promovarea oxidării acizilor grași (28).,pe lângă reglarea directă a transcripției genelor implicate în metabolismul lipidic, p53 poate regla și metabolismul lipidic într–o manieră care implică interacțiunea directă proteină-proteină. De exemplu, glucoza-6-fosfat dehidrogenaza, care este enzima care limitează viteza în calea fosfatului de pentoză, se leagă și este direct inhibată de p53, ducând la scăderea producției de NADPH și, în consecință, scăderea sintezei acizilor grași (12)., De sterol regulatory element-binding proteine (SREBP) familie de factori de transcriere modulează expresia genelor implicate în colesterol, acizi grași, triacilglicerol, și sinteza de fosfolipide (29-31). WT p53 reprima SREBP funcția (32), în timp ce forme mutante ale p53 lega direct la SREBP și de a spori lor transcripțional funcția, ceea ce duce la creșterea SREBP activitate în tumorile umane (33, 34). În consecință, p53 mutant este corelat cu expresia mai mare a genelor de biosinteză a sterolului în tumorile mamare umane (34, 35)., În cele din urmă, protein kinaza activată de AMP (AMPK) este o enzimă care este activată sub niveluri scăzute de nutrienți sau stres energetic și este cunoscută că inhibă sinteza acizilor grași prin interacțiunea cu acetil-CoA-carboxilaza și SREBP-1 (36, 37). Zhou si colegii sai au demonstrat ca p53 mutant se leagă în mod preferențial și inhibă AMPK, ceea ce duce la creșterea sintezei acizilor grași. Ca rezultat, proteinele p53 mutante duc la creșterea semnalizării AMPK, contribuind la creșterea celulelor invazive a celulelor tumorale (33). O zonă mai puțin explorată este rolul p53 în transportul lipidelor., S-a demonstrat că p53 reglează transcripțional apolipoproteina B (apoB) și complexul enzimatic de editare apoB 1, indicând rolul p53 în reglarea lipoproteinelor aterogene (38). Analiza Microarray a celulelor derivate din ficat uman a identificat proteina de transfer a fosfolipidelor, caseta de legare a ATP A12 și lipaza carboxil ester ca trei gene țintă p53 care joacă un rol în transportul lipidelor (39, 40)., În general, deși este clar că p53 joacă un rol cheie în medierea sintezei lipidelor și a metabolismului, contribuția acestei căi și a acestor gene țintă p53 la suprimarea tumorii de către p53 rămâne de determinat (Figura 1).
Ferroptoza este o nouă cale de moarte celulară condusă de peroxidarea lipidelor
În 2012, Dixon și colegii au descoperit o nouă formă de moarte celulară reglementată numită ferroptoză. Ferroptoza este o formă de moarte celulară dependentă de fier, caspază, care rezultă din acumularea de lipide oxidate (4, 41)., Acest proces este condus de inactivarea glutation peroxidazei 4 (GPX4), o enzimă care este responsabilă pentru transformarea hidroperoxizilor lipidici letali în alcooli lipidici netoxici, care necesită glutation pentru a funcționa (41). Se crede că peroxidarea acizilor grași polinesaturați (PUFA) este impulsul de conducere pentru moartea celulelor prin ferroptoză. PUFA-urile conțin protoni bis-alilici care pot fi ușor captați și produc radicali care vor reacționa cu oxigenul, creând mai mulți radicali și rezultând o reacție în lanț a speciilor de oxigen reactiv lipidic (42)., Mecanismul exact al morții celulare prin ferroptoză rămâne necunoscut, dar o ipoteză este că deteriorarea lipidelor duce la distrugerea membranei plasmatice (43). S-a speculat că ferroptoza ar putea fi un mecanism de suprimare a tumorii care funcționează prin eliminarea celulelor care sunt lipsite de nutrienți sau au fost expuse la un stres sau infecție de mediu.,
Farmacologic Regulamentul de Ferroptosis
Ferroptosis poate fi indusă folosind inhibitori de sistem xc− cum ar fi erastin, sau analogii, cum ar fi glutamat și sorafenib, care inhiba importul de cistină, care rezultă în epuizate glutation și, ulterior, inactivarea GPX4. Alternativ, ferroptosis poate fi indusă prin (1S,3R)-RSL3 (denumit în continuare RSL3), care în mod direct se leagă și inhibă GPX4 (4, 5, 42). Buthione sulfoximine, FIN56, FINO2, CCl4, și cisplatină sunt și alți agenți care au fost demonstrate pentru a induce ferroptosis în celule., Moartea prin ferroptosis pot fi prevenite prin suprimarea peroxidarea lipidelor, care poate fi realizată prin utilizarea lipofile antioxidanti, cum ar fi ferrostatin-1, liproxstatin-1, sau vitamina E. chelatori de Fier, cum ar fi deferoxamina sau cicloprox sunt un alt instrument folosit pentru a suprima ferroptosis prin reducerea nivelurilor de fier. Epuizarea PUFA sau adăugarea de acizi grași mononesaturați în mediile de cultură celulară poate, de asemenea, să salveze celulele de ferroptoză (42, 44).,
Ferroptosis este Implicat într-p53-Mediată Suprimarea Tumorii
În 2012, Gu și colegii dezvoltat un model de mouse-ul, în cazul în care, în mod normal, acetilat reziduuri de lizină în ADN-domeniu de legare a p53 au fost mutate în arginină, și, prin urmare, nu ar putea fi acetilate; acest mouse-ul este menționată ca 3KR mouse-ul. În special, în celulele din 3KR mouse-ul nu sunt în măsură să se supună p53 dependente de apoptoza, arestarea ciclului celular, sau senescență, și într-adevăr 3KR mutant de p53 nu reușește să transactivate majoritatea p53 genelor țintă., Interesant este că acest model de șoarece nu dezvoltă spontan cancer, ceea ce implică faptul că p53 ar putea suprima dezvoltarea tumorii independent de senescență sau apoptoză (45). Acest grup a constatat că mutant 3KR proteine păstrează capacitatea de a suferi ferroptosis și de a reglementa cistină metabolismul prin reglementarea expresia de cistină importator SLC7A11; acest lucru a sugerat că ferroptosis ar putea fi o cale care stă la baza p53 mediate suprimarea tumorii., Când tipul sălbatic și 3KR MEFs au fost tratați cu ferroptosis inductor Erastin, aproape 50% moartea celulelor fost observate întrucât p53 null MEFs expuse 20% celule moarte; acest lucru indică faptul că p53 sensibilizează celulele să ferroptosis, și, de asemenea, că alte reglementare cheie, de asemenea, joacă un rol în ferroptosis (5). Ulterior, Gu și colegii săi au identificat o suplimentare de acetilare site-ul de la lizină 98 de p53, și au generat un model de mouse-ul, în care toate cele patru acetilare site-uri au fost mutate în arginină (4KR)., Interesant, 4KR mutant a fost în imposibilitatea de a reglementa gene implicate în ferroptosis ca SLC7A11, și spre deosebire de 3KR mutant a fost în imposibilitatea de a suprima dezvoltarea tumorii (46). Deși în prezent corelativ, aceste date implică rolul p53 în ferroptoză în capacitatea sa de a suprima dezvoltarea tumorii.
În Non-Celulele Transformate, p53 Pozitiv Reglementează Ferroptosis
În plus față de SLC7A11, mai multe alte directe p53 țintă gene au fost descoperite pentru a juca un rol în ferroptosis. Acestea includ GLS2, PTGS2 și SAT1., Studiile din două grupuri separate susțin rolul GLS2 în ferroptoză, despre care se știe că scade glutationul și crește nivelurile celulare de ROS. Jiang și colegii folosit ferroptosis inhibitori combinate cu glutaminolysis inhibitori pentru a inhiba Erastin induse de ferroptosis, demonstrând astfel că ferroptosis necesită glutaminolysis și GLS2 (47). Murphy și colegii săi au arătat că un polimorfă varianta de p53 a fost capabil de a induce creștere de arestare și degenerescență în ambele umană și murină celule, dar nu a reușit să reprime SLC7A11 sau transactivate GLS2., Această variantă a fost afectată semnificativ la inducerea ferroptozei și suprimarea dezvoltării tumorii, implicând din nou rolul p53 în supresia tumorii mediată de ferroptoză (48). O altă genă țintă p53 cu rol în ferroptoză este PTGS2, o genă care codifică enzima ciclooxigenază-2. Stockwell si colegii sai au aratat mai intai ca inducerea ferroptozei folosind Erastin si RSL3 a dus la upregulation de PTGS2 (41). În special, PTGS2 nu a fost reglat de inductorii de ferroptoză în celulele p53-null, sugerând că această reglementare este dependentă de p53 (5)., În prezent, upregulation de PTGS2 este utilizat pe scară largă ca un marker ferroptosis (5, 41).un studiu recent realizat de grupul Gu a arătat că gena țintă p53 SAT1 reglează ferroptoza (49). Autorii au identificat SAT1 ca o țintă directă a p53 și au arătat că tăcerea SAT1 a redus moartea celulelor indusă de speciile reactive de oxigen în celulele cu WT p53, dar nu a avut efect în celulele p53-nule. Din punct de vedere mecanic, acest grup a arătat că SAT1 crește nivelul și activitatea arahidonatului 15-lipoxigenazei, o enzimă care leagă fierul care oxidează PUFA și crește peroxidarea lipidelor., În special, acest studiu a arătat că nici p53, nici SAT1 în monoterapie nu par a fi suficiente pentru a induce ferroptoza. În schimb, datele combinate sunt mult mai consistente cu premisa că p53, în virtutea reglementării gene care contribuie la ferroptosis, regleaza sensibilitatea celulelor la aceasta cale, mai degrabă decât direct induce ferroptosis. Rămâne de determinat dacă p53 reglează alte gene implicate în ferroptoză (Figura 2).
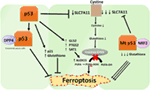
Figura 2. Diferitele roluri ale p53 în ferroptoză., Inhibarea glutation peroxidazei 4 (GPX4), enzima cheie care catalizează conversia acizilor grași polinesaturați (PUFA) care conțin peroxizi în alcooli, este motorul cheie al ferroptozei. În funcție de context, p53 poate suprima ferroptoza (cum ar fi în celulele canceroase colorectale) sau poate promova ferroptoza. Mutantul p53 sensibilizează celulele la ferroptoză chiar mai mult decât p53 de tip sălbatic.,
În Unele Celule, p53 Negativ Reglementează Ferroptosis
Un studiu recent publicat de Tarangelo și colegii săi arată că p53 negativ reglementează ferroptosis în celulele canceroase (50). Acest grup a constatat că pre-tratarea celulelor cu Nutlin-3, un compus care stabilizează p53 întârzie debutul ferroptosis în mai multe tipuri de celule. S-a constatat că debutul întârziat al ferroptozei depinde de CDKN1A (codificarea p21), o țintă transcripțională critică p53., Mecanismul prin care p21 întârzieri ferroptosis a fost încă elucidat, dar se crede că de conservare de glutation intracelular poate fi un factor care contribuie la reducerea ferroptosis sensibilitate. Autorii concluzionează că axa p53–p21 permite celulelor canceroase să supraviețuiască în condiții de stres metabolic, cum ar fi privarea de cistină, prin suprimarea debutului ferroptozei (50). Un studiu recent a arătat că p53 inhibă ferroptosis în cancerul colorectal celule prin legarea enzimei dipeptidil-peptidazei-4 (DPP4), care este un modulator de ferroptosis și metabolismul lipidic., Mecanic, acest studiu a arătat că p53 antagonizează ferroptosis prin punerea sub sechestru a DPP4 într-un nucleare enzimatice inactiv piscină. În absența p53, DPP4 este gratuit pentru a interacționa cu și de a forma un complex cu NOX1; acest lucru duce la creșterea peroxidării lipidelor și ferroptosis. Inhibarea DPP4 suprimă ferroptosis în mod semnificativ, întrucât supraexprimarea de DPP4 declanșează Erastin sensibilitate, în special în p53 depleție de celule (51). Controlul bidirecțional al ferroptozei de către p53 prin mecanisme dependente de transcripție și independente de transcripție poate fi dependent de context sau de tip celular (Figura 2).,
P47S Polimorfismul TP53 Afectează Ferroptosis și Suprimarea Tumorii
În plus față de mutații missense, există mai multe funcțional semnificativ single-nucleotide polymorphisms (Snp) în gena TP53 și alte proteine cunoscute pentru a reglementa această cale (cum ar fi MDM2 și MDM4). La Pro47Ser variant (denumită în continuare S47) este al doilea cel mai comun SNP a fost găsit în p53 regiunea de codificare (după Pro72Arg) care modifică secvența de aminoacizi a proteinei., La mai bine elucida impactul acestei variante pe p53 funcție și riscul de cancer, grupul Murphy a generat o umanizat p53 knock-in, mouse-ul model, în care exoni 4-9 proteinei p53 au fost înlocuite de om p53 exoni care conțin fie de tip sălbatic sau S47 variant (52-55). Majoritatea șoarecilor S47 au dezvoltat spontan tumori de diferite tipuri histologice, în special cancer la ficat, cu vârsta cuprinsă între 12 și 18 luni, spre deosebire de șoarecii WT p53 (48)., În fibroblastele embrionare de șoarece și liniile celulare limfoblastoide umane, varianta S47 a prezentat o moarte celulară programată afectată ca răspuns la cisplatină și alte stresuri genotoxice. În mod mecanic, la S47 varianta este defect pentru transactivation de gene implicate în metabolismul, cum ar fi Gls2 (glutaminase 2) și Sco2 (48). În concordanță cu rolul de Gls2 în ferroptosis, acest grup a constatat că S47 celulele au fost semnificativ rezistente la ferroptosis-inducerea agenți Erastin și RSL3 (47, 48). Acest defect poate contribui la fenotipul predispus la tumori observat la șoarecii S47.,
p53 Mutanta Sensibilizează Celulele Tumorale pentru a Ferroptosis
tip Sălbatic p53 negativ regleaza expresia de cistină importator SLC7A11, care inhibă sensibilitatea la ferroptosis (5). Deși această reglementare are loc în celulele normale, în celulele tumorale, alți mediatori ai SLC7A11 par să predomine în reglarea acestei gene. De exemplu, maestrul antioxidant factor de transcriere NRF2 poate reglementa, de asemenea, expresia de SLC7A11 la nivel transcripțional, și NRF2 a fost implicat ca un jucător-cheie în protejarea celulelor canceroase împotriva ferroptosis., De exemplu, inhibarea NRF2 în celulele canceroase hepatocelulare crește activitatea anti-cancer a Erastin și Sorafenib in vivo (56). Forme mutante ale p53 poate inhiba NRF2 funcție de interacțiunea directă, și un grup constatat că tumorile cu p53 mutanta conțin niveluri foarte scăzute de SLC7A11, și, astfel, arată sensibilitate crescută la ferroptosis. În special, supraexprimarea de SLC7A11 în p53 mutanta modele de led-uri pentru a rezistenței la medicamente, ceea ce sugerează că nivelurile de SLC7A11 exprimare trebuie să fie luate în considerare atunci când vizează p53 mutanta condus de cancer cu ferroptosis-inducerea compuși (57)., În sprijinul acestei premise, lucrările recente în cancerul colorectal (CRC), unde mutația sau ștergerea p53 este un eveniment frecvent, au arătat că liniile celulare CRC umane care adăpostesc p53 mutant au fost mult mai sensibile la moartea celulară mediată de Erastin în comparație cu celulele CRC cu WT p53. Pentru a valida aceste rezultate au arătat că bat într-un p53 hotspot mutație în ambele HCT116 și SW48 celule restaurat sensibilitate la Erastin (51). Aceste date evidențiază un mecanism nou prin care cancerele conduse de p53 mutante pot fi exploatate folosind terapia vizată.,
concluzie
rolul p53 în metabolism este destul de clar și posibil chiar intuitiv evident: WT p53 limitează metabolismul glucozei și sinteza lipidelor, în timp ce mutantul p53 pare să facă contrariul. Contribuția rolului său metabolic la suprimarea tumorii de către p53 și la capacitatea mutantului p53 de a conduce progresia tumorii rămâne să fie dovedită fără echivoc. Rolul p53 în reglarea ferroptozei și contribuția acestei funcții la suprimarea tumorii este și mai puțin clară., În timp ce convingătoare date de modele de mouse-ul acceptă premisa că p53 regleaza sensibilitatea celulelor la ferroptosis, acest lucru poate fi limitat la capacitatea bazale p53 a suprima spontană dezvoltarea tumorii, și în oncogene-a subliniat modele de mouse-ul, este clar că senescența și apoptoza joace rolul predominant. În mod similar, p53 poate regla sensibilitatea ferroptozei într-o manieră specifică tipului de celulă. Mai multe studii pe modele animale, cu atenție la ferroptosis în diferite țesuturi, trebuie să fie făcut să înțeleagă mai bine rolul p53 în ferroptosis și ferroptosis în suprimarea tumorii., În plus, trebuie obținută o idee mai clară despre ce gene țintă p53 joacă un rol în sensibilitatea la ferroptoză. Rezolvarea acestor întrebări ar trebui să prevadă căi noi de combatere a tumorilor cu p53 mutant.
contribuțiile autorului
KG, SB, TB, AB-K, C-PK și MM au scris fiecare unul până la două paragrafe ale acestui articol. KG și SB au făcut cifra. KG și MM au subliniat capitolul.,
Declarație privind conflictul de interese
autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
recenzorul OAF și editorul handling și-au declarat afilierea comună.
Aprecieri
de Cercetare a raportat în această publicație a fost susținută de către Institutele Naționale de Sănătate din cadrul Numere de Atribuire CA102184 (MM), CA201430 (MM), TL1TR002344 (C-PK), și T32 CA009171 (TB)., Conținutul este exclusiv responsabilitatea autorilor și nu reprezintă în mod necesar opiniile oficiale ale institutelor naționale de sănătate.
3. Humpton TJ, Vousden KH. Reglarea metabolismului celular și a hipoxiei prin p53. Primăvară Rece Harb Perspect Med (2016) 6(7):211-30. doi:10.1101 / cshperspect.a026146
CrossRef Textul Complet | Google Scholar
10. Zhang C, Liu J, Wu R, Liang Y, Lin M, Liu J, și colab., Supresorul tumoral p53 reglează negativ glicoliza stimulată de hipoxie prin rrad țintă. Oncotarget (2014) 5(14):5535-46. doi:10.18632 / oncotarget.2137
PubMed Abstract | CrossRef Textul Complet | Google Scholar
17. Lee M, Yoon JH. Interacțiunea metabolică între glicoliză și oxidarea mitocondrială: efectul Warburg invers și implicarea sa terapeutică. Lumea J Biol Chem (2015) 6(3):148-61. doi:10.4331 / wjbc.v6.i3.,148
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Dumont P, Leu JI, Della Pietra AC III, George DL, Murphy M. The codon 72 polymorphic variants of p53 have markedly different apoptotic potential. Nat Genet (2003) 33(3):357–65. doi:10.1038/ng1093
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Kung CP, Khaku S, Jennis M, Zhou Y, Murphy ME., Identification of TRIML2, a novel p53 target, that enhances p53 SUMOylation and regulates the transactivation of proapoptotic genes. Mol Cancer Res (2015) 13(2):250–62. doi:10.1158/1541-7786.MCR-14-0385
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Bitti ML, Saccucci P, Capasso F, Piccinini S, Angelini F, Rapini N, et al. Genotypes of p53 codon 72 correlate with age at onset of type 1 diabetes in a sex-specific manner. J Pediatr Endocrinol Metab (2011) 24(7–8):437–9. doi:10.1515/jpem.,2011.058
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Kung CP, Liu Q, Murphy ME. The codon 72 polymorphism of p53 influences cell fate following nutrient deprivation. Cancer Biol Ther (2017) 18(7):484–91. doi:10.1080/15384047.2017.1323595
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sanchez-Macedo N, Feng J, Faubert B, Chang N, Elia A, Rushing EJ, et al., Depleția romanului p53-țintă gena carnitină palmitoyltransferase 1C întârzie creșterea tumorii în modelul tumorii de tip neurofibromatoza I. Moartea Celulelor Diferă (2013) 20(4):659-68. doi:10.1038 / cdd.2012.168
PubMed Abstract | CrossRef Textul Complet | Google Scholar
30. Ettinger SL, Sobel R, Whitmore TG, Akbari M, Bradley DR, Gleave ME, și colab. Dereglare de steroli răspuns element-binding proteine și în aval efectori în cancerul de prostată în timpul progresia la androgeni independență., Cancer Res (2004) 64(6):2212–21. doi:10.1158/0008-5472.CAN-2148-2
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Clendening JW, Pandyra A, Boutros PC, El Ghamrasni S, Khosravi F, Trentin GA, et al. Dysregulation of the mevalonate pathway promotes transformation. Proc Natl Acad Sci U S A (2010) 107(34):15051–6. doi:10.1073/pnas.,0910258107
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Yang WS, Kim KJ, Gaschler MM, Patel M, Shchepinov MS, Stockwell BR. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis. Proc Natl Acad Sci U S A (2016) 113(34):E4966–75. doi:10.1073/pnas.1603244113
PubMed Abstract | CrossRef Full Text | Google Scholar
54., Luo JL, Yang Q, Tong WM, Hergenhahn M, Wang ZQ, Hollstein M. Knock-la șoareci cu un chimeric uman/murin genei p53 dezvolta în mod normal și arată de tip sălbatic p53 răspuns la deteriorarea ADN-ului agenți: un nou instrument de cercetare biomedicală. Oncogen (2001) 20(3):320-8. doi:10.1038 / sj.onc.1204080
PubMed Abstract | CrossRef Textul Complet | Google Scholar
57. Liu DS, Duong CP, Haupt S, Montgomery KG, casa CM, Azar WJ, și colab. Inhibarea sistemului XC – / axa glutationului vizează selectiv cancerele cu acumulare mutantă-p53., Nat Commun (2017) 8:14844. doi:10.1038/ncomms14844
PubMed Abstract | CrossRef Full Text | Google Scholar















